La circulation utérine est exquisément sensible à la stimulation œstrogénique, répondant avec un degré de vasodilatation inégalé par tout autre organe du corps à tout autre stimulus.2 Pendant le cycle ovarien, des schémas répétitifs d’UBF se produisent reflétant l’effet de la sécrétion d’œstrogènes et les effets modulateurs de la progestérone. Ces schémas cycliques se manifestent de la manière la plus spectaculaire chez les animaux dont les phases du cycle préovulatoire sont courtes, comme la vache, la truie et la brebis, et sont illustrés à la figure 1 avec les niveaux périphériques d’œstrogènes et de progestérone.3, 4, 5 Après la conception chez ces espèces, les schémas d’UBF sont similaires à ceux des animaux non gravides jusqu’à ce que l’interdigitation des tissus maternels et fœtaux se produise 17 à 28 jours plus tard ; on observe alors une augmentation définitive et progressive de l’UBF qui se poursuit jusqu’à la grossesse à terme. Puisque l’érosion de l’endomètre par le trophoblaste fœtal se produit beaucoup plus tôt après la conception chez le primate, il est raisonnable de présumer que l’UBF augmente plus tôt chez ces espèces, bien que de telles réponses n’aient jamais été observées. La figure 2 illustre les tendances générales de l’UBF total, de l’UBF par unité de poids de l’utérus et de son contenu, de la fraction de l’UBF alimentant le placenta et du poids du fœtus tout au long de la grossesse ovine. La période entre le 17e et le 70e jour de gestation est associée aux changements les plus rapides de l’UBF et du PBF et correspond au moment de la placentation définitive chez cette espèce. Par des mécanismes incomplètement compris, les vaisseaux sanguins qui alimentent le placenta se dilatent progressivement au cours de cette période, ce qui entraîne simultanément une augmentation absolue de l’UBF total et un transfert de ce sang des tissus non placentaires vers les tissus placentaires.* Avec la maturation placentaire ultérieure, la fraction de l’UBF qui alimente le placenta et la quantité absolue de PBF augmentent, mais à des taux plus similaires à ceux de la croissance fœtale ; ainsi, au cours de la dernière moitié de la grossesse, l’UBF par unité de poids de l’utérus et de son contenu est essentiellement constant. Pendant cette même période, la quantité d’oxygène extraite de chaque millilitre de sang est constante et, par conséquent, la quantité d’oxygène délivrée par poids donné de l’utérus gravide est également constante.6 Des études corrélatives menées chez la femme indiquent des schémas homéostatiques similaires de 10 à 40 semaines de gestation et une consommation d’oxygène similaire (environ 10 ml/kg).7 Puisque la femme délivre la même quantité d’oxygène à des taux de PBF inférieurs à ceux de la brebis (~150 contre ~270 ml/kg), il s’ensuit que le placenta humain est plus efficace à cet égard. Ainsi, pour des fœtus de poids similaire, moins d’UBF absolu est nécessaire et la charge de la grossesse sur le cœur est diminuée.
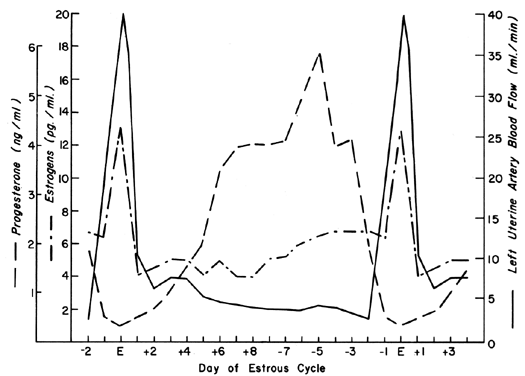 Fig. 1. Schéma unilatéral du flux sanguin utérin au cours du cycle œstral ovin représenté avec les niveaux sériques rapportés d’œstrogènes et de progestérone.(Adapté de Greiss FC, Jr, Anderson SG : Am J Obstet Gynecol 103:629, 1969 ; Yuthasastrakosol P et al : J Reprod Fertil 43:57, 1975.)
Fig. 1. Schéma unilatéral du flux sanguin utérin au cours du cycle œstral ovin représenté avec les niveaux sériques rapportés d’œstrogènes et de progestérone.(Adapté de Greiss FC, Jr, Anderson SG : Am J Obstet Gynecol 103:629, 1969 ; Yuthasastrakosol P et al : J Reprod Fertil 43:57, 1975.)
 Fig. 2. Schémas longitudinaux du flux sanguin utérin et de sa distribution au cours de la grossesse ovine.
Fig. 2. Schémas longitudinaux du flux sanguin utérin et de sa distribution au cours de la grossesse ovine.
Les modifications de la FBP sont accomplies par une vasodilatation toujours plus importante des vaisseaux sanguins alimentant le placenta tout au long de la gestation. Cependant, à tout moment au cours des deuxième et troisième trimestres, il ne peut pratiquement plus y avoir de vasodilatation aiguë de ces vaisseaux. Par conséquent, pour maintenir un apport constant d’oxygène pendant les épisodes de réduction du PBF, il faut augmenter l’extraction d’oxygène (Fig. 3). D’après les données rapportées, il semblerait que la limite de l’augmentation de l’extraction soit double. Ainsi, le PBF doit être réduit de plus de 50 % avant que l’apport d’oxygène ne soit diminué. Ces considérations supposent que le taux de PBF homéostatique était optimal avant la réduction du débit. Nous savons cependant que les niveaux homéostatiques peuvent être sous-optimaux soit de façon subaiguë, comme dans le cas de la toxémie, soit de façon chronique, comme dans le cas des néphropathies. Dans de tels cas, le facteur de sécurité, c’est-à-dire le pourcentage de réduction du PBF avant que l’apport d’oxygène ne soit compromis, est réduit. Il faut toujours en tenir compte lorsqu’on évalue l’effet d’un stimulus aigu sur le fœtus.
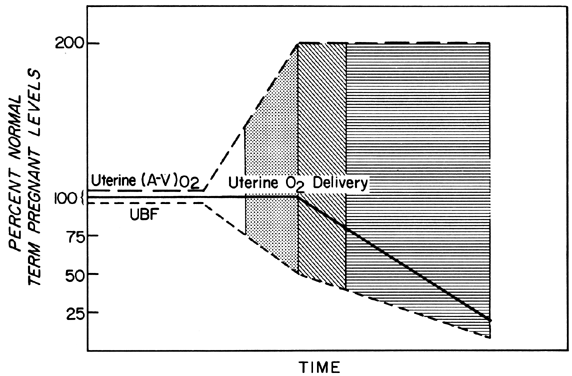 Fig. 3. Changements dans l’extraction d’oxygène artério-veineuse utérine-(A-V)02 – en réponse aux réductions du débit sanguin utérin pendant la seconde moitié de la gestation ovine. Puisque (A-V)02 peut être doublé, l’apport d’oxygène utérin sera maintenu à des niveaux homéostatiques jusqu’à ce que le débit sanguin utérin soit réduit de plus de 50%. Les zones claires, pointillées et alignées indiquent les degrés hypothétiques de réserve fœtale lorsqu’ils sont définis en fonction du débit sanguin placentaire optimal et sont utilisées pour indiquer des niveaux similaires de réserve fœtale dans les illustrations suivantes. (Adapté de Huckabee WE, Metcalfe J, Prystowsky H et al : Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
Fig. 3. Changements dans l’extraction d’oxygène artério-veineuse utérine-(A-V)02 – en réponse aux réductions du débit sanguin utérin pendant la seconde moitié de la gestation ovine. Puisque (A-V)02 peut être doublé, l’apport d’oxygène utérin sera maintenu à des niveaux homéostatiques jusqu’à ce que le débit sanguin utérin soit réduit de plus de 50%. Les zones claires, pointillées et alignées indiquent les degrés hypothétiques de réserve fœtale lorsqu’ils sont définis en fonction du débit sanguin placentaire optimal et sont utilisées pour indiquer des niveaux similaires de réserve fœtale dans les illustrations suivantes. (Adapté de Huckabee WE, Metcalfe J, Prystowsky H et al : Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
*Chez l’homme et les primates subhumains, les artérioles spiralées qui vont alimenter l’espace intervillaire (environ une par cotylédon placentaire) perdent leurs connexions capillaires et se dilatent environ dix fois suite au remplacement des parois des vaisseaux par le trophoblaste. Ce processus peut s’étendre jusqu’à ou sous la jonction myoendométriale, transformant littéralement les artérioles spiralées en artères spiralées. Le sang circulant dans ces vaisseaux sanguins modifiés dans l’espace intervillaire constitue le PBF.
Dans l’espèce ovine, de multiples zones discrètes d’endomètre appelées caroncules sont présentes à l’état non gravide. Pendant la grossesse, l’interdigitation des tissus fœtaux et maternels se produit dans ces caroncules, qui s’agrandissent pour devenir des cotylédons placentaires individuels. Le sang qui circule dans ces zones constitue collectivement le PBF. Bien que les vaisseaux sanguins artériels cotylédonaires se dilatent de manière significative, ils ne contiennent pas d’éléments trophoblastiques, le transfert maternel-fœtal se fait par une interface capillaire-capillaire, et aucun espace intervillaire n’est présent.
Réactions dynamiques de la circulation utérine
Les vaisseaux sanguins de l’utérus non gravide répondent de manière similaire à ceux de tout autre organe musculaire, à l’exception de leur réactivité unique à la stimulation œstrogénique, de leur réponse aux agents anesthésiques locaux et, éventuellement, de leur réponse aux prostaglandines (tableau 1). Pendant la grossesse, les vaisseaux sanguins qui alimentent le placenta se dilatent progressivement, atteignant un état dans lequel une dilatation aiguë supplémentaire minimale ou nulle peut se produire.24 Par conséquent, les stimuli qui évoquent une vasodilatation dans l’utérus non gravide sont inefficaces après la placentation définitive. Cependant, les vaisseaux placentaires conservent leur capacité de vasoconstriction comme dans l’état de non-grossesse. Puisque la FBP représente environ 80 à 90 % de la FBU totale lors d’une grossesse à terme, les réponses vasculaires utérines totales apparaîtront comme celles des vaisseaux placentaires. Ce point est souvent mal interprété et il faut se rappeler que les réponses des vaisseaux non placentaires sont les mêmes, que la grossesse soit présente ou non.
TABLE 1. Réponses des vaisseaux utérins non gravides*
|
Vasoconstriction |
Vasodilatation |
|
α-.Stimulation adrénergique |
β-Stimulation adrénergique |
|
(dopamine, épinéphrine, |
(isoprotérénol, épinéphrine)8,9,16 |
|
norépinéphrine)8,9,10 |
Acétylcholine et agents parasympathomimétiques23 |
|
Agents sympathomimétiques agents11 |
Adénosines17 |
|
(médicaments vasopresseurs) |
Bradykinine17,18 |
|
Hypoxémie(sévère)12 |
Cyanure19 |
|
Agents anesthésiques locaux |
Substances strogènes |
|
(administration intra-artérielle)13,14 |
(effet retardé mais prolongé)2 |
|
Nicotine |
Glucosamine |
|
(médiation α-adrénergique)15 |
( ? effet osmotique)21 |
|
Hypoxémie (légère)12 |
|
|
Ischémie19 |
|
|
Nitroglycérine19 |
|
|
Prostaglandines E1, E2, et I18,22 |
|
|
Polypeptide intestinal vasoactif20 |
* La dilatation marquée des vaisseaux sanguins alimentant le placenta et la distribution prépondérante du flux sanguin utérin vers le placenta oblitèrent les réponses gravides ; Par conséquent, les effets des stimuli vasodilatateurs pendant la grossesse sont controversés. Lorsqu’elles sont testées, les réponses vasculaires non placentaires sont similaires aux réponses non gravides.
La structure hémochoriale du placenta humain ajoute un facteur unique à ceux qui contrôlent normalement le flux sanguin dans les autres lits vasculaires. C’est-à-dire que le sang traverse les artères spiralées pour entrer dans l’espace intervilleux semblable à un marécage, perfuse les villosités fœtales, puis retourne dans la circulation générale par de nombreuses veines collectrices dans la plaque basale. En fait, le sang quitte les canaux vasculaires normaux pour circuler dans un nouvel espace extravasculaire greffé sur l’utérus pour la durée de la grossesse. Comme l’espace intervillaire se trouve à l’intérieur de la cavité utérine et que le placenta est une structure flexible, la pression générée par la contraction du myomètre sera transmise également à la cavité amniotique et à l’espace intervillaire. Ainsi, un facteur étranger au contrôle vasculaire habituel, l’activité du myomètre, peut modifier la pression de l’espace intervillaire et influencer la FBP par ses effets sur la pression de perfusion. La figure 4 présente une représentation schématique du flux sanguin vers les tissus non placentaires et vers un seul cotylédon, ainsi que les formules pertinentes pour le contrôle de chacun. Il faut noter que ces formules ne sont que des applications de la loi d’Ohm à ces situations cardiovasculaires individuelles.
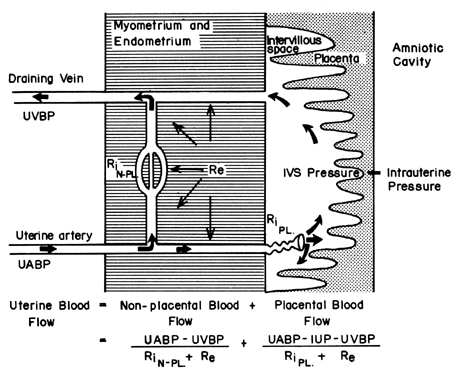 Fig. 4. Circulations non placentaire et placentaire et les facteurs affectant chacune d’elles de l’utérus du primate. La relation entre ces facteurs et le flux sanguin distribué est définie dans l’équation suivante. UABP, pression sanguine artérielle utérine ; UVBP, pression sanguine veineuse utérine ; Re, résistance vasculaire extrinsèque ; RiN-PL et RiPL, résistance vasculaire intrinsèque causée par les réactivités des artérioles non placentaires et placentaires, respectivement.(D’après Greiss FC, Jr : MCV/Q, 8:52, 1972.)
Fig. 4. Circulations non placentaire et placentaire et les facteurs affectant chacune d’elles de l’utérus du primate. La relation entre ces facteurs et le flux sanguin distribué est définie dans l’équation suivante. UABP, pression sanguine artérielle utérine ; UVBP, pression sanguine veineuse utérine ; Re, résistance vasculaire extrinsèque ; RiN-PL et RiPL, résistance vasculaire intrinsèque causée par les réactivités des artérioles non placentaires et placentaires, respectivement.(D’après Greiss FC, Jr : MCV/Q, 8:52, 1972.)
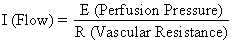
La pression de perfusion délivrant le sang aux tissus non placentaires est la différence entre les pressions sanguines artérielles et veineuses utérines. Cependant, la pression de perfusion délivrant le sang à l’espace intervillaire est la différence entre la pression sanguine artérielle utérine et la pression de l’espace intervillaire. Cette dernière est mieux approchée par la pression du liquide amniotique (IUP). Dans un organe musculaire, les facteurs de résistance comprennent la résistance due à la réactivité du muscle lisse vasculaire, ou résistance intrinsèque (Ri), et la pression exercée sur les vaisseaux sanguins lorsqu’ils traversent le myomètre en contraction, ou résistance extrinsèque (Re). Il devrait donc être évident que les contractions utérines peuvent affecter la FBP par deux mécanismes : en augmentant la Re et en réduisant la pression de perfusion placentaire.
Dans la pratique clinique, trois caractéristiques majeures du contrôle vasculaire placentaire sont importantes. Il s’agit de la relation entre la pression de perfusion et le débit, des réponses des artères spiralées aux stimuli vasoactifs et des effets des contractions du myomètre. De plus, les effets uniques des agents anesthésiques locaux doivent être appréciés.
Relation pression-débit
Lorsqu’on observe les changements de l’UBF secondaires aux réductions de la pression de perfusion pendant la quiescence du myome et du procès, une relation en ligne droite avec une pente de un peut être développée (Fig. 5). Ceci reflète la nature largement dilatée de la vascularisation placentaire et indique que la FBP diminuera de façon presque identique à la diminution de la pression de perfusion. Comme la pression veineuse utérine est assez constante dans la plupart des circonstances, les variations de la pression sanguine systémique (PSM) peuvent être utilisées pour estimer les variations de la FBP. En d’autres termes, une diminution de 25 % de la pression artérielle moyenne devrait entraîner une diminution de 25 % du PBF. Ces mesures doivent cependant être effectuées en décubitus latéral, car il a été démontré que la pression de l’utérus gravide sur l’aorte seule fait baisser la pression sanguine dans la zone pelvienne en dessous de celle observée dans l’artère brachiale.
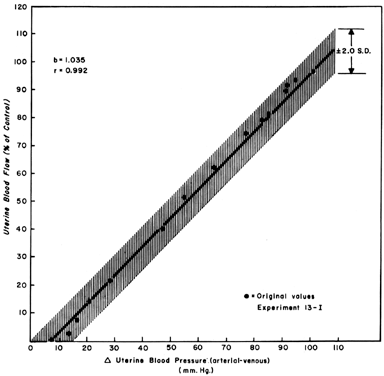 Fig. 5. Ligne de régression pression-débit déterminée à partir de données proportionnelles regroupées chez des brebis enceintes à terme. Comme la relation est linéaire, le débit sanguin utérin variera avec et proportionnellement à tout changement de la pression de perfusion.(D’après Greiss FC, Jr : Am J Obstet Gynecol 96:41, 1966.)
Fig. 5. Ligne de régression pression-débit déterminée à partir de données proportionnelles regroupées chez des brebis enceintes à terme. Comme la relation est linéaire, le débit sanguin utérin variera avec et proportionnellement à tout changement de la pression de perfusion.(D’après Greiss FC, Jr : Am J Obstet Gynecol 96:41, 1966.)
Réponses aux stimuli vasoactifs
Puisque les artères spiralées s’approchent de la dilatation maximale à l’état de repos, les agents ou stimuli vasodilatateurs ont peu ou pas d’effet même si des récepteurs pour ces agents sont présents. Cependant, les muscles lisses de ces vaisseaux sont extrêmement sensibles aux agents ou stimuli vasoconstricteurs, plus que la plupart des autres lits vasculaires périphériques (Fig. 6). Cela signifie que, bien que le BMP puisse augmenter en réponse à une stimulation par un vasopresseur à action périphérique tel que la phényléphrine, l’augmentation proportionnelle de la résistance vasculaire placentaire (Ri) est tellement plus importante que l’effet net est une diminution marquée de la FBP. De telles différences dans la sensibilité aux vasoconstricteurs doivent être prises en compte chaque fois qu’un médicament vasopresseur est indiqué. L’utilisation d’un médicament à action plus centrale comme l’éphédrine, bien que provoquant une petite quantité de vasoconstriction placentaire, entraînera une amélioration proportionnellement plus importante de la PBP avec une augmentation absolue de la PBF.
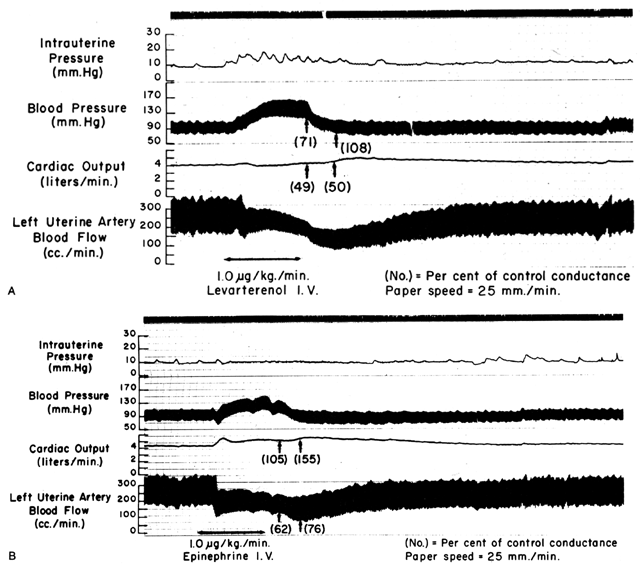 Fig. 6. Enregistrements originaux montrant les effets du ( A) lévartérénol (norépinéphrine) et ( B) de l’épinéphrine par voie intraveineuse sur la pression artérielle maternelle, le débit cardiaque et le flux sanguin utérin lors d’une grossesse ovine à terme. Les changements proportionnels par rapport aux niveaux de contrôle de la conductance systémique et utérine (l’inverse de la résistance) ont été insérés entre parenthèses. Notez que la diminution de la conductance utérine (augmentation de la résistance) dépasse celle de la conductance systémique avec les autres agents. (D’après Greiss FC, Jr : Obstet Gynecol 21:295, 1963. Courtoisie de Harper & Row, Publishers.)
Fig. 6. Enregistrements originaux montrant les effets du ( A) lévartérénol (norépinéphrine) et ( B) de l’épinéphrine par voie intraveineuse sur la pression artérielle maternelle, le débit cardiaque et le flux sanguin utérin lors d’une grossesse ovine à terme. Les changements proportionnels par rapport aux niveaux de contrôle de la conductance systémique et utérine (l’inverse de la résistance) ont été insérés entre parenthèses. Notez que la diminution de la conductance utérine (augmentation de la résistance) dépasse celle de la conductance systémique avec les autres agents. (D’après Greiss FC, Jr : Obstet Gynecol 21:295, 1963. Courtoisie de Harper & Row, Publishers.)
Contractions myométriales
Agissant par les deux mécanismes discutés ci-dessus, l’augmentation de Re et la diminution de la pression de perfusion, les contractions myométriales diminuent la FBP en proportion directe de l’intensité et de la durée de chaque contraction. Cette relation est si précise qu’un tracé de la pression intra-utérine est presque une image inverse exacte de la FBP (Fig. 7). L’augmentation de la fréquence des contractions diminue la PBF pendant une unité de temps donnée en diminuant la durée de la diastole myométriale, moment où la PBF est à un niveau homéostatique. De plus, si le tonus d’intercontraction est élevé, comme dans le cas d’un décollement placentaire, le PBF d’intercontraction sera proportionnellement réduit. Des études radioangiographiques chez les primates et les femmes sous-humaines montrent que pendant l’acmé des contractions myométriques d’intensité moyenne, le PBF cesse.25 Il est donc évident que le travail est intrinsèquement stressant pour le fœtus, puisque la quantité moyenne de PBF perfusant les villosités fœtales par période de temps donnée diminue progressivement à mesure que la fréquence et l’intensité des contractions utérines augmentent.
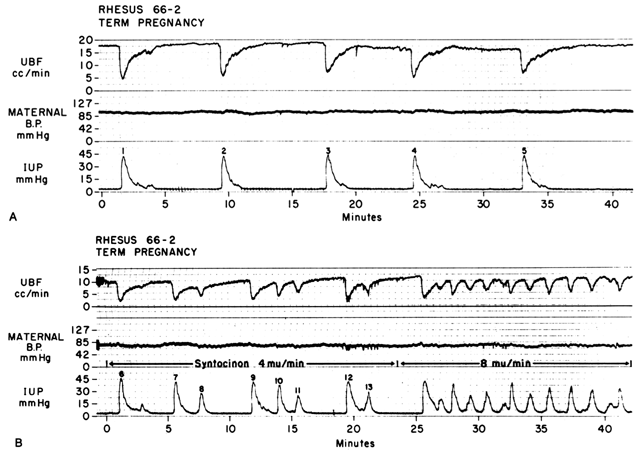 Fig. 7. A. Relation entre le flux sanguin utérin (UBF) et les contractions utérines pendant le travail spontané chez un singe rhésus. Notez la relation inverse de l’image, les fortes diminutions de l’UBF au début des contractions, et la récupération plus lente de l’UBF des niveaux basaux. L’UBF n’a retrouvé ses niveaux basaux que pendant le tonus « normal ». B. Effet de l’augmentation de la fréquence des contractions sur l’UBF produit par la stimulation à l’ocytocine du travail spontané montré en A. Notez que la durée des phases de tonus normal est réduite. Le taux d’UBF atteint entre les contractions dépend de l’intensité de la contraction précédente et de la durée de la phase de tonus normal. Après les contractions 7 et 12, la récupération du débit était incomplète car la contraction suivante s’est produite sans phase de tonus normal.(D’après Greiss FC, Jr, Anderson SG : Clin Obstet Gynecol 11:96, 1968. Courtoisie de Harper & Row, Publishers.)
Fig. 7. A. Relation entre le flux sanguin utérin (UBF) et les contractions utérines pendant le travail spontané chez un singe rhésus. Notez la relation inverse de l’image, les fortes diminutions de l’UBF au début des contractions, et la récupération plus lente de l’UBF des niveaux basaux. L’UBF n’a retrouvé ses niveaux basaux que pendant le tonus « normal ». B. Effet de l’augmentation de la fréquence des contractions sur l’UBF produit par la stimulation à l’ocytocine du travail spontané montré en A. Notez que la durée des phases de tonus normal est réduite. Le taux d’UBF atteint entre les contractions dépend de l’intensité de la contraction précédente et de la durée de la phase de tonus normal. Après les contractions 7 et 12, la récupération du débit était incomplète car la contraction suivante s’est produite sans phase de tonus normal.(D’après Greiss FC, Jr, Anderson SG : Clin Obstet Gynecol 11:96, 1968. Courtoisie de Harper & Row, Publishers.)
Agents anesthésiques locaux
Ces médicaments peuvent exercer des effets sur un lit vasculaire directement, comme après une injection intravasculaire par inadvertance, et indirectement, à la suite de la paralysie des nerfs autonomes qui maintiennent le tonus vasculaire normal. Dans la plupart des organes, les injections intravasculaires n’ont pas d’effets significatifs sur la résistance vasculaire. Cependant, les vasculatures utérine et placentaire répondent à de tels stimuli par une vasoconstriction significative. De plus, le myomètre est variablement stimulé par ces médicaments (Fig. 8). Seules ou combinées, ces réponses diminuent le PBF. Après une anesthésie par bloc paracervical administrée pendant le travail, une bradycardie fœtale retardée peut se produire. La meilleure hypothèse pour expliquer la réponse fœtale est que les agents anesthésiques locaux sont injectés à proximité des artères utérines et qu’en raison de leur excellente pénétration, ils traversent les parois artérielles pour provoquer leurs effets utérins diminuant le PBF et provoquant une hypoxie fœtale.
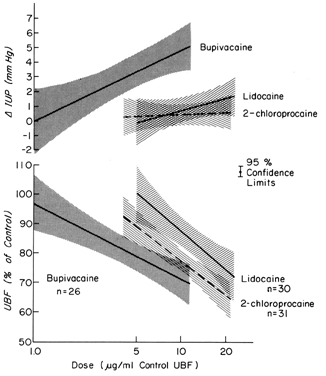 Fig. 8. Relations dose-réponse des agents anesthésiques locaux administrés directement dans l’artère utérine à la conductance vasculaire utérine et à la pression intra-utérine pendant la gestation ovine. Les niveaux de dose effective se situent dans les fourchettes observées chez les fœtus pendant la bradycardie consécutive à l’anesthésie du bloc paracervical.(Tiré de Fishburne JI, Jr et al : Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Courtoisie de The C. V. Mosby Company.)
Fig. 8. Relations dose-réponse des agents anesthésiques locaux administrés directement dans l’artère utérine à la conductance vasculaire utérine et à la pression intra-utérine pendant la gestation ovine. Les niveaux de dose effective se situent dans les fourchettes observées chez les fœtus pendant la bradycardie consécutive à l’anesthésie du bloc paracervical.(Tiré de Fishburne JI, Jr et al : Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Courtoisie de The C. V. Mosby Company.)
