- Méthodologie
- Figure1:Imaging pathway
- Approche diagnostique et bilan initial
- Cytologie urinaire
- Imagerie initiale chez les patients à faible risque
- Figure2:Carcinome à cellules transitionnelles de la vessie (US)
- Figure3 :Carcinome rénal à cellules transitionnelles (US et RPUG)
- Imagerie initiale chez les patients à haut risque
- Figure4:TCC vésical et rénal (CTU)
- Figure5 :TCC vésical (IRM)
- Figure6 :Urétérique TCC (CTU)
- Figure7:Tumeur de la vessie (cystoscopie)
- Autres études d’imagerie
- Suivi clinique
- Tableau2 : Indications d’orientation
Méthodologie
Une recherche électronique d’août à septembre 2015 sur MEDLINE à travers PubMed, et la Cochrane Database of Systematic reviews a permis d’identifier des articles originaux pertinents, des revues systématiques et des directives fondées sur des preuves de la période 2008-septembre 2015, qui ont été inclus. Les termes suivants ont été utilisés en combinaison pendant l’examen de la littérature pour produire la liste des articles examinés : « indolore », « macroscopique », « visible » ET « hématurie », « reins », « uretères », « vessie », « cancer de la vessie », « voies urinaires », « cytologie », « imagerie diagnostique », « radiographie », « ultrasonographie », « échographie », « pyélographie », « tomographie, rayons X calculés » ET « urographie », « résonance magnétique » ET « urographie », « intraveineuse » OU « excrétoire » ET « urographie », « urologie » OU « néphrologie » ET « orientation » OU « consultation », « cystoscopie », « directives ».
Une recherche manuelle pour identifier d’autres publications pertinentes à partir des études extraites a également été effectuée pour la revue. Au total, 84 articles en texte intégral ont été présélectionnés et évalués pour leur admissibilité. Les articles décrivant des études originales, des lignes directrices fondées sur des preuves ou des examens systématiques ont été inclus, tandis que les études pédiatriques et animales ont été exclues. Les articles qui n’étaient pas en anglais ou dont le texte était limité ont également été exclus, après quoi 59 articles finaux ont été inclus et classés selon les niveaux de preuve du Oxford Centre for Evidence-Based Medicine . Les algorithmes basés sur des preuves ont été produits et révisés par les membres du comité éditorial d’experts de Diagnostic Imaging Pathways (DIP) conformément aux processus habituels de DIP (http://www.imagingpathways.health.wa.gov.au/index.php/production/processes-for-creating-and-managing-content), en consultation avec le rédacteur en chef, un urologue et un néphrologue. L’algorithme final (figure 1), qui est également disponible sur le site Imaging Pathways (outil de décision clinique en ligne : Dulku G. Hématurie macroscopique indolore. Diagnostic Imaging Pathways ; septembre 2015), fournit des conseils et des recommandations en matière d’imagerie pour les patients adultes présentant une hématurie visible indolore inexpliquée.
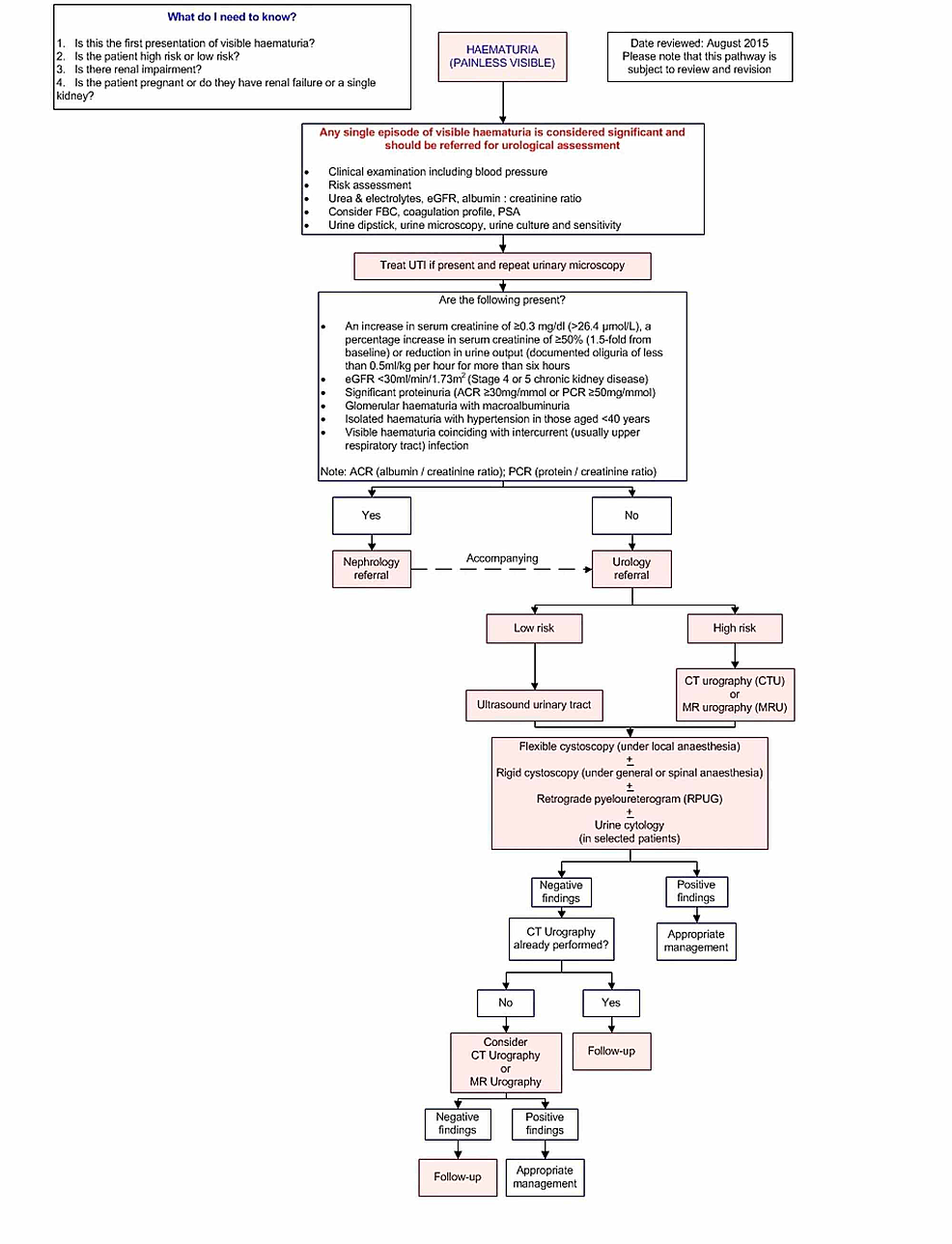
Figure1:Imaging pathway
Ce pathway fournit des orientations sur l’imagerie des patients adultes présentant une hématurie visible indolore inexpliquée.
eGFR : Taux de filtration glomérulaire estimé ; FBC : Formule sanguine complète ; PSA : antigène spécifique de la prostate ; ACR : rapport albumine/créatinine ; PCR : Protein/creatinine ratio ; UTI : infection des voies urinaires.
Notre examen n’a pas inclus une analyse des conseils d’imagerie pour la détection des calculs des voies urinaires comme cause d’hématurie, car généralement cela est associé à la douleur. Nous nous sommes principalement concentrés sur le guide d’imagerie et la littérature de soutien pour l’hématurie visible indolore avec des malignités urologiques comme cause potentielle.
Approche diagnostique et bilan initial
Le consensus de la British Association of Urological Surgeons (BAUS) et de l’Interregional Chiefs of Urology Service (IRCUS), Kaiser Permanente, Amérique a suggéré que tout épisode unique d’HV est considéré comme significatif et devrait être référé pour une évaluation urologique qui, dans presque tous les cas, inclura une cystoscopie .
En attendant, des investigations peuvent être menées pour identifier les causes transitoires et traitables, et organiser une imagerie primaire. Les patients atteints d’HV et d’une infection urinaire (IU) avérée doivent tout de même faire l’objet d’une recherche de malignité concomitante, car la malignité coexiste fréquemment avec une infection ou agit comme un nidus à partir duquel une infection peut se propager . L’infection urinaire doit être traitée avant la cystoscopie, car il existe un risque d’uro-sepsie si la cystoscopie est effectuée en présence d’une IU active.
La présence d’une HV ne doit pas non plus être attribuée à un traitement anticoagulant ou antiplaquettaire et ces patients doivent également être évalués indépendamment de ces médicaments, car des rapports de malignité sous-jacente ont été trouvés chez 24% et 7% des patients dans deux séries distinctes .
Donc, le rôle principal de l’imagerie est d’identifier les patients ayant une cause maligne d’hématurie. Cependant, le choix de la modalité d’imagerie dépend de divers facteurs individuels du patient (par exemple, l’âge, les facteurs de risque de malignité, la fonction rénale et la grossesse) et d’autres facteurs, tels que la politique et la pratique locales, le rapport coût-efficacité et la disponibilité des ressources.
Depuis toujours, les examens de première ligne comprennent la radiographie conventionnelle, l’échographie rénale (US) et/ou la pyélographie intraveineuse (PIV) en combinaison avec la cystoscopie. Cette dernière est importante car de nombreuses lésions hémorragiques des voies urinaires surviennent dans la vessie et il n’a pas encore été prouvé de manière concluante que les procédures d’imagerie sont aussi sensibles que la cystoscopie pour diagnostiquer la plupart d’entre elles .
Les examens de deuxième intention ont inclus l’urogramme de tomographie computérisée multidétecteur (UTCM) et l’urographie par résonance magnétique (UMR), souvent réalisés uniquement si les examens de première intention révèlent une anomalie.
L’IRCUS a recommandé qu’une UTCM modifiée ou une PIV avec une US rénale simultanée soit réalisée pour les patients présentant une hématurie significative. Il n’est pas nécessaire de réaliser une tomographie rénale lors d’une urographie intraveineuse (UIV) si une US rénale simultanée est effectuée. Cette approche réduira l’exposition aux rayonnements ionisants.
Lorsqu’il recommandait l’imagerie pour l’évaluation de l’HV, Cowan avait suggéré que le type de modalité d’imagerie employé soit basé sur un score de risque, les patients >40 ans devant subir une urographie CT tandis que les patients <40 ans devaient subir une échographie comme modalité d’imagerie de première ligne . La Société européenne de radiologie urogénitale (ESUR) a suggéré que l’investigation des patients à faible risque nécessite une échographie et une cystoscopie et que les patients à haut risque nécessitent une UTC et une cystoscopie pour une imagerie complète des reins et des voies urinaires .
Cytologie urinaire
La cytologie urinaire, bien que controversée, est essentielle pour l’évaluation du carcinome à cellules urothéliales du haut appareil urinaire (UUT-UCC) et les directives de l’Association européenne d’urologie (EAU) recommandent que la cytologie urinaire soit réalisée dans le cadre du bilan diagnostique standard . La cytologie urinaire a une sensibilité de 25%, une spécificité de 91%, une valeur prédictive positive élevée mais une faible valeur prédictive négative .
Cependant, la cytologie urinaire a un taux élevé de faux négatifs pour la détection de la malignité et une cytologie négative ne peut jamais exclure complètement la présence d’une tumeur de la vessie, la cystoscopie est justifiée dans tous les cas.
Les nombreux tests urinaires disponibles dans le commerce pour les biomarqueurs véhiculés par l’urine comprennent BTA TRAK, ImmunoCyt/uCyt+, CxBladder, Nuclear Matrix Protein 22 (NMP-22) et UroVysion (FISH), bien que ceux-ci puissent manquer une proportion significative de patients atteints de cancer de la vessie, en particulier lorsque sa précision est faible pour les tumeurs de bas stade et de bas grade . Pour ces raisons, aucun consensus n’a été atteint sur le rôle de la cytologie urinaire et/ou des marqueurs de tumeurs de la vessie dans l’évaluation des patients présentant une hématurie .
Imagerie initiale chez les patients à faible risque
L’ESUR avait suggéré que l’investigation des patients à faible risque nécessite une US et une cystoscopie et que les patients à haut risque nécessitent une UTC et une cystoscopie pour une imagerie complète des reins et des voies urinaires . La sensibilité de l’US n’est cependant pas suffisante pour éviter la nécessité d’une cystoscopie en raison de son manque de sensibilité dans la détection des petites tumeurs de la vessie, en particulier celles qui ont un diamètre inférieur à 0,5 cm .
L’échographie (US) est importante dans l’évaluation initiale de l’hématurie et, en plus d’être facilement disponible et peu coûteuse, elle n’implique aucune exposition aux rayonnements ionisants et est particulièrement utile dans les populations sensibles aux rayonnements, comme les enfants et les femmes enceintes ou en âge de procréer. L’échographie permet également des plans de balayage illimités, ce qui permet une bonne visualisation des reins et de la vessie urinaire. En outre, les études Doppler peuvent fournir des informations supplémentaires concernant la vascularisation des masses (figure 2A, 2B) .
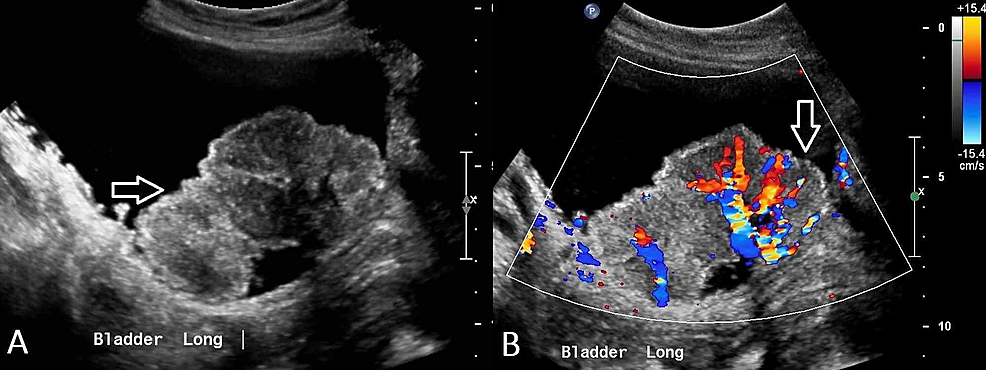
Figure2:Carcinome à cellules transitionnelles de la vessie (US)
(A) L’échographie pelvienne démontre un irrégulier, hétérogène au sein de la vessie urinaire avec de multiples lésions polypoïdales plus petites vues adjacentes, ce qui est suggestif d’un cancer de la vessie urinaire. (B) La vascularisation est démontrée au sein de cette masse.
Dans la détection des tumeurs de l’UUT, l’US a une sensibilité variable dans la détection des carcinomes urothéliaux, avec une sensibilité modérée (82%) pour la détection du carcinome des cellules rénales et une faible sensibilité (12%) pour la détection du carcinome urothélial de l’uretère . Cependant, comparée à la PIV dans la détection des anomalies de l’UUT chez les patients présentant une hématurie, l’US est plus sensible dans la détection des tumeurs rénales et vésicales, avec une sensibilité (96% contre 25%) et une valeur prédictive négative (98% contre 91%) respectivement plus élevées .
En outre, l’US est également utile pour détecter l’hydronéphrose et/ou l’hydroureter qui peuvent être une séquelle des tumeurs vésicales obstruant la jonction vésico-urétérale (Figure 3). Néanmoins, comparée à l’imagerie transversale telle que la MDCTU ou l’IRM, l’US a une sensibilité plus faible pour détecter les anomalies des voies urinaires.
L’échographie est excellente pour déterminer si une masse est kystique ou non et si une lésion kystique est un kyste simple ou minimalement compliqué ou compliqué. Les lésions qui ne sont pas des kystes simples doivent faire l’objet d’un examen complémentaire par tomographie ou IRM. L’échographie avec renforcement des contrastes (CEUS) est une alternative prometteuse pour le bilan initial des masses rénales. Les performances rapportées de l’ECUS dans l’évaluation des masses kystiques solides ou complexes suspectées suggèrent une valeur similaire de l’ECUS par rapport au CT. L’ECUS présente les avantages suivants : absence de néphrotoxicité, absence de rayonnements ionisants et possibilité d’évaluer le schéma de rehaussement en temps réel, ce qui peut être fait lors de la première consultation du patient. Cependant, la place du CEUS dans l’algorithme diagnostique doit être clarifiée.
Donc, l’utilisation de l’US comme modalité d’imagerie de première ligne dans l’évaluation de l’hématurie semble justifiée. Étant donné que l’échographie seule peut potentiellement manquer des lésions urétérales et urothéliales, une évaluation plus poussée par cystoscopie est nécessaire, tandis que la pyélo-urétographie rétrograde est un complément utile (figure 3) .
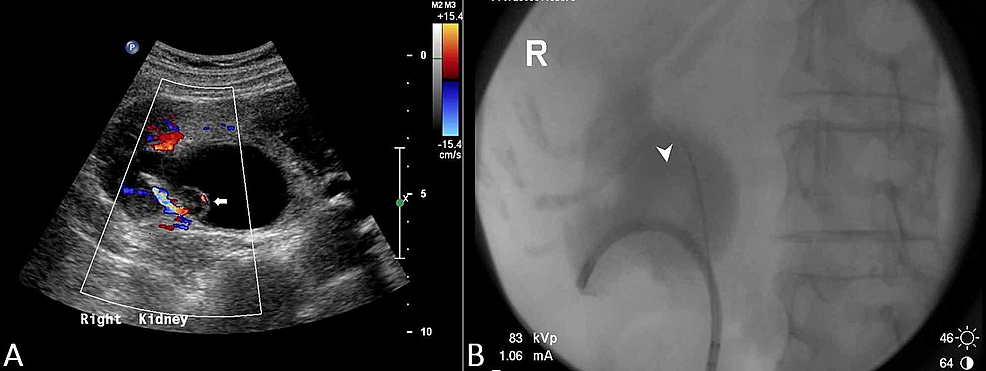
Figure3 :Carcinome rénal à cellules transitionnelles (US et RPUG)
(A) L’échographie du bassin démontre un uretère proximal droit épaissi de façon diffuse avec une lésion papillaire (flèche) vue dans le bassin rénal droit, et une hydronéphrose droite résultante. (B) Cela correspond aux résultats de la pyélo-urétérographie rétrograde (RPUG) (tête de flèche) qui évoque un carcinome à cellules transitionnelles du haut appareil urinaire droit obstruant.
Imagerie initiale chez les patients à haut risque
Urographie CT
L’urographie CT (également appelée CT IVP bien que CTU soit le terme préférable) surpasse les US, IVU, et la radiographie dans l’évaluation des masses du parenchyme rénal et des calculs des voies urinaires avec une sensibilité et une spécificité pour les tumeurs malignes urothéliales des voies supérieures de 67-100% et 93-99%, respectivement .
La stratégie diagnostique optimale pour examiner les patients à haut risque après avoir exclu l’UTI est une stratégie combinée utilisant la CTU et la cystoscopie flexible . Les « patients » présentant des lésions compatibles avec un cancer de la vessie à l’UTC doivent être orientés directement vers une cystoscopie rigide et ainsi éviter la cystoscopie souple avec un avantage de réduction de 17% du nombre de cystoscopies souples réalisées .
Pour toutes les autres catégories de patients, y compris les patients plus jeunes et les patients présentant des indications plus bénignes et des probabilités de cancer pré-test plus faibles, l’US est la modalité d’imagerie de première ligne . Des modifications de la technique d’examen de l’urographie CT, consistant en des protocoles limités et des combinaisons de phases de balayage, pourraient être utilisées en alternative ou en complément des autres examens d’imagerie .
Le protocole de balayage devrait inclure : un balayage sans contraste, une phase néphrographique (90-100 secondes après bolus de contraste) et une phase excrétrice (ou pyélographique) (5-15 minutes après administration du contraste) . Une phase cortico-médullaire est utile dans certains cas, par exemple si l’on soupçonne un pseudo-anévrisme ou une pseudo-tumeur. L’acquisition de routine pendant cette phase peut ne pas être justifiée. Les images non contrastées sont utiles pour détecter les calculs rénaux. La phase néphrographique a la plus grande sensibilité dans la détection des masses rénales, et la corrélation avec des images non rehaussées est nécessaire pour montrer un rehaussement sans équivoque. La phase pyélographique/excrétoire est utilisée pour évaluer le système collecteur, les uretères et la vessie. L’utilisation de techniques de distension urétérale telles que la compression, le bolus intraveineux de solution saline et les diurétiques donne des résultats variables. L’urographie CT peut également détecter des maladies extra-urinaires.
Contrairement aux tumeurs urothéliales, de nombreux patients atteints de malignité rénale restent asymptomatiques jusqu’à des stades avancés de la maladie, étant donné que la grande majorité des cancers rénaux sont petits et détectés de manière fortuite. De plus, les masses rénales envahissent rarement le système collecteur. Par conséquent, la triade classique de la douleur au flanc, de l’hématurie et d’une masse rénale abdominale palpable d’un carcinome à cellules rénales (CCR) ne se produit que chez 6 à 9 % des patients et, lorsqu’elle est présente, elle suggère fortement une maladie localement avancée et un mauvais pronostic. Dans ce cas, la TDM et l’IRM sont toutes deux recommandées pour le bilan et sont considérées comme égales pour la stadification et le diagnostic (Figures 4, 5). Cependant, des études comparatives entre la TDM et l’IRM à haut champ sont attendues. Dans l’intervalle, l’IRM peut être utilisée dans certains cas pour résoudre des problèmes. L’IRM pondérée en fonction de la diffusion (DWI) peut également être utile pour la détection et la caractérisation des lésions, mais les examens systématiques n’indiquent qu’une précision modérée .
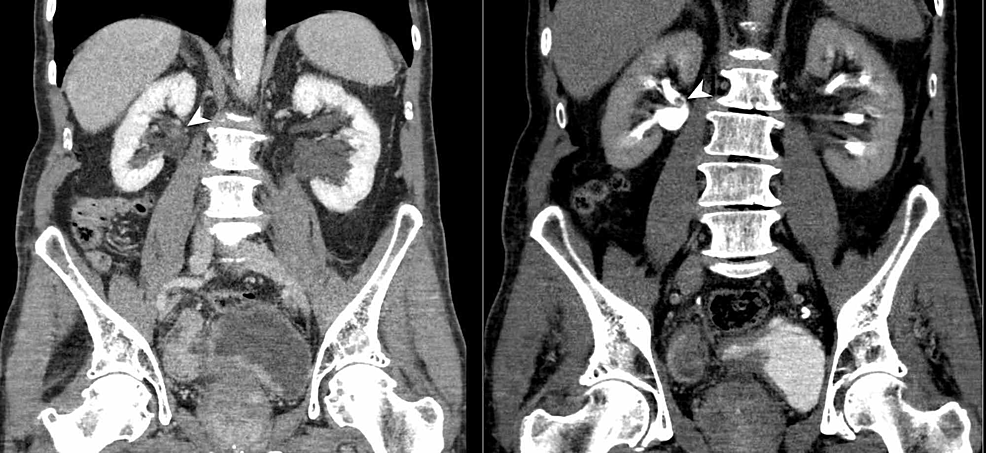
Figure4:TCC vésical et rénal (CTU)
L’urographie par scanner (reformatage coronal) démontre un épaississement irrégulier de la paroi de la vessie urinaire et également un défaut de remplissage polypoïde sessile dans la face postérieure du bassin rénal droit (têtes de flèches). Les résultats sont évocateurs d’un carcinome à cellules transitionnelles (CCT) multifocal des voies urinaires.
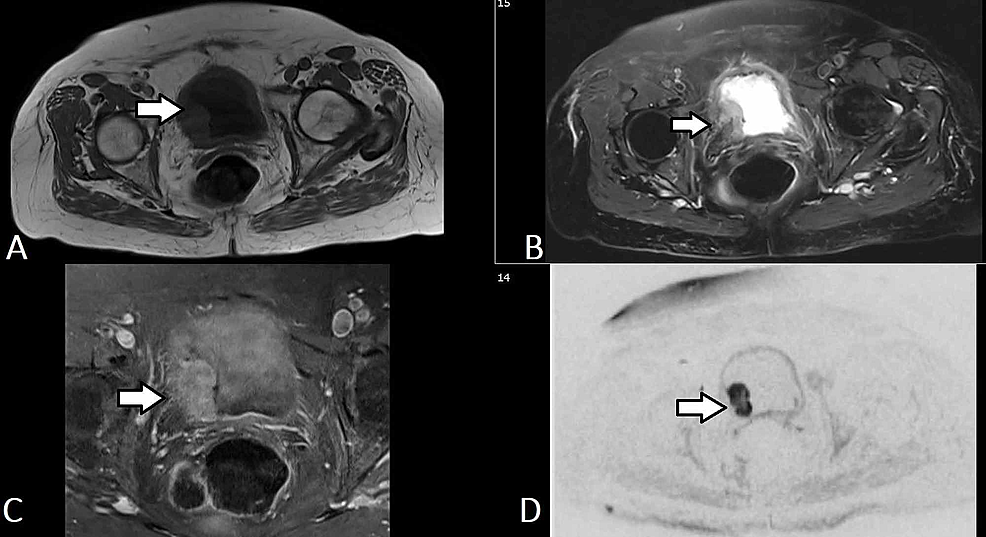
Figure5 :TCC vésical (IRM)
(A-D) Des images sélectionnées d’urographie par RM axiale du même patient montrent une masse lobulée (flèche) provenant de la paroi latérale droite de la vessie urinaire qui s’étend jusqu’au trigone et envahit la paroi de la vessie urinaire pour impliquer la couche externe sans extension dans la graisse périvésicale. La masse a un signal T1 faible et T2 élevé. La masse présente un rehaussement de contraste relativement homogène et diffus et une restriction de diffusion importante (b50/400/800). La constellation de résultats reflète une tumeur de la vessie qui est probablement classée comme T2b No Mx.
TCC : Carcinome à cellules transitionnelles
La classification de Bosniak des masses rénales kystiques est basée sur les caractéristiques d’imagerie sur la CT avec contraste et elle est utile pour prédire le risque de malignité et fournir des conseils dans la gestion. Le risque de malignité pour les lésions kystiques Bosniak 1, 2, 2F, 3 et 4 est respectivement de 0 %, 0 %, 25 %, 54 % et 100 %.
L’urographie CT peut également être efficace dans le diagnostic des tumeurs de la vessie. Cependant, les résultats peuvent différer en fonction de la population spécifique étudiée. Dans le groupe à haut risque, les résultats non équivoques de l’UTC étaient sensibles à 93 % et spécifiques à 99 % pour la détection du cancer de la vessie, avec une valeur prédictive négative (VPN) globale de 95 %. La valeur prédictive négative élevée de l’UTC peut éviter la cystoscopie chez ces patients sélectionnés bien que, la cystoscopie reste l’étalon-or dans la détection des voies urinaires inférieures, y compris les tumeurs urothéliales de la vessie, car ni la PIV ni l’UCTM n’ont systématiquement des sensibilités assez significatives pour exclure les anomalies de la muqueuse de la vessie .
Les doses de rayonnement sont une préoccupation avec MDCTU et cela peut être réduit en limitant le nombre de phases d’imagerie par l’utilisation de la tomographie à double énergie (DECT) ou de la technique du split-bolus . En outre, (25) l’omission de l’acquisition non rehaussée entraîne une réduction de l’exposition aux rayonnements de près de 50 % .
La DECT fournit des informations sur la façon dont les substances se comportent à différentes énergies, la possibilité de générer des ensembles de données virtuelles non rehaussées et une meilleure détection des substances contenant de l’iode sur les images à faible énergie . Parmi les autres avantages du DECT, citons un bon enregistrement temporel et spatial et une bonne séparation spectrale entre les scans à haute et à basse énergie ; il est facile d’égaliser la dose et le bruit. Une étude prospective a démontré que l’urographie DECT monophasique avec rehaussement synchrone de la phase néphrographique-excrétoire représente une approche « tout-en-un » précise avec une économie de dose de radiation allant jusqu’à 45% par rapport à un protocole standard biphasique avec une bonne opacification dans 86.9% des cas et d’excellentes ou bonnes images virtuelles non rehaussées (VUE) dans 83,3% des cas .
D’autre part, le MDCTU split-bolus fournit une opacification d’au moins 50% de la majorité des segments UUT avec une sensibilité élevée (88.9-100%), une spécificité (99-99,5%) et une précision (98,5-99,5%) élevées pour la détection des tumeurs des voies urinaires supérieures (figure 6) .
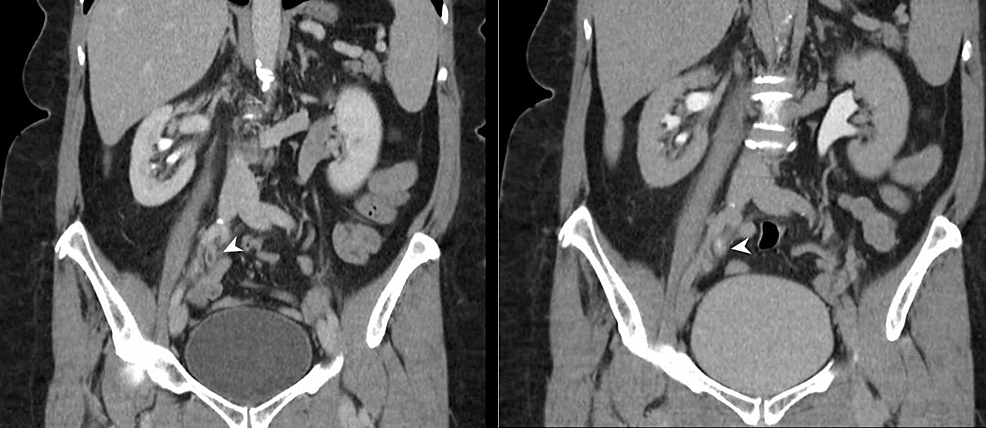
Figure6 :Urétérique TCC (CTU)
L’urographie CT (reformats coronaux) démontre un segment de 4 cm d’épaississement urothélial circonférentiel à la jonction de l’uretère droit moyen et distal (têtes de flèches) avec un rehaussement urothélial anormal. Il y a une obstruction secondaire du système collecteur droit avec le point de transition noté au niveau de l’épaississement urothélial anormal, ce qui est hautement suspect pour un TCC urothélial droit.
TCC : Carcinome à cellules transitionnelles
Urographie par résonance magnétique
L’imagerie par résonance magnétique est utile pour le diagnostic et la stadification des tumeurs malignes des reins, de la vessie et de la prostate et pour l’évaluation de la fonction rénale. Elle sert de technique d’imagerie alternative pour la population sensible aux radiations, notamment les enfants et les femmes enceintes, les personnes nécessitant des examens répétés des voies urinaires et celles présentant une contre-indication aux produits de contraste iodés.
Un protocole MRU complet peut être utilisé pour l’imagerie de tous les composants des reins et du système collecteur urinaire en une seule séance d’imagerie. L’urographie par RM est réalisée par deux méthodes principales : l’urographie statique-fluide avec des séquences ultrarapides pondérées en T2, similaires à celles utilisées pour la cholangiopancréatographie par résonance magnétique (MRCP), et les séquences pondérées en T1 de l’urographie excrétoire après administration d’un contraste IV au gadolinium .
L’UMR statique-fluide est préférée à l’UMR excrétoire pour l’imagerie des patients dont la fonction rénale est altérée, des patientes enceintes et des patients présentant une obstruction urétérale, en particulier lorsqu’il existe un risque raisonnable de fibrose systémique néphrogénique . Cependant, étant donné que les séquences pondérées en T2 sont réalisées sans administration de contraste IV, des modifications d’imagerie sont souvent nécessaires pour optimiser l’imagerie urétérale.
L’imagerie urétérale peut également être améliorée, en particulier lors de la MRU excrétoire, après l’administration d’un produit de contraste IV, d’une solution saline et d’un diurétique pour obtenir une distribution de contraste plus uniforme . Bien que les preuves révèlent que la DWI ne démontre qu’une précision modérée pour la prédiction de la malignité rénale, sa performance en tant que test indépendant n’a pas encore été testée . L’ajout de la DWI à l’imagerie pondérée en T1 et T2 augmente la sensibilité de l’identification du cancer de l’UUT avec une excellente concordance inter-observateur. En particulier, la combinaison T2WI+DWI démontre des sensibilités entre 92-98% pour le diagnostic des tumeurs de la vessie (figure 5).
Les inconvénients de l’UMR comprennent son coût, sa disponibilité, un temps d’acquisition plus long, la dégradation de l’image due aux artefacts de mouvement, une résolution spatiale et une confiance diagnostique plus faibles dans la détection de la malignité urothéliale par rapport à la CTU. Cependant, le développement de séquences plus rapides et l’optimisation des protocoles d’IRM 3-T devraient permettre de résoudre ces problèmes .
Cystoscopie
La cystoscopie reste la méthode de choix pour l’évaluation de la vessie urinaire et ne doit pas être remplacée par une technique d’imagerie excrétoire . Les récentes lignes directrices de l’EAU recommandent également de réaliser une cystoscopie pour exclure une tumeur de la vessie concomitante (figure 7) lorsqu’un cancer de la VUT est diagnostiqué, en particulier lorsque des auteurs ont démontré des résultats faussement positifs et faussement négatifs notables à l’UTC et à l’IRM dans la détection des tumeurs de la vessie par rapport à l’histopathologie chez les patients présentant une hématurie visible . Une cystoscopie devrait être réalisée chez pratiquement tous les patients présentant une hématurie visible indolore .
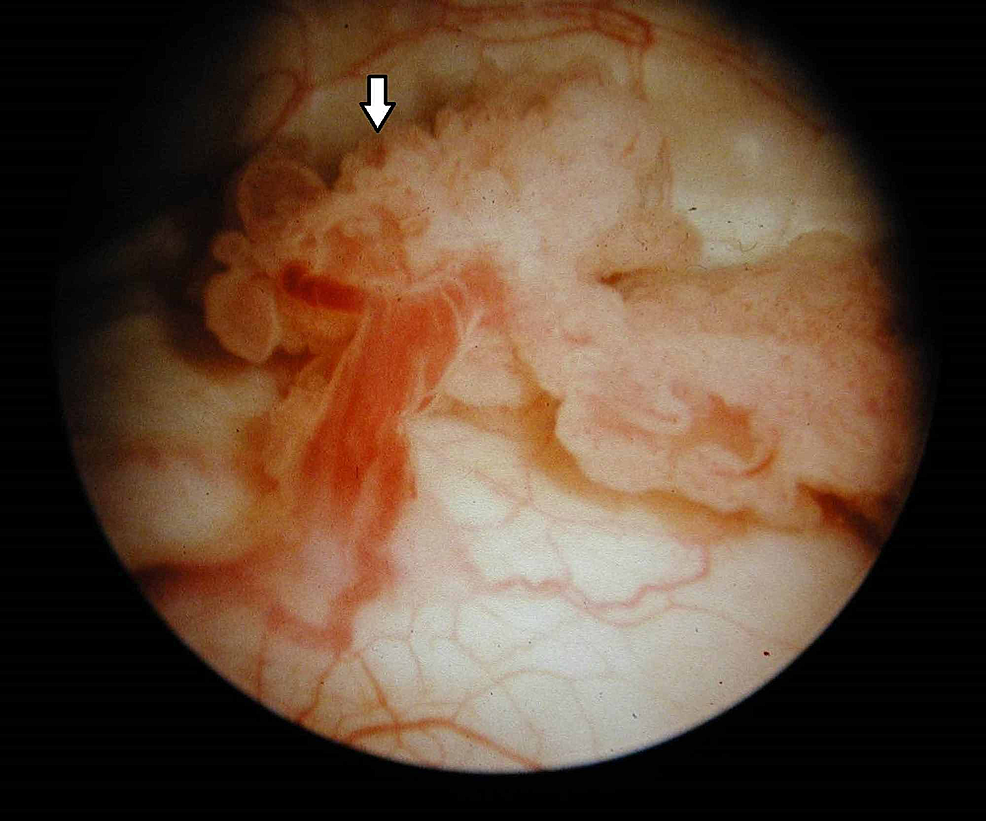
Figure7:Tumeur de la vessie (cystoscopie)
La cystoscopie révèle une excroissance exophytique de type chou-fleur avec des frondes délicates et des zones d’ulcération en accord avec une tumeur maligne de la vessie (flèche).
La cystoscopie flexible est une procédure simple, rapide et sûre réalisée sous anesthésie locale comme un cas de jour avec une réassurance fiable et permettant aux patients opérés d’être diagnostiqués et préparés pour leur chirurgie dans la même visite .
En revanche, la cystoscopie rigide est réalisée sous anesthésie générale ou rachidienne en particulier lorsque des procédures supplémentaires plus complexes sont prévues. Une pyélo-urétérographie rétrograde (RPUG) peut être réalisée au moment de la cystoscopie rigide pour imager les voies supérieures si la CTU n’a pas déjà été réalisée .
Autres études d’imagerie
Pyélo-urétérographie rétrograde
L’urogramme CT s’est avéré avoir une plus grande précision diagnostique que la RPUG pour la détection de la lésion urothéliale . Par conséquent, il est justifié d’utiliser l’UTC avant la RP, en tant que test unique, non invasif et complet, qui permet un diagnostic et/ou une stadification simultanés.
La pyélographie rétrograde peut encore être employée en deuxième intention pour caractériser davantage les défauts de remplissage détectés sur d’autres modalités, l’UTC non diagnostique, ou chez les patients souffrant d’insuffisance rénale ou les cas d’allergie aux produits de contraste. La pyélo-urétérographie rétrograde ne peut montrer que la lumière urétérale et ne peut pas dépeindre directement les anomalies extrinsèques (Figure 3) .
Radiographie simple des reins, des uretères et de la vessie (Plain X-ray KUB)
La radiographie simple KUB a actuellement peu de valeur dans l’investigation des patients présentant une hématurie indolore et n’est pas utilisée comme modalité d’image de première ligne .
Urographie excrétoire/Urographie intraveineuse (UIV)
L’urographie intraveineuse est un bon choix pour évaluer les maladies urothéliales et intraluminales mais n’est pas suffisamment sensible pour détecter les masses rénales <2-3 cm de taille et a maintenant été remplacée par l’UTC pour l’imagerie de l’UUT . La recherche de l’hématurie chez les patients à haut risque par l’UIV seule n’est plus recommandée.
Son principal avantage est que l’UIV image l’ensemble de l’UUT avec un haut degré de résolution spatiale et fournit également des informations structurelles ainsi que des données fonctionnelles limitées. C’est souvent le test le plus rentable dans de nombreux centres .
Cependant, les inconvénients de l’UIV incluent un temps d’acquisition long, des réactions de contraste potentiellement dangereuses, nécessitant une préparation intestinale et une exposition à une charge de radiation appréciable. Sa relative imprécision est son principal défaut et sera bientôt obsolète .
Suivi clinique
Il existe un risque de 1-3% des patients avec un bilan négatif de développer une malignité dans les trois ans si rien n’est fait . Le groupe d’experts de l’American Urological Association (AUA) recommande que les médecins de premier recours vérifient la présence d’une HV, de nouveaux symptômes urinaires et d’une cytologie positive tous les six mois pendant trois ans ; si les résultats sont systématiquement négatifs, le suivi peut être interrompu. BAUS recommande de réorienter le patient vers l’urologie en cas d’apparition d’une HV ou d’une hématurie non visible (HNV) symptomatique pendant le suivi en soins primaires, dont la durée n’a pas été clairement définie. Le Best Practice Advocacy Centre New Zealand a recommandé un suivi annuel pour les causes néphrologiques avec une bandelette urinaire, la pression artérielle, le DFGe et le rapport albumine/créatinine urinaire/protéine/créatinine (ACR/PCR) lorsque l’hématurie persiste, et un suivi annuel pendant deux ans pour les causes urologiques avec une bandelette urinaire, le DFGe, l’ACR/PCR urinaire et la cytologie. Cette initiative permet un suivi par les soins primaires afin de rassurer les patients qui s’inquiètent d’une hématurie continue, qui peut être intermittente mais persistante malgré un bilan négatif. L’indication de référence en néphrologie et en urologie est résumée dans le tableau 2 .
Référence en néphrologie
Une augmentation de la créatinine sérique de ≥0.3 mg/dl (>26,4 µmol/L), une augmentation en pourcentage de la créatinine sérique de ≥50% (1,5 fois par rapport aux valeurs de base) ou une réduction du débit urinaire (oligurie documentée de moins de 0.5 ml/kg par heure pendant plus de six heures
Une protéinurie significative (ACR ≥30 mg/mmol ou PCR ≥50 mg/mmol) en plus d’une hématurie fait suspecter une maladie rénale intrinsèque
Hématurie glomérulaire avec macroalbuminurie
Hématurie isolée (c’est-à-dire, en l’absence de protéinurie significative) avec hypertension chez les personnes âgées de <40
Hématurie visible coïncidant avec une infection intercurrente (généralement des voies respiratoires supérieures)
Référence en urologie
Hématurie visible chez tous les patients (quel que soit leur âge)
Patients présentant toute hématurie symptomatique nonvisible en l’absence d’infection urinaire ou d’autres causes transitoires (quel que soit l’âge)
Patients de sexe masculin présentant une hématurie non visible asymptomatique
Tous les patients présentant une hématurie non visible asymptomatique et d’autres facteurs de risque
Tableau2 : Indications d’orientation
† La présence d’hématies dysmorphiques, de protéinurie, de plâtres cellulaires et/ou d’insuffisance rénale, ou tout autre indicateur clinique suspect d’une maladie du parenchyme rénal justifie un bilan néphrologique concomitant mais n’exclut pas la nécessité d’une évaluation urologique.
‡ Les femmes présentant une hématurie asymptomatique non visible âgées de <40 ans ne nécessitent pas d’orientation vers l’urologie.
.
