Description
Corps fructifiant : 8 à 30 cm de diamètre, charnu, blanc au début, brun clair ou jaunâtre avec l’âge, quelques branches principales partant de la base étroite, chaque branche principale envoyant de nombreuses branches plus petites, sur lesquelles pendent en rangées des épines denses et serrées.
Epines : cylindriques, pointues au sommet, 0,5 à 1,5 cm de long.
Impression des spores : blanche.
Spores : incolores, lisses, ellipsoïdes à subglobuleuses, amyloïdes, hyalines, 5-8 x 4,5-6 µm.
Habitat : touffes solitaires ou groupées, généralement sur des arbres feuillus morts ; saprobique ; fin de l’été et automne ; commun.
Odeur : indistincte.
Edibilité : comestible.
Composés bioactifs
Une première étude sur les polysaccharides isolés de ce champignon a révélé qu’il s’agit d’une molécule linéaire contenant uniquement des liaisons α-1,4 glucosidiques. De plus, ce polysaccharide diffère de celui des plantes supérieures en ce qu’il n’est constitué que de molécules d’amylose à chaîne courte (32 à 45 unités de glucose de long), alors que chez les plantes, les polysaccharides peuvent avoir des longueurs de chaîne s’étendant jusqu’à des milliers, selon les espèces (McCracken et Dodd, 1971).
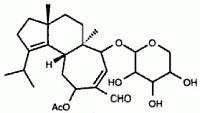
Des expériences utilisant du glucose radiomarqué suggèrent que le D-xyloside herical, isolé de cultures de H. coralloides, serait un précurseur dans la synthèse des molécules du cyathane-squelette, dont l’érinacine E, discutée ci-dessous. L’herical est connu pour inhiber un large spectre de champignons et de bactéries et présente des propriétés cytotoxiques et hémolytiques (Anke et al., 2002).
Propriétés médicinales
Activité nématicide
Un mélange nématicide d’acides gras a été obtenu à partir de cultures de H. coralloides. Ce mélange, qui contenait principalement des acides linoléique, oléique et palmitique, a montré des effets toxiques envers Caenorhabditis elegans (Stadler et al., 1994).
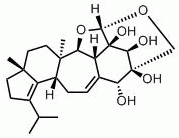
En 1998, un groupe de recherche de Pfizer a isolé l’érinacine E (voir structure ci-dessous) à partir du bouillon de fermentation de H. coralloides (Saito et al., 1998). L’érinacine E est un agoniste hautement sélectif du récepteur opioïde κ (IC50 de 0,8 µM par rapport à la liaison au récepteur opioïde µ, IC50 de >200 mM). Cette molécule a été isolée précédemment des organes de fructification de H. erinaceum, où elle a été signalée comme étant un puissant stimulateur de la synthèse du facteur de croissance nerveuse (Kawagishi et al., 1996). Les stimulateurs de la synthèse du facteur de croissance nerveuse sont étudiés comme médicaments potentiels pour les troubles neuronaux dégénératifs tels que la maladie d’Alzheimer et la régénération des nerfs périphériques (Yamada et al., 1997). La synthèse totale de l’érinacine E a été récemment rapportée (Watanabe et Nakada, 2008).
Liens
Expert en champignons
Champignons de Pologne
Champignons sur bois
Anke T, Rabe U, Schu P, Eizenhofer T, Schrage M, Steglich W.
Etudes sur la biosynthèse des diterpénoïdes de type striatal et l’activité biologique de l’herical.
Z Naturforsch C. 2002 57(3-4):263-71.
Ginns J.
Hericium coralloides N. amer auct (Hericium americanum sp nov) et les Hericium alpestre et Hericium coralloides européens.
Mycotaxon. 1984 20(1):39-43.
Hallenberg N.
Hericium coralloides et Hericium coralloides (basidiomycètes) en Europe.
Mycotaxon. 1983 18(1):181-9.
Kawagishi H, Shimada A, Hosokawa S, Mori H, Sakamoto H, Ishiguro Y, Sakemi S, Bordner J, Kojima N, Furukawa S.
Erinacines E, F et G, stimulateurs de la synthèse du facteur de croissance des nerfs (NGF), provenant des mycéliums de Hericium erinaceum.
Tetra Lett. 1996 37(41):7399-402.
McCracken DA, Dodd JL.
Structure moléculaire des polysaccharides de type amidon de Hericium ramosum et Hericium coralloides.
Science. 1971 174(7):419.
Publié
Saito T, Aoki F, Hirai H, Inagaki T, Matsunaga Y, Sakakibara T, Sakemi S, Suzuki Y, Watanabe S, Suga O, Sujaku T, Smogowicz AA, Truesdell SJ, Wong JW, Nagahisa A, Kojima Y, Kojima N.
Erinacine E comme agoniste des récepteurs opioïdes kappa et ses nouveaux analogues provenant d’un basidiomycète, Hericium ramosum.
J Antibiot. 1998 51(11):983-90.
Publié
Stadler M, Mayer A, Anke H, Sterner O.
Acides gras et autres composés à activité nématicide provenant de cultures de Basidiomycètes.
Planta Med. 1994 60(2):128-32.
Publié
Watanabe H, Nakada M.
Synthèse totale biomimétique de (-)-Erinacine E
J Am Chem Soc. 2008 130(4):1150-1.
Yamada K, Nitta A, Hasegawa T, Fuji K, Hiramatsu M, Kameyama T, Furukawa Y, Hayashi K, Nabeshima T.
Stimulateurs de synthèse du NGF actifs par voie orale : agents thérapeutiques potentiels dans la maladie d’Alzheimer.
Behav Brain Res. 1997 83(1-2):117-22.
Publié
.
