INTRODUCTION
Les recherches fondamentales et cliniques menées ces dernières années ont établi une relation directe et bidirectionnelle entre la maladie rénale chronique et les maladies cardiovasculaires1,2. Dans la pratique clinique quotidienne, les concentrations de créatinine sérique et le débit de filtration glomérulaire estimé à l’aide de la formule Cockcroft-Gault3 ou de l’équation Modification of Diet in Renal Disease (MDRD)4 sont couramment utilisés pour estimer la fonction rénale. Cependant, les concentrations de créatinine plasmatique peuvent être influencées par un certain nombre de facteurs, tels que l’âge du patient, son sexe, sa masse musculaire, son activité physique, son régime alimentaire et ses médicaments.5
La cystatine C est une protéine inhibitrice de la cystéine protéase qui est synthétisée à un taux stable par toutes les cellules nucléées. En raison de son faible poids moléculaire et de son point isoélectrique élevé, elle peut être éliminée presque exclusivement par filtration glomérulaire. Les concentrations de cystatine C ne sont pas influencées par l’âge, le sexe ou l’ingestion de protéines, et elles sont sensibles à de faibles variations de la filtration glomérulaire. En raison de ces caractéristiques, la concentration plasmatique de cystatine C est considérée comme l’un des meilleurs marqueurs de l’état de la filtration glomérulaire.6-9 Récemment, plusieurs études ont rapporté une association entre des valeurs élevées de cystatine C et le développement de complications cardiovasculaires chez les patients atteints de maladie coronarienne. On ignore actuellement si cette relation est due au fait que la cystatine C est un meilleur marqueur de la fonction rénale que la créatinine sérique ou si des facteurs autres que la filtration glomérulaire affectent la concentration de cette protéine et sont en outre liés au risque cardiovasculaire10.
Le but de cette étude était d’évaluer la valeur pronostique de la concentration plasmatique de cystatine C chez les patients hospitalisés pour un syndrome coronarien aigu (SCA) à haut risque, et d’étudier la relation entre la cystatine C et d’autres marqueurs de la fonction rénale et de l’inflammation.
METHODES
Il s’agit d’une étude prospective et observationnelle réalisée entre mai 2006 et juillet 2007. Un total de 203 patients âgés de plus de 18 ans et hospitalisés consécutivement dans l’unité de soins intensifs (USI) de cardiologie de notre centre avec un diagnostic de SCA à haut risque ont été inclus.
Les critères de diagnostic du SCA à haut risque comprenaient au moins 2 des facteurs suivants : douleur avec des caractéristiques ischémiques, altérations électrocardiographiques compatibles avec l’ischémie, et/ou marqueurs de nécrose myocardique élevés. Le traitement administré et les examens complémentaires effectués pendant le séjour hospitalier du patient étaient fondés sur les décisions cliniques du médecin traitant. Chez la plupart des patients, une stratégie invasive a été utilisée, impliquant une coronarographie urgente (pour un infarctus du myocarde avec un sus-décalage du segment ST ou un bloc de branche gauche) ou une coronarographie précoce programmée au cours des 24 à 72 premières heures suivant l’admission à l’hôpital.
Caractéristiques cliniques
Les données suivantes ont été enregistrées à partir des dossiers cliniques des patients : informations démographiques, présence de facteurs de risque cardiovasculaire classiques (diabète sucré, hypertension systémique, dyslipidémie et tabagisme) et antécédents de maladie vasculaire connue (cardiopathie ischémique, maladie cérébrovasculaire, artériopathie périphérique et traitement antérieur de revascularisation myocardique). Les autres variables cliniques analysées comprenaient le type de SCA, la classe de Killip au moment de l’hospitalisation, les valeurs de pression systolique et diastolique, la pression pulsée (estimée comme la différence entre la pression artérielle systolique et diastolique) et la fréquence cardiaque.
Tous les patients ont subi une échocardiographie, au cours de laquelle la fraction d’éjection ventriculaire gauche a été estimée par la méthode de Simpson en utilisant une approche à 4 chambres ; la moyenne de 3 déterminations a été calculée chez les patients en rythme sinusal, et la moyenne de 5 déterminations chez ceux en fibrillation auriculaire.
Chez 95 % des patients, une coronarographie a été réalisée, et la sévérité des lésions coronaires a été évaluée par un score basé sur le nombre de coronaires épicardiques touchées.
Données analytiques
Les valeurs initiales de l’hémoglobine, de l’hématocrite, des leucocytes, du glucose et de la créatinine ont été enregistrées dans les premières analyses de laboratoire effectuées dans notre centre au moment de l’hospitalisation. Les concentrations de cholestérol total, de cholestérol à lipoprotéines de haute densité (HDL-C), de cholestérol à lipoprotéines de basse densité (LDL-C), de glucose, de protéine C-réactive de haute sensibilité et de cystatine C ont été enregistrées au cours des 24 premières heures, ainsi que le taux maximal de troponine I (TpI).
La cystatine C a été mesurée avec un dosage immunologique homogène automatisé utilisant un néphélomètre Dade-Behring BN ProSpec. Le réactif pour l’analyse était constitué de particules de polystyrène recouvertes d’anticorps contre la protéine qui s’agglutinent lorsqu’elles sont mélangées à des échantillons contenant de la cystatine C et dispersent de la lumière à une intensité proportionnelle à la concentration de l’analyte.
L’intervalle de référence pour la concentration de cystatine C sérique chez les adultes avec la méthode néphélométrique utilisée est de 0,51 à 0,95 mg/L. Les concentrations de la protéine C-réactive de haute sensibilité ont également été déterminées par immunodosage. Le débit de filtration glomérulaire a été estimé avec l’équation MDRD.
Episodes analysés
Les complications cardiovasculaires analysées comprenaient la mortalité hospitalière, la mortalité toutes causes confondues au cours du suivi, le développement d’un nouvel infarctus du myocarde, défini comme une douleur thoracique ou une douleur angineuse équivalente avec modifications ECG, ou une élévation des marqueurs de nécrose tumorale au cours des 24 premières heures suivant l’hospitalisation (les patients présentant une élévation des marqueurs après des procédures interventionnelles coronaires ont été exclus), et le développement d’une insuffisance cardiaque au cours de l’hospitalisation ou du suivi.
Suivi clinique
Le suivi moyen était de 186 (écart-type, 110 ; médiane, 156) jours, au cours desquels tous les événements cliniques des patients ont été enregistrés. Le suivi a été effectué par contact téléphonique, dans les cliniques externes et par l’examen des dossiers médicaux hospitaliers des patients.
Analyse statistique
Toutes les informations ont été enregistrées prospectivement dans une base de données créée avec Microsoft Office Access 2003 SP2. Les analyses statistiques ont été réalisées avec SPSS (Statistical Package for the Social Sciences), version 12.0. Les variables catégoriques ou dichotomiques sont exprimées en valeurs absolues et en pourcentages, et ont été comparées avec le test du χ2 de Pearson. Les variables continues avec une distribution normale sont décrites comme la moyenne (SD), et le test t de Student a été utilisé pour les comparaisons entre les groupes. Les variables qui ne présentaient pas une distribution gaussienne ont été comparées avec le test U de Mann-Whitney.
Le coefficient de corrélation de Spearman a été utilisé pour évaluer les corrélations de la concentration de cystatine C avec la protéine C-réactive de haute sensibilité et le débit de filtration glomérulaire. Une analyse de régression logistique a été utilisée pour évaluer le rôle indépendant des facteurs cliniques et de laboratoire par rapport à la cystatine C pour prédire le développement de complications cardiovasculaires pendant l’hospitalisation, y compris les variables significatives de l’analyse univariée. Les odds ratios ajustés et les intervalles de confiance (IC) à 95 % sont présentés. Les courbes de survie de Kaplan-Meier pendant le suivi ont été construites et comparées à l’aide du test du long rang.
Pour réaliser une analyse descriptive de la population étudiée, certaines variables quantitatives ont été classées par intervalles : le taux de filtration glomérulaire (>90, 90-60, 55% et 0,95 et
Une valeur P inférieure à 0,05 a été considérée comme statistiquement significative.
RESULTATS
De mai 2006 à juillet 2007, 203 patients hospitalisés avec un diagnostic de SCA à haut risque ont été inclus dans l’étude. L’âge moyen était de 66,6 (13,16) ans. Parmi le total, 62,1% des patients (n=126) présentaient un SCA sans élévation du segment ST et 37,9% (n=77), un SCA avec élévation du segment ST. Les caractéristiques de base de la population étudiée sont décrites dans le tableau 1.
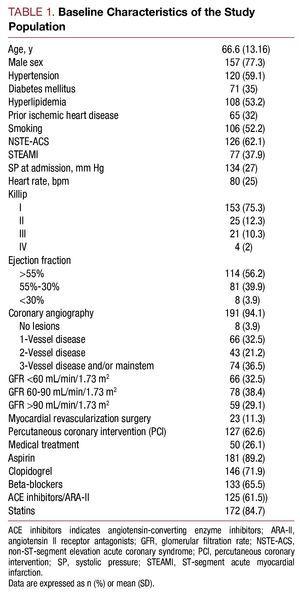
La concentration médiane de cystatine C était de 1,01 (plage, 0,83-1,35) mg/L, la créatinine plasmatique lors de la première analyse effectuée était de 1 (0.9-1,3) mg/L, le taux de filtration glomérulaire était de 72,4 (49,12-93,73) mL/min/1,73 m2 et la protéine C réactive de haute sensibilité était de 1,37 (0,46-5,02) mg/L. La filtration glomérulaire au moment de l’hospitalisation était de 2 chez 32,5 % des patients et la cystatine C sérique était >0,95 mg/L chez 113 (55,7 %) patients.
Les patients présentant des valeurs de cystatine C plus élevées présentaient un profil clinique moins bon, étaient plus âgés, avaient une prévalence élevée d’hypertension, une classe de Killip moins bonne au moment de l’hospitalisation, une maladie coronaire plus sévère à la coronarographie et des valeurs de créatinine plasmatique et de protéine C-réactive plus élevées (tableau 2).
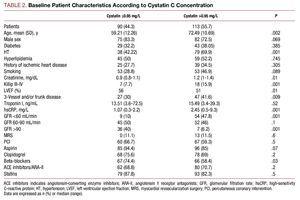
Il n’y avait pas de différences significatives entre les 2 groupes de cystatine C concernant l’intervention coronaire réalisée ; le résultat angiographique final a donné un taux de réussite similaire et aucune complication significative (3,27% pour les patients avec une cystatine C ≤0,95 et 4,09% dans l’autre groupe). L’analyse du traitement pharmacologique a montré une utilisation sensiblement plus élevée de bêta-bloquants et d’aspirine dans le groupe avec une cystatine C ≤0,95 (tableau 2).
Les valeurs sériques de la cystatine C ont montré une corrélation plus élevée avec le débit de filtration glomérulaire estimé (r=-0,655 ; P=,001) (figure 1) qu’avec la microalbuminurie (r=0,302, P=,01) et une corrélation plus faible avec la protéine C-réactive (r=0,29 ; P=,01).
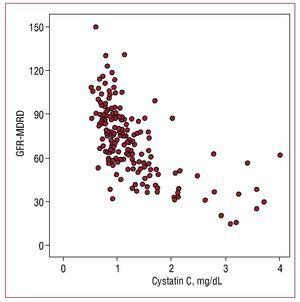
Figure 1. Corrélation entre les valeurs de cystatine C et le débit de filtration glomérulaire estimé avec la formule MDRD (GFR-MDRD).
Dans le groupe de patients présentant des valeurs de cystatine C >0,95, 6,5% présentaient des débits de filtration glomérulaire normaux et 46%, des débits de filtration glomérulaire compris entre 60 et 90 ml/min/1,73 m2. En outre, 10 % des patients qui présentaient un dysfonctionnement rénal avec un taux de filtration de 2 avaient des valeurs de cystatine C
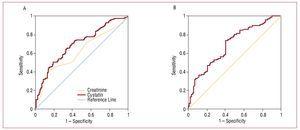
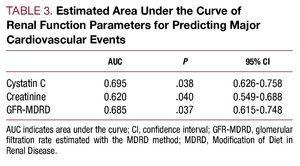
Figure 2. A, ROC de la cystatine C et de la créatinine par rapport au développement de complications cardiovasculaires (insuffisance cardiaque, infarctus et décès cardiovasculaire). B, courbe ROC du débit de filtration glomérulaire estimé avec le MDRD par rapport au développement de complications cardiovasculaires (insuffisance cardiaque, infarctus et décès cardiovasculaire).
Le séjour hospitalier a duré une médiane de 9 (6-19) jours. Entre le moment de l’admission et la fin du suivi de l’étude, 56 (27,58%) patients de l’échantillon global ont développé une insuffisance cardiaque, la plupart d’entre eux dans le groupe avec des valeurs de cystatine C élevées (45 patients). La mortalité hospitalière était significativement plus élevée dans le groupe présentant des valeurs de cystatine C élevées (17,6 % contre 3,3 % ; P=.001), et ces différences ont persisté au cours du suivi (figure 3, tableau 4).
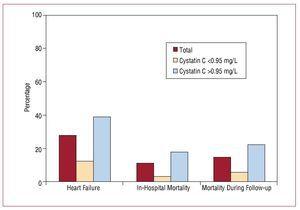
Figure 3. Association entre la cystatine C 0,95 mg/L et le développement d’événements cardiovasculaires à l’hôpital.

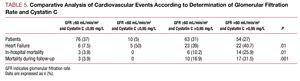
Dans l’analyse univariée, aucune association n’a été observée entre les complications cardiovasculaires et le type de SCA, l’hyperlipidémie ou la concentration maximale de TpI, mais une association a été trouvée avec les autres facteurs de risque cardiovasculaire : nombre de vaisseaux touchés, fraction d’éjection, marqueurs de la fonction rénale, cystatine C et protéine C réactive de haute sensibilité. Lorsque les résultats des patients ayant un taux de filtration glomérulaire >60 ml/min/1,73 m2 ont été analysés, nous avons constaté que les patients ayant une cystatine C >0.95 mg/L présentaient un taux de complications cardiovasculaires significativement plus élevé que les patients ayant un taux de filtration glomérulaire >60 et une cystatine C 60 et une cystatine C
La survie estimée sans événement (c’est-à-dire sans insuffisance cardiaque, infarctus du myocarde ou décès) après un suivi moyen de 186 jours était significativement plus élevée dans le groupe de patients ayant des valeurs de cystatine ≤0.95 mg/L : 75 % contre 44 % (P= 0,02) (figure 4).

Figure 4. Courbes de Kaplan-Meier permettant d’estimer la probabilité de survie sans événement cardiovasculaire majeur, en fonction de la valeur de la cystatine C.
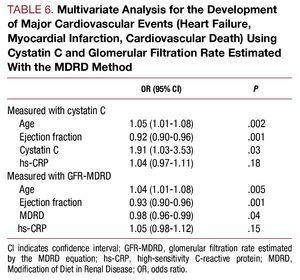
L’analyse multivariée a identifié l’âge, la fraction d’éjection et la concentration de cystatine C comme facteurs prédictifs indépendants des complications cardiovasculaires pendant l’hospitalisation (tableau 6).
DISCUSSION
Les résultats de la présente étude indiquent que des valeurs élevées de cystatine C prédisent le développement d’une insuffisance cardiaque à l’hôpital, d’un infarctus du myocarde et d’un décès cardiovasculaire chez les patients présentant un SCA à haut risque, indépendamment des autres facteurs de risque classiques. En outre, la valeur plasmatique de la cystatine C pourrait avoir une plus grande capacité à stratifier les patients à haut risque de complications cardiovasculaires pendant l’hospitalisation que d’autres méthodes d’évaluation de la fonction rénale. Nous avons constaté qu’un taux élevé de cystatine C était associé à un pronostic cardiovasculaire plus défavorable, même dans le groupe de patients présentant une filtration glomérulaire normale. À notre connaissance, il s’agit du premier rapport de cette association, qui, selon nous, pourrait avoir des implications pour la stratification du risque dans cette population de patients.
Ces dernières années, plusieurs articles ont décrit une association étroite entre le dysfonctionnement rénal et les complications cardiovasculaires au cours du suivi de patients atteints de cardiopathie ischémique aiguë et chronique, ainsi que d’autres présentations cliniques de maladies cardiovasculaires, en particulier l’insuffisance cardiaque.1,10-12 Une réduction de la filtration glomérulaire en dessous de 60 ml/min est liée à une augmentation significative du risque de décès, d’infarctus du myocarde et d’accident vasculaire cérébral, à la fois chez les patients avec ou sans maladie cardiovasculaire antérieure.13 Plus précisément, cette relation a été décrite chez les patients victimes d’un SCA présentant un sus-décalage du segment ST et chez ceux qui n’en présentaient pas.10,13-15 Dans l’étude VALIANT16 (patients présentant une dysfonction ventriculaire et une insuffisance cardiaque après un infarctus du myocarde avec sus-décalage du segment ST), la détérioration de la fonction rénale (évaluée par le taux de filtration glomérulaire) a été associée à une augmentation de la mortalité et des complications cardiovasculaires au cours du suivi. Des résultats similaires ont été rapportés pour les populations de patients incluses dans les études SAVE (dysfonctionnement ventriculaire post-infarctus), HOPE (patients présentant un risque cardiovasculaire élevé, la majorité souffrant de cardiopathie ischémique chronique) et PEACE (patients souffrant de cardiopathie ischémique chronique). Dans ces études, la relation entre le dysfonctionnement rénal et le pronostic a été observée pour la diminution des taux de filtration glomérulaire ainsi que pour l’excrétion urinaire d’albumine.16-19
Comme mentionné ci-dessus, une relation directe à double sens a été décrite entre le dysfonctionnement rénal et les maladies cardiovasculaires. L’insuffisance rénale chronique favorise le développement de l’hypertension et de la dyslipidémie, et favorise l’activation du système rénine-angiotensinaldostérone. Ces facteurs, associés à l’augmentation des médiateurs inflammatoires, semblent contribuer à une production plus élevée de radicaux libres, qui interviennent dans le processus athérosclérotique et les lésions cardiovasculaires. En outre, les altérations du métabolisme minéral (augmentation des promoteurs et diminution des inhibiteurs de la calcification) favorisent les dépôts de calcium dans les vaisseaux coronaires.20,21 Enfin, une utilisation moins intensive des interventions thérapeutiques dont le bénéfice clinique et pronostique est reconnu a été décrite chez les patients souffrant de dysfonctionnement rénal. Plus précisément, chez ceux qui présentent un SCA, un traitement moins agressif et des délais plus longs dans la réalisation des procédures coronaires interventionnelles, ainsi qu’une utilisation plus faible des IIb/IIIa, des bloqueurs de l’axe rénine-angiotensine-aldostérone, des bêtabloquants, des statines et des agents antiplaquettaires, peuvent contribuer au plus mauvais pronostic décrit dans cette population de patients22.
Dans la pratique clinique quotidienne, l’évaluation de la fonction rénale repose généralement sur le dosage de la créatinine sérique et sur l’estimation du débit de filtration glomérulaire à l’aide des formules Cockcroft-Gault ou MDRD. Ces deux méthodes présentent plusieurs limites, dont beaucoup découlent de facteurs qui affectent la production de créatinine, comme l’âge, le sexe féminin, les caractéristiques liées à la race, le régime alimentaire et l’évolution des maladies chroniques.
Ces équations ont récemment été évaluées chez des patients atteints d’insuffisance cardiaque et comparées au NT-proBNP, un marqueur pronostique. L’information pronostique fournie par le NT-proBNP s’est avérée supérieure à celle de la fonction rénale estimée par la formule MDRD.23
La cystatine C possède des caractéristiques moléculaires et métaboliques qui font des concentrations plasmatiques de cette protéine un bon marqueur biologique pour l’estimation de la fonction rénale ; les petites altérations fonctionnelles sont détectées avec une plus grande sensibilité que les paramètres conventionnels utilisés à cet effet24. Cela peut justifier le fait que dans le groupe de patients présentant des concentrations sériques de cystatine C supérieures à la limite supérieure de la normale, 15 % présentaient un débit de filtration glomérulaire normal ; le dosage de la statine C peut être utile pour identifier les patients présentant un état préclinique de maladie rénale6.
Les résultats obtenus dans la présente étude sont, dans une certaine mesure, conformes aux résultats rapportés indiquant que la cystatine C est un prédicteur indépendant des complications cardiovasculaires chez les patients atteints de maladie coronarienne.25-27 De plus, nos données permettent d’étendre ce concept aux patients présentant un taux de filtration glomérulaire normal. Jernberg et al26 ont analysé la relation entre les valeurs plasmatiques de la cystatine C et le pronostic dans un groupe de patients hospitalisés pour un SCA sans élévation du segment ST, et ont signalé une association significative entre les valeurs de la cystatine C et la mortalité. Il a également été décrit que des concentrations élevées de cystatine C sont associées à un risque accru de décès, de complications cardiovasculaires et à l’incidence de l’insuffisance cardiaque chez les patients ambulatoires atteints de maladie coronarienne chronique.24 Chez les personnes âgées sans maladie rénale manifeste, la cystatine C est un marqueur de risque de décès, de maladie cardiovasculaire et de maladie rénale chronique.6 Dans l’étude actuelle, nous avons constaté que les patients présentant des niveaux élevés de cystatine C avaient un profil de risque plus faible ; cependant, le niveau relativement faible de protéine C-réactive était surprenant. Nous pensons que cela peut s’expliquer par la cinétique de la protéine, qui a un spectre spécifique et caractérisé dans lequel sa valeur dépend du moment où l’échantillon est prélevé (le pic se produit à 49 heures après le début des symptômes, et un pic plus tardif est observé dans l’infarctus du myocarde aigu avec surélévation du segment ST) ; dans notre étude, les échantillons ont été prélevés dans les 24 premières heures suivant l’hospitalisation28. Les complications cardiovasculaires affectant les patients de notre étude diffèrent de celles publiées dans des registres récents29, ce qui peut s’expliquer par l’inclusion de patients à très haut risque et présentant une incidence plus élevée de complications. Dans le registre MASCARA récemment publié, seuls 50 % des patients inclus avaient été initialement admis dans une unité de soins intensifs ou une unité de soins intensifs cardiaques, alors que tous nos patients provenaient d’une unité de soins intensifs cardiaques, un fait qui implique sans doute un certain biais de sélection. Néanmoins, le groupe de patients présentant une cystatine C élevée constituait une population avec un profil de risque et un nombre de complications cardiovasculaires significativement plus élevés que les autres patients. La présente étude contribue à établir une plus grande précision dans ces associations en fournissant le premier rapport selon lequel des niveaux élevés de cystatine C dans les premières heures d’hospitalisation pour un SCA à haut risque sont un facteur prédictif indépendant de complications cardiovasculaires à l’hôpital. De plus, l’association entre la cystatine C et le risque de complications cardiovasculaires est plus élevée que celle d’autres paramètres largement utilisés pour estimer la fonction rénale, et se maintient même dans le groupe de patients ayant une filtration glomérulaire normale. Actuellement, on ne sait pas précisément si la capacité de prédire un risque plus élevé de complications provient du fait que la cystatine C est un meilleur marqueur de la fonction rénale que d’autres paramètres courants (créatinine sérique et taux de filtration glomérulaire), ou si d’autres facteurs, en dehors de la filtration glomérulaire, affectent la concentration de cystatine C et pourraient être directement liés au risque cardiovasculaire. Dans cette optique, une corrélation positive des valeurs de la protéine C-réactive plasmatique et du fibrinogène avec des concentrations élevées de cystatine C et la présence d’une maladie cardiovasculaire a été décrite.30 Dans l’étude PRIME (Prospective Epidemiological Study of Myocardial Infarction), l’association entre la cystatine C et le développement d’un infarctus aigu du myocarde, la mort cardiaque et l’angine de poitrine a été étudiée chez des patients sans maladie coronarienne. Après ajustement pour les facteurs de risque cardiovasculaire communs, le niveau de cystatine C plasmatique était significativement associé au développement de la première complication coronaire d’origine ischémique. De l’avis des auteurs, la diminution du taux de filtration glomérulaire ne justifierait pas les valeurs plus élevées de cystatine C présentées par les cas par rapport aux témoins, et ils ont proposé que l’inflammation puisse être à l’origine de la relation entre la cystatine C et le risque de maladie cardiovasculaire.31,32 Conformément à ces données, nos résultats ont montré une corrélation positive entre la cystatine C et la protéine C-réactive de haute sensibilité (r=0,2), qui est également un prédicteur indépendant des complications cardiovasculaires, et fournissent des preuves supplémentaires pour justifier la présence de relations directes entre la maladie rénale, l’inflammation et les maladies cardiovasculaires.
Parmi les principales limites de l’étude présentée, il convient de souligner que les résultats ne concernent que les patients présentant un SCA à haut risque hospitalisés dans une unité de soins intensifs cardiaques, la majorité d’entre eux ayant été traités de manière agressive par une coronarographie précoce. D’autre part, ces caractéristiques doivent être soulignées, car il existe peu d’informations sur cette population spécifique, chez qui la cystatine C a été mesurée à l’admission à l’hôpital. Dans presque toutes les études publiées, le moment des déterminations n’est pas indiqué et, au moins chez les patients atteints de SCA, les concentrations plasmatiques de cystatine C peuvent être influencées par le temps écoulé depuis l’événement et les interventions diagnostiques et thérapeutiques effectuées. La limitation d’un suivi court empêche d’étendre nos observations à moyen ou long terme. Néanmoins, nos résultats offrent une possibilité d’améliorer la stratification du risque chez les patients hospitalisés pour un SCA à haut risque, ce qui sera utile pour décider de la thérapie ainsi que pour établir le diagnostic.
CONCLUSIONS
La détermination de la cystatine C au moment de l’hospitalisation des patients présentant un SCA à haut risque pourrait être un bon outil clinique pour la stratification du risque cardiovasculaire. La détermination de cette protéine compléterait les informations fournies par d’autres méthodes d’évaluation de la fonction rénale et, outre les implications diagnostiques, pourrait être utile pour identifier le groupe à plus haut risque. Il pourrait être nécessaire d’accorder une attention particulière au respect des recommandations contenues dans les guides de pratique clinique dans cette population. En outre, la cystatine C pourrait apporter des informations importantes pour la stratification des patients présentant un SCA à haut risque et une fonction rénale préservée. Des études supplémentaires avec un suivi plus long peuvent être nécessaires pour définir le rôle de la cystatine C dans le SCA avec plus de précision.
ABBREVIATIONS
SCA : syndrome coronarien aigu
MDRD : Modification of Diet in Renal Disease
TpI : troponine I
.
