Introduction
La maladie diverticulaire du côlon représente la maladie la plus courante affectant le gros intestin dans le monde occidental. La prévalence de la maladie diverticulaire a augmenté au cours du siècle dernier dans le monde entier, probablement en raison de changements dans le mode de vie, tels que le tabagisme, le surpoids et, plus généralement, la sédentarité et une alimentation pauvre en fibres. La prévalence augmente avec l’âge, allant d’environ 5 % chez les adultes de moins de 40 ans à 50-70 % chez ceux de 80 ans ou plus ; 80 % des patients qui présentent une diverticulite ont 50 ans ou plus. Les diverticules peuvent être solitaires ou se compter par centaines. Ils ont généralement un diamètre de 5 à 10 mm, mais peuvent dépasser 2 cm. La diverticulose se produit principalement dans le sigmoïde et le côlon descendant chez plus de 90% des patients, mais peut être prévalente à des degrés divers dans le reste du côlon.1
Il existe plusieurs termes liés aux diverticules qui seront utilisés dans cette revue. La présence de diverticules dans le côlon en l’absence d’inflammation manifeste est appelée diverticulose ou maladie diverticulaire non compliquée (MDNC). Elle peut être symptomatique ou asymptomatique. Le terme « diverticulite colique aiguë » (DCA) est utilisé pour décrire l’inflammation des diverticules, qui peut ou non évoluer vers des complications (DCA compliquée). Il existe également une diverticulite chronique, en raison de diverticulites récurrentes ou du développement d’une colite segmentaire associée aux diverticules. En résumé, le spectre clinique de la maladie diverticulaire est large.
Les études sur l’histoire naturelle de la maladie soulignent qu’une grande majorité des patients atteints de diverticules (environ 80%) resteront asymptomatiques tout au long de leur vie. Parmi les 15-20% qui développent des symptômes, environ 1/4 auront finalement un épisode de maladie diverticulaire douloureuse symptomatique sans inflammation, et jusqu’à 10-25% auront un épisode de DCA. Environ 1 à 2 % nécessiteront une hospitalisation et 0,5 % une intervention chirurgicale. Les diverticules sont responsables de la majorité (24-42%) des épisodes d’hémorragie gastro-intestinale inférieure.2-4
Physiopathologie et développement des symptômes
Un diverticule colique est une hernie de la muqueuse et de la sous-muqueuse, correspondant à un point faible où les vasa recti pénètrent la tunique musculaire. Les mécanismes pathogéniques de la maladie diverticulaire sont encore mal compris, mais il est généralement admis qu’ils sont probablement liés à des interactions complexes entre le régime alimentaire, le microbiote colique, les facteurs génétiques, la motilité et la structure du côlon qui aboutissent à la formation de diverticules coliques au fil du temps.5 Voir Fig. 1. En 1971, Painter et Burkitt ont publié leur célèbre hypothèse selon laquelle la maladie diverticulaire était causée par une pression excessive dans le côlon due à une segmentation basée sur un apport insuffisant en fibres alimentaires. En réponse à l’augmentation de la pression intraluminale, des diverticules peuvent se développer et faire saillie dans les zones de faiblesse potentielle.6 La stase ou l’obstruction dans le diverticule à collet étroit peut entraîner une prolifération bactérienne et une ischémie tissulaire locale conduisant finalement à une perforation.7 Depuis lors, de nombreuses études d’observation ont tenté de démontrer l’effet possible des fibres sur la prévention de la maladie diverticulaire. La plupart d’entre elles ont conclu que le risque de DMU était inversement associé à la consommation de fibres alimentaires.8-10 Sur la base de ces preuves, un régime riche en fibres est recommandé pour prévenir la maladie diverticulaire dans la plupart des recommandations et des documents de synthèse actuels.11-15 Cependant, cette hypothèse a été récemment remise en question car : (1) l’association inverse entre la consommation de fibres et la diverticulose a été remise en question dans certaines études épidémiologiques récentes16,17 et (2) de nouvelles hypothèses pathogéniques telles que l’hypothèse neuropathique et myopathique émergent.18-22 D’autres facteurs qui ont été associés à un risque accru de maladie diverticulaire sont l’inactivité physique, la constipation, l’obésité et le tabagisme23.-27
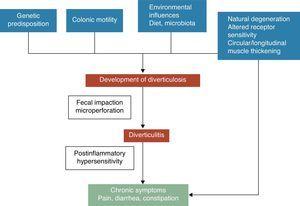
Le développement des symptômes dans la maladie diverticulaire est probablement lié à des interactions complexes entre les caractéristiques génétiques, la structure du côlon, la motilité intestinale l’inflammation de bas grade et l’hypersensibilité postinflammatoire.
L’association entre la maladie diverticulaire non compliquée (DMNC) et les symptômes est incertaine. Certaines données suggèrent que la maladie diverticulaire douloureuse pourrait être un état lié à l’inflammation et à ses effets sur la fonction neuromusculaire du côlon.22-28 La présence d’une inflammation intestinale chronique de bas grade induirait un dysfonctionnement sensori-moteur, entraînant le développement et/ou la persistance des symptômes. Les modifications de la microflore intestinale pourraient être l’un des mécanismes putatifs responsables de l’inflammation de bas grade. La prolifération bactérienne favorisée par la stase fécale à l’intérieur des diverticules pourrait contribuer à une inflammation chronique de bas grade qui sensibilise les neurones efférents primaires intrinsèques et afférents primaires extrinsèques. Ces altérations pourraient conduire à une hypertrophie des muscles lisses, et à une sensibilité accrue à la distension abdominale, et enfin, au développement de symptômes.3,22 Voir Fig. 1.
Comme nous l’avons mentionné ci-dessus, la plupart des personnes atteintes de diverticulose colique restent asymptomatiques, mais peuvent éventuellement développer des complications comme l’ACD ou le saignement du diverticule. Dans cet article, nous nous concentrons sur l’ACD. La manifestation clinique de cet événement dépendra d’un certain nombre de facteurs, notamment la taille de la perforation, le niveau de contamination extracolonique et la capacité de l’organisme à contenir cette contamination.29,30
Gestion de la maladie diverticulaireGestion de la maladie diverticulaire non compliquée (MND)
Chez les patients atteints de MND asymptomatique,2 un régime riche en fibres peut être recommandé en raison de son possible bénéfice prophylactique dans la prévention de la MND symptomatique et des complications. Il n’existe aucune preuve de l’utilité d’autres médicaments chez ces patients.
Les preuves de l’intérêt d’un traitement en cas de DBU symptomatique sont plus nombreuses. Le symptôme le plus fréquent est la douleur abdominale, qui peut être exacerbée par l’alimentation et atténuée par la défécation ou le passage de flatulences. Les autres symptômes sont les nausées, la diarrhée, la constipation et les ballonnements. Plus de 61% des patients présentant un DDU symptomatique et ne prenant aucune mesure thérapeutique pour prévenir la récurrence des symptômes deviendront symptomatiques dans l’année qui suit, et environ 4% développeront des complications.31
Cinq agents ont été proposés pour le traitement (voir Fig. 2):

Traitement de la maladie diverticulaire non compliquée. Mécanismes d’action.
A) Régime riche en fibres ou agents gonflants
Plusieurs essais contrôlés randomisés (ECR) et d’autres études interventionnelles évaluent l’effet des fibres dans le cas de la MUD symptomatique, mais avec des résultats incohérents32.-En tout état de cause, les fibres sont recommandées dans la prévention et le traitement du DDU symptomatique, ainsi que dans la prévention de la DCA par la plupart des lignes directrices et des documents de synthèse actuels.11-15
B) Antibiothérapie
La justification de l’utilisation d’antibiotiques dans le DDU symptomatique n’est pas clairement établie. Des études récentes suggèrent que des modifications du microbiote intestinal (prolifération bactérienne intestinale) pourraient contribuer au développement des symptômes en raison de la production excessive de gaz intestinaux par la fermentation des glucides. Afin d’éviter les effets systématiques, les antimicrobiens peu absorbés qui agissent contre les agents pathogènes entériques mais présentent un risque minimal de toxicité systématique ou d’effets secondaires semblent être les antibiotiques les plus appropriés. La rifaximine a été proposée.
Rifaximine
La rifaximine est un analogue non systématique de la rifamycine avec un large spectre d’activité in vitro. La rifaximine peut diminuer l’activité métabolique de la flore intestinale, augmentant la masse fécale, et peut également éradiquer la surcroissance bactérienne. Cet antibiotique présente un profil de sécurité et de tolérance élevé.33,38 Le niveau plasmatique de la rifaximine est minimal, par conséquent, les pathogènes non entériques ne sont pas exposés à une pression sélective et le risque de résistance bactérienne est faible.39 Trois ECR ouverts et deux ECR en double aveugle40-44 ont examiné l’efficacité de l’administration cyclique de rifaximine et de fibres pour réduire les symptômes par rapport aux fibres seules. Une revue systématique et deux méta-analyses ont analysé ces essais.44-46 Elles ont conclu que le traitement combiné est efficace pour obtenir un soulagement des symptômes à un an chez les patients atteints de DBU. 35 % des patients traités par fibres seules étaient asymptomatiques, contre 64 % dans les groupes de traitement combiné. Le nombre nécessaire pour traiter était de trois pour la rifaximine contre le placebo pour soulager les symptômes et de neuf pour éviter les complications. En résumé, les meilleurs résultats ont été obtenus en utilisant une combinaison de fibres solubles, comme le glucomannane, et de rifaximine 1 semaine tous les mois.
C) Les probiotiques
Les probiotiques sont des micro-organismes vivants qui peuvent restaurer la flore intestinale commensale qui peut avoir été altérée dans la maladie diverticulaire en raison de la stase et de la réduction du temps de transit colique.47 Malheureusement, il existe peu de données disponibles sur son utilisation dans le DDU symptomatique et la plupart des études sont de petite taille et non contrôlées. La majorité d’entre elles montrent une amélioration des symptômes.48-50
Les probiotiques ont également été étudiés en association avec le 5-aminosalicylate (5-ASA). Tursi et ses collègues ont mené trois ECR comparant le 5-ASA seul, le probiotique seul ou une thérapie combinée.51-53 Le 5-ASA et les probiotiques ont tous deux semblé efficaces pour la prévention du DBU symptomatique mais leur combinaison était meilleure. Un récent ECR à double insu publié par ce même groupe scientifique a conclu que la mésalazine cyclique et le Lactobacillus casei subsp DG, particulièrement en association, semblent être meilleurs que le placebo pour le maintien de la rémission des UDD symptomatiques.54 Mais, en résumé, la mauvaise conception des études et leur petite taille ne permettent pas de tirer des conclusions définitives.
D) 5-ASA : mésalazine
La mésalazine a des effets anti-inflammatoires et antioxydants. En 2010, Gatta et al,55 ont publié une revue systématique Cochrane qui a évalué le rôle du 5-ASA chez les patients atteints de maladie diverticulaire. Les auteurs ont conclu que le 5-ASA pouvait être efficace dans le traitement de cette maladie et que l’administration quotidienne de mésalazine était plus efficace que l’administration cyclique pour prévenir les rechutes. Des ECR de haute qualité et bien conçus sont nécessaires pour confirmer leurs observations. En fait, le premier essai en double aveugle contrôlé par placebo a montré que la mésalazine était efficace pour soulager la douleur chez les patients souffrant d’UDD aiguë.56 En outre, deux ECR intéressants ont montré un avantage pour la mésalazine par rapport à la rifaximine en termes de prévention de la récidive symptomatique et un succès similaire dans le maintien de la rémission à long terme par rapport au probiotique Lactobacillus casei.53,57
E) Agents anticholinergiques/antiespasmodiques
L’hipermotilité du côlon dans la diverticulose suggère que les agents antispasmodiques tels que la dicyclomine et l’hyoscyamine pourraient améliorer les symptômes en diminuant la contraction musculaire. Mais il n’y a pas d’essais cliniques randomisés qui confirment ce bénéfice.
F) Éviter le traitement par AINS
Plusieurs études contrôlées ont montré que les AINS sont un facteur de risque pour le développement de symptômes, de DCA, de perforation et d’hémorragie.7,58-60 Les utilisateurs d’AINS ont plus de risque de développer des maladies diverticulaires symptomatiques que les non-utilisateurs (RR : 1,5, IC 95% : 1,1-2,1).58 Et chez les patients atteints de maladies diverticulaires compliquées, il y avait une plus grande utilisation d’AINS par rapport aux contrôles sans maladie. Il a été postulé que ce risque accru était dû à des dommages muqueux résultant d’une altération de la fonction de barrière de la muqueuse colique permettant la translocation des bactéries, qui provoquent une inflammation.
G) Niveaux de vitamine D
Il semble que l’incidence de l’ACD ait été associée à une variation géographique et saisonnière. Pour cette raison, Maguire et al. ont mené deux études observationnelles intéressantes qui ont montré que des niveaux plus faibles de vitamine D et une faible exposition à la lumière UV (l’exposition aux UV détermine le statut en vitamine D) sont associés à un risque significativement plus élevé de DCA. D’autres études de haute qualité sont nécessaires avant de faire une recommandation.61,62
Traitement de la diverticulite colique aiguë (DCA)
Bien que la plupart des personnes atteintes de diverticulose restent asymptomatiques, on estime qu’environ 10-25% d’entre elles développeront un épisode de DCA gauche.63 En général, le diagnostic clinique n’est pas suffisamment précis et les techniques radiologiques sont indiquées. Chez les patients présentant des symptômes légers (la plupart) et ne présentant pas de signes de DCA compliquée, la combinaison d’une douleur dans la partie inférieure de l’abdomen gauche, l’absence de vomissements et une protéine C réactive >50mg/l, peut être suffisante pour le diagnostic.64,65 Si l’imagerie est indiquée, probablement, une stratégie conditionnelle avec l’échographie comme technique de première ligne et suivie par la tomographie informatisée (CT), si l’échographie n’est pas concluante ou douteuse, peut représenter l’approche la plus efficace. Le nombre d’examens de tomographie peut être réduit de 50 %. En 1978, Hinchey et al. ont proposé une classification des DCA, qui a été modifiée par la suite.66,67 Elle distingue cinq stades de DCA : stade 0, diverticulite cliniquement bénigne, stade I (a : inflammation péricolique et b : abcès
cm à proximité de l’inflammation primaire), stade II, abcès intra-abdominal, pelvien ou rétropéritonéal ou abcès distant de l’inflammation primaire, stade III, péritonite purulente généralisée et stade IV, péritonite fécale. Voir Fig. 3.

Algorithme de prise en charge de la diverticulite colique aiguë.
Traitement des DCA non compliqués (stade 0 ou Ia de Hinchey)
La majorité des DCA non compliqués peuvent être traités de manière conservatrice en toute sécurité avec un taux de réussite compris entre 70% et 100%.14 Le traitement ambulatoire peut permettre des économies importantes pour les systèmes de santé. Dans les cas de DCA non compliquée, les critères pour une prise en charge hospitalière sont une inflammation significative (incluant la présence de fièvre ou de péritonite), une intolérance aux liquides oraux, un âge supérieur à 80-85 ans, une immunosuppression ou des comorbidités sévères. Dans la plupart des cas, un court séjour à l’hôpital sera suffisant. Il n’y a pas de preuve que les restrictions alimentaires influencent les résultats du traitement, bien que la plupart des médecins recommandent habituellement un régime liquide clair.
L’un des plus grands changements récents dans la gestion de la DCA non compliquée est la diminution de l’utilisation des antibiotiques. Une récente revue Cochrane, qui n’utilise qu’une approche qualitative (sans méta-analyse), a conclu que les meilleures données disponibles ne soutiennent pas son utilisation systématique.68 Les antibiotiques n’accélèrent pas la guérison et ne préviennent pas les complications ou les récidives. Par conséquent, l’utilisation d’antibiotiques dans ce cas est discutable. Ils seraient probablement appropriés chez les patients présentant des signes d’infection généralisée, des signes de septicémie ou de bactériémie et chez les patients immunodéprimés. Les schémas thérapeutiques recommandés sont basés sur un consensus clinique. Divers antibiotiques peuvent être utilisés, allant de l’ampiciline aux céphalosporines de troisième génération, tant qu’ils sont efficaces contre les bactéries à Gram positif, à Gram négatif et anaérobies. L’association de ciprofloxacine et de métronidazole est probablement le traitement oral le plus prescrit. Si cette association est mal tolérée, l’ampiciline-sulfabactam peut être un bon choix. D’autre part, des données récentes ont montré qu’il n’y a pas d’avantages à administrer des antibiotiques par voie intraveineuse plutôt que par voie orale et à administrer un traitement de 4 jours plutôt qu’un traitement de 7 jours.69-71 Habituellement, une amélioration clinique est observée dans les 3-4 jours suivant le traitement. Enfin, l’admission à l’hôpital avec un antibiotique intraveineux est recommandée lorsque le patient est incapable de prendre de la nourriture par voie orale, est affecté par une comorbidité sévère ou ne s’améliore pas avec un traitement ambulatoire.
Traitement des DCA compliqués (stade Ib à IV de Hinchey)DCA Hinchey Ib ou II : abcès
Approximativement 15% des patients atteints de DCA développeront un abcès.67 Il n’y a pas de preuves de haute qualité sur la gestion la plus optimale des DCA avec formation d’abcès. L’hospitalisation est indiquée. La taille est un déterminant important de la réussite du traitement. Dans les abcès plus petits (
cm), un traitement conservateur avec des antibiotiques à large spectre est recommandé. Il sera couronné de succès dans 70% des cas.72 Lorsque le traitement conservateur échoue ou dans les abcès plus importants, un drainage percutané doit être effectué. La chirurgie sera un traitement de secours lorsque les traitements mentionnés précédemment échouent.ACD Hinchey III ou IV : péritonite purulente ou fécale
La péritonite est la complication la plus grave, avec une mortalité de 14%. Bien qu’il n’y ait pas de preuves, la chirurgie précoce est considérée comme le traitement standard pour ces patients. Le choix de l’opération est influencé par les conditions du patient, les résultats de l’opération et l’expérience du chirurgien. Chez les patients gravement malades et présentant une instabilité hémodynamique, la procédure de Hartmann est recommandée. Cependant, chez les patients hémodynamiquement stables, l’anastomose primaire avec ou sans dérivation fécale proximale doit être considérée comme un choix préférable.14,74
Traditionnellement, les directives internationales recommandent de recourir à l’endoscopie après un épisode de DCA pour exclure un cancer colorectal. Cette recommandation n’est basée que sur des avis d’experts. Des études rétrospectives récentes et une revue systématique75-80 montrent que le taux de cancer chez ces patients est plutôt faible. Sur la base de ces données récentes, la stratégie la plus efficace pourrait être d’orienter vers une coloscopie uniquement les patients présentant des symptômes persistants ou ceux dont les résultats du scanner sont suspects. Mais plus d’études sont nécessaires pour une recommandation ferme.
Gestion après un épisode de DCA
Après un épisode de DCA, environ un tiers aura un deuxième DCA, et après un deuxième épisode, un autre tiers aura une autre attaque.73,74 Mais les preuves pour définir le traitement optimal après un épisode de DCA afin de prévenir un nouvel épisode sont rares.
A) Régime riche en fibres
Une fois l’épisode aigu résolu, un régime riche en fibres est généralement recommandé pour réduire les récidives. Mais les résultats des ECR sur les régimes riches en fibres chez les patients atteints de DCA sont contradictoires. Une revue systématique du régime riche en fibres, publiée récemment, n’a pu inclure aucune étude sur le rôle des fibres dans la prévention des récidives de DCA.26,81 Certains aliments (graines, pop-corn et noix) sont classiquement évités car ils peuvent théoriquement pénétrer, bloquer ou irriter le diverticule. Mais Strate et al. dans leur grande étude prospective n’ont trouvé aucune association avec un risque accru de DCA. Par conséquent, l’exclusion de ces aliments du régime alimentaire ne devrait pas être recommandée.82 De même, la réduction du poids et l’arrêt du tabac peuvent avoir une influence favorable sur la prévention des DCA.9,83
B) Antibiotiques
Trois revues systématiques récentes ont évalué le rôle de la rifaximine cyclique dans la prévention de la récidive des DCA, mais n’ont pas montré de bénéfice clair.46,84,85 D’un point de vue physiopathologique, une explication plausible de l’inefficacité de la rifaximine dans la prévention des récidives pourrait être qu’un traitement cyclique peut ne pas contrôler la population bactérienne colique pendant un mois complet, car la population bactérienne colique se rétablit dans les 7 à 14 jours après la fin de la rifaximine. Cependant, un récent ECR ouvert espagnol a montré que la rifaximine cyclique peut améliorer les symptômes et maintenir des périodes de rémission après une DCA.86 Des récidives sont survenues chez 10,4 % des patients ayant reçu de la rifaximine et des fibres, contre 19,3 % des patients ayant reçu des fibres seules. De plus, les patients diagnostiqués pour la première fois depuis ≥1 an avaient un risque plus élevé d’exacerbation (OR 3,34, IC 95 % : 0,01-12,18). Mais d’autres études sont nécessaires car, à l’heure actuelle, aucune recommandation ne peut être faite. Il n’y a pas de preuves pour soutenir l’utilisation d’autres antibiotiques dans ce contexte.
C) Probiotiques
Certaines études ouvertes ont examiné le rôle des probiotiques dans la prévention de la récidive de la DCA. Giaccari et al, il y a plus de 20 ans, ont évalué le rôle de Lactobacillus sp. après rifaximine chez 79 patients présentant une sténose du côlon post diverticulite. 88% des patients sont restés asymptomatiques pendant une période de 12 mois.87 Cette étude d’observation a été la première à suggérer un rôle possible des probiotiques dans ce contexte. Une étude plus récente a évalué un traitement combiné : balsalazide et VSL#3 (un mélange probiotique de huit espèces). Après 12 mois, 73% des sujets sous traitement combiné étaient asymptomatiques, contre 53% sous monothérapie probiotique (p>0,05).52 En résumé, les probiotiques semblent être efficaces pour prévenir la récidive de la DCA, mais des études bien conçues font défaut.
D) 5-ASA
Plusieurs ECR en double aveugle et ouverts ont évalué le rôle de la mésalazine dans la prévention de la récidive de la DCA. Malheureusement, la plupart d’entre eux n’ont pas trouvé de bénéfice de la mésalazine par rapport au placebo dans la prévention des récidives.88-90 Raskin et al. ont récemment publié deux intéressants et identiques ECR de phase 3 en double aveugle avec placebo (PREVENT1 et PREVENT2) qui montrent également que la mésalazine n’est pas supérieure au placebo dans la prévention des récidives de DCA.91 Le traitement combiné, 5-ASA plus rifaximine, a également été évalué dans plusieurs études. Trivedi et Das ont passé en revue les données de cinq ECR et d’une étude ouverte, portant collectivement sur plus de 600 patients, et ont conclu que l’association semble être supérieure à la rifaximine seule pour prévenir les récidives de DCA.92
E) Chirurgie
Jusqu’à il y a quelques années, la chirurgie élective était recommandée après deux crises de DCA non compliquée ou une crise de DCA compliquée pour réduire la morbidité et la mortalité par récidive. Mais la chirurgie élective comporte également un risque accru de morbi-mortalité.93 Pour cette raison, il est important de mettre en balance la morbidité et la mortalité dues à la chirurgie avec le risque de récidives compliquées et la gravité des symptômes.
Des données récentes montrent que l’histoire naturelle de la DCA est beaucoup plus bénigne que ce que l’on pensait par le passé.73,94 Le risque à long terme de rechute est plus faible que ce que l’on croyait auparavant, et les risques à long terme de chirurgie d’urgence ultérieure (3-7%), de décès (95) ont montré que 16% des cas avec un premier DCA ont été opérés en urgence contre seulement 6% dans les cas de rechute, et que la mortalité à 30 jours pour le premier épisode était également plus élevée par rapport aux événements récurrents (3% vs. 0%). En fait, la majorité des patients présentant un DCA compliqué n’ont pas d’antécédents de la maladie.96 Il est également proposé que le DCA récurrent puisse protéger contre la perforation, peut-être en raison de la formation d’adhérences causées par l’inflammation.95 Par conséquent, une politique de chirurgie élective après un DCA ne diminue pas la probabilité d’une autre chirurgie (jusqu’à 3%) et ne protège pas complètement contre la récurrence. D’autre part, l’amélioration des diagnostics et des modalités de traitement a réduit la morbi-mortalité des DCA compliqués. En raison de ces nouvelles données, l’American Society of Colon and Rectum Surgeons, dans ses dernières directives, recommande que la résection sigmoïdienne élective après guérison d’un DCA soit effectuée au cas par cas14 et considère que le nombre d’épisodes précédents n’est pas un bon indicateur pour la sélection des candidats à une chirurgie élective. Les médecins doivent tenir compte de l’état de santé et de l’âge du patient, de la fréquence et de la gravité de la ou des crises et de la présence de symptômes persistants après l’épisode aigu.14
Il est très difficile de prévoir quels cas de DCA vont rechuter. La gravité graduée par CT du premier épisode de DCA semble être un facteur prédictif d’une histoire naturelle défavorable. Le DCA du côté gauche, >5cm de côlon impliqué et un abcès rétropéritonéal étaient des prédicteurs de récidive et doivent être pris en compte.97 Il n’y a pas de consensus quant à savoir si le jeune âge (82 Selon les preuves actuelles, l’âge ne devrait pas être considéré comme une indication pour une chirurgie élective car il ne semble pas être lié à une évolution sévère de la maladie après un DCA traité médicalement. Mais, en tenant compte du fait qu’il y a une incidence accrue de DCA chez les patients plus jeunes, des études supplémentaires sont nécessaires pour clarifier cette question spécifique.
Les cas particuliers sont les individus immunodéprimés. Des études de cohorte indiquent que ces patients ont un risque élevé de DCA récurrente compliquée (un risque de perforation 5 fois plus élevé), et un risque élevé de chirurgie d’urgence.98 Par conséquent, un seuil plus bas pour la chirurgie élective pourrait leur être bénéfique.14 Mais, Biondo et al. dans leur étude récente montrent que les patients immunodéprimés avaient un taux de mortalité significativement plus élevé mais seulement lors du premier épisode. La controverse est donc présente.99
Traitement des séquellesA) Fistule
Une fistule se produit lorsqu’un phlegmon diverticulaire ou un abcès se rompt dans un organe adjacent. Une fistule apparaît chez moins de 5% des patients atteints de DCA. Les plus fréquentes sont les fistules colovésicales et colovaginales. Vraisemblablement, une résection chirurgicale en une seule étape avec fermeture de la fistule et anastomose primaire pourrait être réalisée chez la plupart des patients. Les autres fistules comme les fistules colo-entériques ou col-utérines sont rares.100,101
B) Obstruction
Les épisodes récurrents d’ACD, qui peuvent être subcliniques, peuvent produire une striction chronique du côlon sans inflammation continue. Une obstruction de haut grade ou complète peut se produire. Avant de traiter l’obstruction, il est nécessaire d’exclure une étiologie maligne. Lorsque le néoplasme est suffisamment exclu et qu’il n’y a pas de DCA, la dilatation endoscopique ou la décompression temporaire avec un stent métallique peuvent être des options thérapeutiques.102 Plus tard, une résection ultérieure en une seule étape sans déviation peut être réalisée.
Gestion de la colite segmentaire associée à la diverticulose
Elle est définie comme une inflammation chronique de la muqueuse interdiverticulaire d’un segment colique impliqué. Le rectum et le côlon droit sont épargnés. Elle est devenue un trouble clinique et pathologique distinct et se manifeste fréquemment par des selles sanglantes. La pathogénie est inconnue. Le spectre des altérations histologiques va d’une légère inflammation non spécifique à des changements semblables à ceux d’une maladie inflammatoire de l’intestin. De ce fait, le diagnostic différentiel est souvent difficile. La plupart des patients se rétablissent complètement en quelques semaines ou mois. Certains d’entre eux sont initialement traités avec du 5-ASA par voie orale, mais ces médicaments ne sont probablement pas nécessaires car la plupart des cas se résolvent spontanément.103
Conclusions
Dans le cas du DDU symptomatique, les objectifs du traitement sont de prévenir les complications et de réduire les symptômes. Selon les données actuelles, les fibres plus la rifaximine cyclique ou la mésalazine plus les probiotiques semblent être les thérapies les plus efficaces. Dans la DCA, les antibiotiques semblent rester le pilier du traitement et une prise en charge ambulatoire est considérée comme l’approche optimale chez la grande majorité des patients atteints de DCA non compliquée. Cependant, une prise en charge hospitalière et des antibiotiques par voie intraveineuse sont nécessaires en cas de DCA compliquée. Actuellement, le rôle de la chirurgie d’urgence est en train de changer. La plupart des abcès associés à la diverticulite peuvent être traités par des antibiotiques intraveineux et/ou un drainage percutané et la chirurgie d’urgence ne sera considérée comme un traitement standard que chez les patients souffrant de péritonite. Enfin, la chirurgie élective après la récupération de l’ACD devrait être faite au cas par cas.
Contributions des auteurs
Gargallo CJ, Sopeña F et Lanas A ont contribué de manière égale à la conception, à la rédaction et au processus de révision de cet article.
Conflit d’intérêts
Le Dr Carla J. Gargallo et le Dr Federico Sopeña ne signalent pas de conflit d’intérêts. Le Dr Angel Lanas a été conseiller d’AlfaWasserman.
