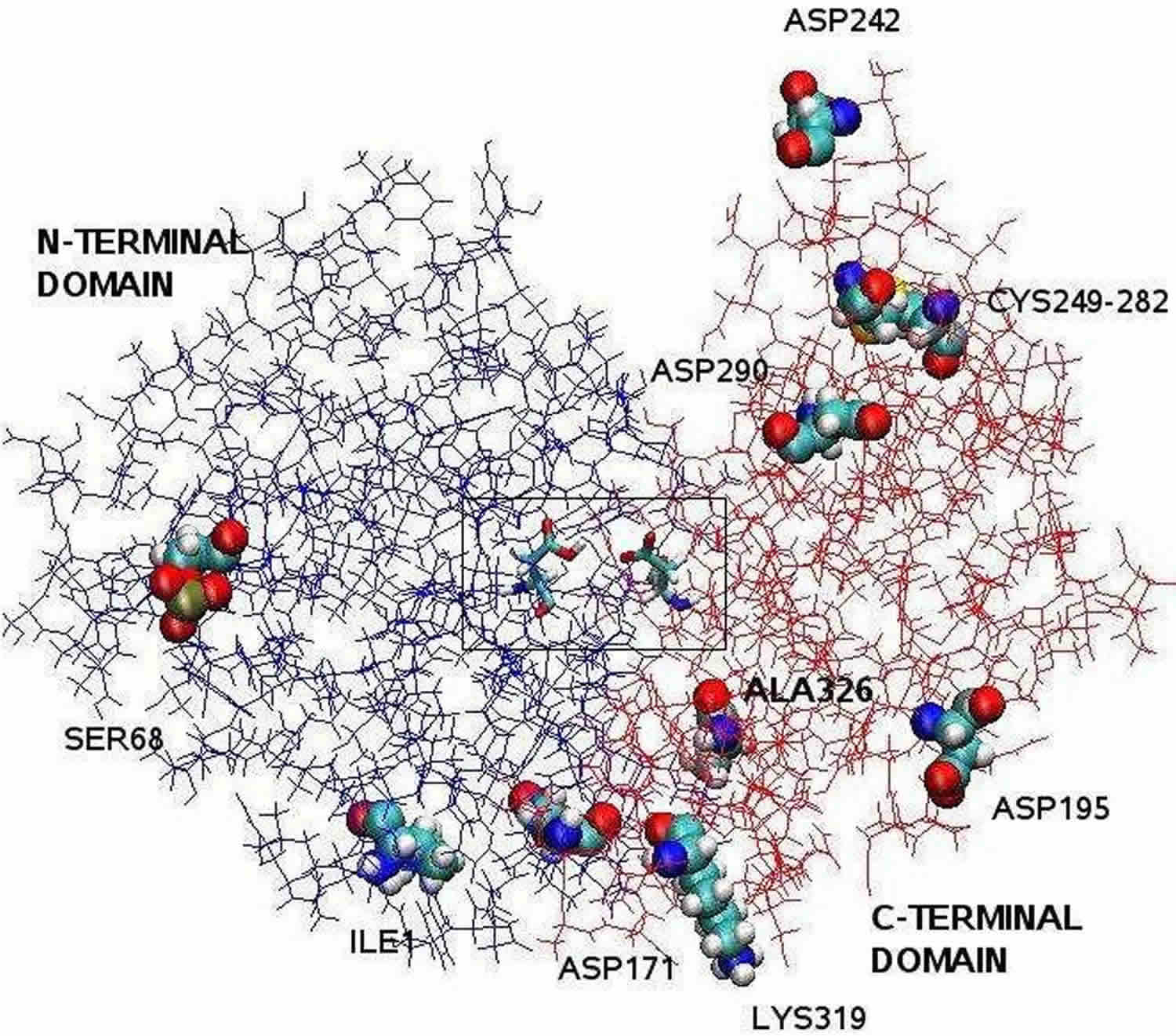
 Note de bas de page : La structure de la pepsine clarifiée par cristallographie aux rayons X est bilobée avec une grande fente de site actif entre les deux lobes. Les résidus 1 à 175 forment le domaine N-terminal, tandis que les résidus 176 à 326 constituent le domaine C-terminal. Deux aspartates au centre de la fente, Asp32 et Asp215, fonctionnent comme des résidus catalytiques. Le site catalytique, composé de l’Asp32 et de l’Asp215, est situé au centre de la fente. Les résidus d’acides aminés chargés situés à la surface de la protéine sont Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). La Ser68 phosphorylée est entièrement exposée au solvant et le pont disulfure entre la Cys 249 et la Cys 282 est situé à la surface de la protéine.
Note de bas de page : La structure de la pepsine clarifiée par cristallographie aux rayons X est bilobée avec une grande fente de site actif entre les deux lobes. Les résidus 1 à 175 forment le domaine N-terminal, tandis que les résidus 176 à 326 constituent le domaine C-terminal. Deux aspartates au centre de la fente, Asp32 et Asp215, fonctionnent comme des résidus catalytiques. Le site catalytique, composé de l’Asp32 et de l’Asp215, est situé au centre de la fente. Les résidus d’acides aminés chargés situés à la surface de la protéine sont Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). La Ser68 phosphorylée est entièrement exposée au solvant et le pont disulfure entre la Cys 249 et la Cys 282 est situé à la surface de la protéine.
La pepsine, en tant que protéase aspartique, a un optimum de pH très bas. Kondjoyan, Daudin, et Santé-Lhoutellier 9) ont étudié la digestibilité des protéines myofibrillaires ont trouvé une activité maximale de la pepsine à un pH voisin de 2. Pletschke, Naudé, et Oelofsen 10) ont étudié l’hydrolyse de l’hémoglobine par la pepsine de porc et d’autruche, et ont également trouvé un pH optimal de 2,0 pour l’activité de la pepsine. Une fois activée par un pH <4,5, l’enzyme pepsine est facilement dénaturée par un pH supérieur à 7,0, constituant des propriétés qui déterminent les caractéristiques de la pepsine 11).
Contrairement à l’influence du pH, l’effet de la force ionique sur l’activité enzymatique est moins souvent discuté. Des travaux antérieurs de Dale et White 12) ont montré que l’augmentation de la force ionique diminue clairement la vitesse de réaction de la ribonucléase pancréatique immobilisée, tandis que Butré, Wierenga et Gruppen 13) ont étudié l’hydrolyse enzymatique de l’isolat de protéines de lactosérum par l’alcalase et la neutrase, et ont également constaté que la présence de 0.5M NaCl diminuait la vitesse d’hydrolyse.
Deux puissants inhibiteurs naturels de la pepsine sont connus : la pepstatine, un pentapeptide de Streptomyces, et un inhibiteur protéique unique d’Ascaris. La pepsine subit également une rétro-inhibition ; un produit de la digestion des protéines ralentit la réaction en inhibant la pepsine 14).
Où la pepsine est-elle produite ?
Les cellules du Chef sécrètent la pepsine sous la forme d’un précurseur d’enzyme inactif appelé pepsinogène. Lorsque le pepsinogène entre en contact avec l’acide chlorhydrique des cellules pariétales, il se décompose rapidement, formant la pepsine 15). La pepsine commence la digestion de presque tous les types de protéines alimentaires en polypeptides. Cette enzyme est plus active dans un environnement acide, qui est fourni par l’acide chlorhydrique dans le jus gastrique.
Figure 2. Cellules de l’estomac (glandes gastriques)
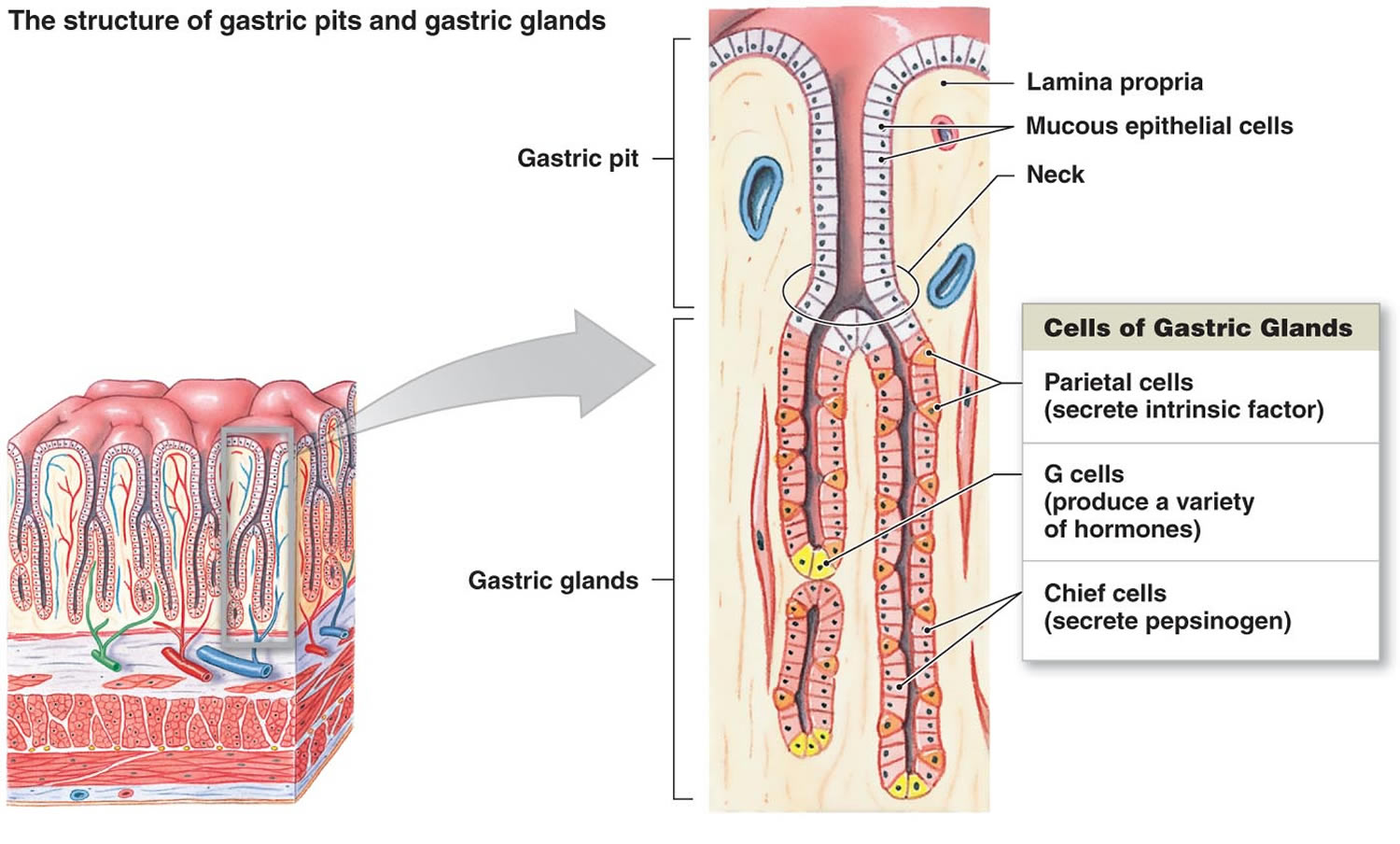 Note de bas de page : Revêtement de l’estomac. Les glandes gastriques comprennent des cellules muqueuses, des cellules pariétales et des cellules en chef. La muqueuse de l’estomac est constellée de fosses gastriques qui sont les ouvertures des glandes gastriques.
Note de bas de page : Revêtement de l’estomac. Les glandes gastriques comprennent des cellules muqueuses, des cellules pariétales et des cellules en chef. La muqueuse de l’estomac est constellée de fosses gastriques qui sont les ouvertures des glandes gastriques.
Que fait la pepsine ?
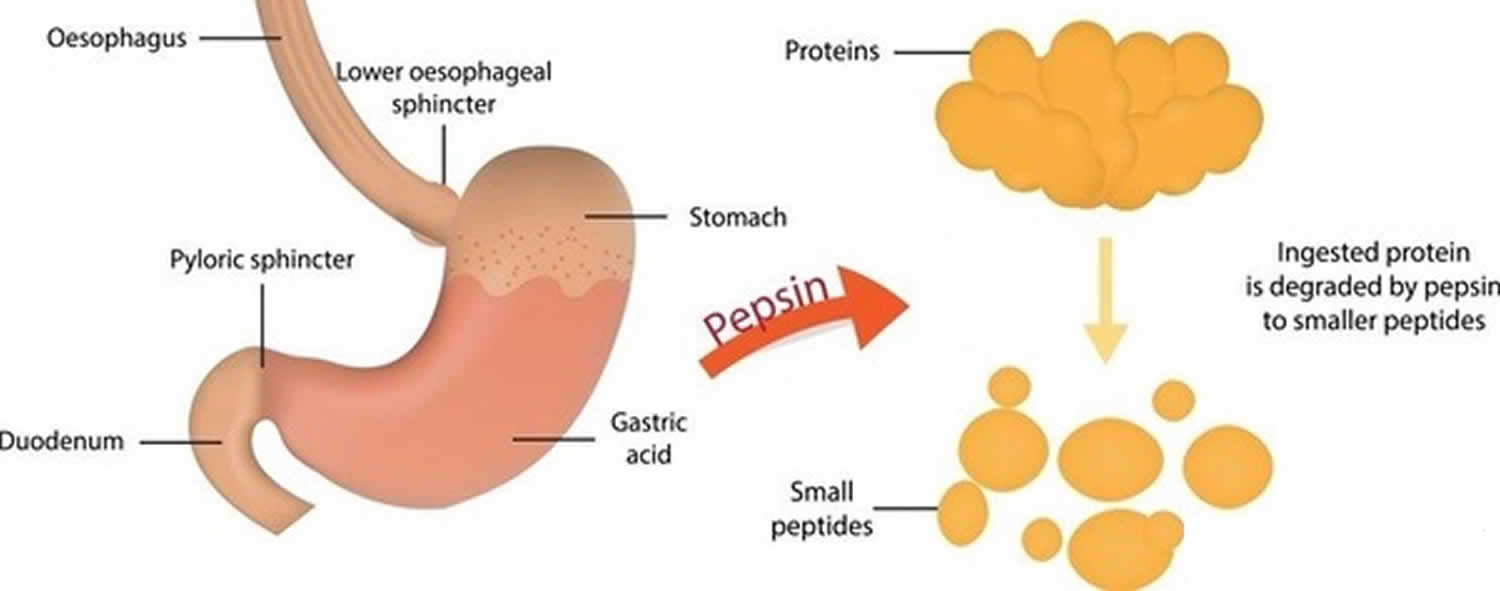
La pepsine formée à partir du pepsinogène (forme inactive de la pepsine) en présence d’acide chlorhydrique, digère presque tous les types de protéines alimentaires en polypeptides (composés protéiques plus petits). La pepsine digère les protéines dans l’acide gastrique fort. La pepsine est optimisée pour la digestion des aliments dans l’environnement acide de l’estomac et est la première protéase que les protéines alimentaires rencontrent dans le tube digestif. La pepsine est la plus active dans les environnements acides entre 37 °C et 42 °C 16).
La spécificité de la pepsine (c’est-à-dire la probabilité de clivage des liaisons peptidiques par la pepsine) est principalement influencée par les résidus d’acides aminés en position P1 et P1′, tandis que les résidus d’acides aminés d’autres sous-sites peuvent également jouer un rôle. En général, la pepsine préfère cliver après la phénylalanine, la leucine et la méthionine, alors qu’elle clive rarement après l’histidine, la lysine, la proline et l’arginine 17). Les résidus aromatiques tyrosine, tryptophane, et phénylalanine sont favorisés en position P1′. La proline est fortement défavorisée en position P2, P2′ et P3′, tandis que l’histidine, la lysine et l’arginine sont défavorisées en position P3. Les positions P4 et P4′ ont peu d’influence 18).
Figure 3. Fonction de la pepsine
.
