A periódusos rendszer általánosan használt hosszú formája az elektronkonfigurációkat hangsúlyozza. Mivel az atomok közötti kémiai kölcsönhatásokban elsősorban a legkülső (valencia) elektronok vesznek részt, az atomhoz a felépítési folyamat során utoljára hozzáadott elektron sokkal jobban érdekli a vegyészt, mint az első. Ezt az utolsó elektront nevezzük megkülönböztető elektronnak, mert ez különbözteti meg az atomot a periódusos rendszerben közvetlenül előtte lévő atomtól. Az, hogy a megkülönböztető elektron milyen alhéjba (s, p, d, f) kerül, nagyon szorosan összefügg az elem kémiai viselkedésével, és ez adja az itt látható periódusos rendszerben a színkódolás által mutatott osztályozást. A reprezentatív elemek azok, amelyekben a megkülönböztető elektron ans vagy p alhéjba kerül. A legtöbb olyan elem, amelynek kémiáját és valenciáját eddig tárgyaltuk, ebbe a kategóriába tartozik. A reprezentatív elemek számos kémiai tulajdonsága magyarázható a Lewis-diagramok alapján. Vagyis a reprezentatív elemek valenciája megjósolható a bennük lévő valenciaelektronok száma alapján, illetve abból, hogy hány elektront kellene hozzáadniuk ahhoz, hogy elérjék ugyanazt az elektronkonfigurációt, mint egy nemesgáz atomja. A reprezentatív elemek esetében a valenciaelektronok száma megegyezik a perióduscsoport számával, és a következő nemesgáz-konfigurációhoz szükséges szám 8 mínusz a csoportszám. Ez megegyezik a periódusos rendszerből levezetett valenciaszabályokkal, és az első tucat elem kloridjainak képleteit eredményezi, amelyek a valencia periódusos változását mutatják.
| Elem | Atomsúly | Hidrogénvegyületek | Az oxigénvegyületek | Klórvegyületek |
|---|---|---|---|---|
| Hidrogén | 1.01 | H2 | H2O, H2O2 | HCl |
| Hélium | 4.00 | Nem keletkezett | Nem keletkezett | Nem keletkezett |
| Lítium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Berillium | 9.01 | BeH2 | BeO | BeCl2 |
| Bór | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogén | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nem keletkezett | Nem keletkezett | Nem keletkezett |
| Nátrium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnézium | 24.31 | MgH2 | MgO | MgCl2 |
A modern periódusos rendszer első három vízszintes sora vagy periódusa teljes egészében reprezentatív elemekből áll. Az első periódusban a H és He megkülönböztető elektronjai az 1s alhéjban vannak. A második periódusban a Li és a Be megkülönböztető elektronjai a 2s alhéjban vannak, és a B-től a Ne-ig terjedő atomokban elektronok kerülnek a 2p alhéjba. A harmadik periódusban a Na és a Mg, és így az Al, Si, P, S, S, Cl és Ar esetében a 3s alhéj töltődik ki. Általános szabályként a reprezentatív elemek esetében a megkülönböztető elektron egy ns vagy np alhéjban lesz. Az n értéke, a megkülönböztető elektron fő kvantumszáma gyorsan meghatározható, ha a periódusos rendszer tetejétől lefelé számolunk. Például a jód az ötödik periódus reprezentatív eleme. Ezért a megkülönböztető elektronnak vagy az 5s vagy az 5p alhéjban kell elhelyezkednie. Mivel az I a táblázat jobb oldalán van, az 5p a helyes választás.
Ha a fő kvantumszám három vagy több, akkor d-típusú alhéjak is lehetségesek. Az átmeneti elemek vagy átmeneti fémek azok az elemek, amelyek megkülönböztető elektronja egy d-orbitálon található. Az átmeneti fémek első példái (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) a negyedik periódusban találhatók, annak ellenére, hogy a megkülönböztető elektron minden esetben 3d elektron és a harmadik héjhoz tartozik. Ez a hiatus, mint már láttuk, abból adódik, hogy a 4s alacsonyabb energiájú, mint a 3d. A 4s pálya így elkezd kitöltődni, és megkezdődik a negyedik periódus, mielőtt bármelyik 3d pálya elfoglalttá válhatna.
A \(\PageIndex{1}\) ábra összehasonlítja egy 4s és egy 3d elektron valószínűségi eloszlását egy V atomban. Bár a 4s elektronfelhő átlagosan távolabb fekszik az atommagtól, mint a 3d felhő, a 4s elektronsűrűség egy kis része nagyon közel található az atommaghoz, ahol alig van védve a +23-as teljes magtöltéstől. A teljes 4s elektronsűrűség e kis részének nagyon erős vonzóereje az, ami a 4s elektron energiáját a 3d energiája alá csökkenti.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
A tény, hogy a 4s elektronfelhő kiterjedtebb, mint a 3d, fontos hatással van az átmeneti elemek kémiájára. Amikor egy olyan atom, mint a V (\(\PageIndex{1}\ ábra) ) kölcsönhatásba lép egy másik atommal, a magtól legtávolabb eső 4s elektronok érintkeznek először a másik atommal. Így a 4s elektronok gyakran nagyobb jelentőséggel bírnak a vegyületek valenciájának és képleteinek meghatározásában, mint a 3d elektronok. A 3d elektronok az átmeneti fémek atomjainak felszíne alatt vannak “eltemetve”. Egy további 3d elektron hozzáadása lényegesen kisebb hatással van kémiai tulajdonságaikra, mint egy további 3s vagy 3p elektron hozzáadása a reprezentatív elemek esetében. Ezért a tulajdonságokban lassú, de folyamatos átmenet figyelhető meg egyik átmeneti elemről a másikra. Figyeljük meg például, hogy a Sc kivételével az összes átmeneti fém kloridokat, MCl2-t képez, ahol a fém 2 valenciájú; példák erre a TiCl2, VCl2, CrCl2 stb. Ez látható az oldal tetején található táblázatban. A 2 valencia megfelel a két 4s valenciaelektronnak.
Az átmeneti fémek mindegyike mutat más valenciákat is, ahol egy vagy több 3d elektron is szerepel. Például egyes vegyületekben a V (vanádium) 2 valenciájú (VO, VCl2), másokban 3 valenciájú (V2O3, VCl3), megint másokban 4 valenciájú (VO2, VCl4), és legalább egy esetben (V2O5) 5 valenciájú. A változó valencia miatt az átmeneti fémek kémiája bonyolultabb, és az átmeneti fémvegyületek formuláinak szélesebb választéka lehetséges. Egyes esetekben a d alhéjban lévő elektronok valenciaelektronként viselkednek, míg más esetekben nem. Bár a 3d elektronfelhők nem nyúlnak messzebbre az atommagtól, mint a 3s és a 3p (és ezért nem alkotnak másik héjat, mint a 4s elektronok), alaposan védve vannak a magtöltéstől, és ezért gyakran valenciaelektronként viselkednek. A 3d elektronoknak ez a Jekyll és Hyde viselkedése bonyolultabbá (és gyakran sokkal érdekesebbé) teszi az átmeneti elemeket tanulmányozó kémikusok életét.
| Z | Elem | Konfiguráció | ||
|---|---|---|---|---|
| 1 | H | 1s 1 | ||
| 2 | He | 1s 2 | ||
| 3 | Li | 2s 1 | ||
| 4 | Be | 2s 2 | ||
| 5 | B | 2s 2 2p1 | ||
| 6 | C | 2s 2 2p2 | ||
| 7 | N | 2s 2 2p3 | ||
| 8 | 0 | 2s 2 2p4 | ||
| 9 | F | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | ||
| 11 | Na | 3s 1 | ||
| 12 | Mg | 3s 2 | ||
| 13 | Al | 3s 2 3p1 | ||
| 14 | Si | 3s 2 3p2 | ||
| 15 | P | 3s 2 3p3 | ||
| 16 | S | 3s 2 3p4 | ||
| 17 | Cl | 3s 2 3p5 | ||
| 18 | Ar | 3s 2 3p6 | ||
| 19 | K | 4s 1 | ||
| 20 | Ca | 4s 2 | ||
| 21 | Sc | 3d 1 4s 2 | ||
| 22 | Ti | 3d 2 4s 2 | ||
| 23 | V | 3d 3 4s 2 | ||
| 24 | Cr | 3d 5 4s 1 | ||
| 25 | Mn | 3d 5 4s 2 | ||
| 26 | Fe | 3d 6 4s 2 | ||
| 27 | Co | 3d 7 4s 2 | ||
| 28 | Ni | 3d 8 4s 2 | ||
| 29 | Cu | 3d 10 4s 1 | ||
| 30 | Zn | 3d 10 4s 2 | ||
| 31 | Ga | 3d 10 4s 2 4p 1 | ||
| 32 | Ge | 3d 10 4s 2 4p 2 | ||
| 33 | As | 3d 10 4s 2 4p 3 | ||
| 34 | Se | 3d 10 4s 2 4p 4 | ||
| 35 | Br | 3d 10 4s 2 4p 5 | ||
| 36 | Kr | 3d 10 4s 2 4p 6 | ||
| 37 | Rb | 5s 1 | ||
| 38 | Sr | 5s 2 | ||
| 39 | Y | 4d 1 5s 2 | ||
| 40 | Zr | 4d 2 5s 2 | ||
| 41 | Nb | 4d 4 5s 1 | ||
| 42 | Mo | 4d 5 5s 1 | ||
| 43 | Tc | 4d 5 5s 2 | ||
| 44 | Ru | 4d 7 5s 1 | ||
| 45 | Rh | 4d 8 5s 1 | ||
| 46 | Pd | 4d 10 | ||
| 47 | Ag | 4d 10 5s 1 | ||
| 48 | Cd | 4d 10 5s 2 | ||
| 49 | In | 4d 10 5s 2 5p 1 | ||
| 50 | Sn | 4d 10 5s 2 5p 2 | ||
| 51 | Sb | 4d 10 5s 2 5p 3 | ||
| 52 | Te | 4d 10 5s 2 5p 4 | ||
| 53 | I | 4d 10 5s 2 5p 5 | ||
| 54 | Xe | 4d 10 5s 2 5p 6 | ||
| 55 | Cs | 6s 1 | ||
| 56 | Ba | 6s 2 | ||
| 57 | La | 5d 1 6s 2 | ||
| 58 | Ce | 4f 1 5d 1 6s 2 | ||
| 59 | Pr | 4f 3 6s 2 | ||
| 60 | Nd | 4f 4 6s 2 | ||
| 61 | Pm | 4f 5 6s 2 | ||
| 62 | Sm | 4f 6 6s 2 | ||
| 63 | Eu | 4f 7 6s 2 | ||
| 64 | Gd | 4f 7 5d 1 6s 2 | ||
| 65 | Tb | 4f 9 6s 2 | ||
| 66 | Dy | 4f 10 6s 2 | ||
| 67 | Ho | 4f 11 6s 2 | ||
| 68 | Er | 4f 12 6s 2 | ||
| 69 | Tm | 4f 13 6s 2 | ||
| 70 | Yb | 4f 14 6s 2 | ||
| 71 | Lu | 4f 14 5d 1 6s 2 | ||
| 72 | Hf | 4f 14 5d 2 6s 2 | ||
| 73 | Ta | 4f 14 5d 3 6s 2 | ||
| 74 | W | 4f 14 5d 4 6s 2 | ||
| 75 | Re | 4f 14 5d 5 6s 2 | ||
| 76 | 0s | 4f 14 5d 6 6s 2 | ||
| 77 | Ir | 4f 14 5d 7 6s 2 | ||
| 78 | Pt | 4f 14 5d 9 6s 1 | ||
| 79 | Au | 4f 14 5d 10 6s 1 | ||
| 80 | Hg | 4f 14 5d 10 6s 2 | ||
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | ||
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | ||
| 83 | Bi II. | 4f 14 5d 10 6s 2 6p 3 | ||
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | ||
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | ||
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | ||
| 87 | Fr | 7s 1 | ||
| 88 | Ra | 7s 2 | ||
| 89 | Ac | 6d 1 7s 2 | ||
| 90 | Th | 6d 2 7s 2 | ||
| 91 | Pa | 5f 2 6d 1 7s 2 | ||
| 92 | U | 5f 3 6d 1 7s 2 | ||
| 93 | Np | 5f 4 6d 1 7s 2 | ||
| 94 | Pu | 5f 6 7s 2 | ||
| 95 | Am | 5f 7 7s 2 | ||
| 96 | Cm | 5f 7 6d 1 s 2 | ||
| 97 | Bk | 5f 9 s 2 | ||
| 98 | Cf | 5f 10 s 2 | ||
| 99 | Es | 5f 11 s 2 | ||
| 100 | Fm | 5f 12 s 2 | ||
| 101 | Md | 5f 13 s 2 | ||
| 102 | No | 5f 14 s 2 | ||
| 103 | Lr | 5f 14 6d 1 s 2 | ||
| 104 | Rf | 5f 14 6d 2 s 2 |
Az elemek harmadik nagy kategóriája akkor keletkezik, ha a megkülönböztető elektron f alhéjat foglal el. Az első példa a lantanoidok (57 és 71 közötti atomszámú elemek) esetében fordul elő. a lantanoidok általános elektronkonfigurációja
4d104f i5s25p65d0 vagy 16s2
ahol i egy 0 és 14 közötti szám. A lantanoidok felépítési folyamatában tehát az elektronok egy olyan alhéjba (4f) kerülnek, amelynek fő kvantumszáma kettővel kisebb, mint a legkülső orbitálisé (6s). Egy másik elektron hozzáadása egy olyan mélyen eltemetett belső héjhoz, mint a 4f, alig vagy egyáltalán nem befolyásolja ezen elemek kémiai tulajdonságait. Mindegyikük nagyon hasonlít a lantánhoz (La), és a periódusos rendszerben pontosan ugyanarra a helyre kerülhetnek, mint a La. A lanthanoid elemek annyira hasonlítanak egymásra, hogy elkülönítésükhöz speciális technikákra van szükség. Ennek eredményeként legtöbbjükből még megközelítőleg tiszta mintákat sem tudtak előállítani egészen az 1870-es évekig. Az aktínium (Ac) elemet követően egy sor olyan atom következik, amelyekben az 5f alhéj kitöltése történik. Az aktinoidok valamivel kevésbé hasonlítanak az Ac-ra, mint a lantanoidok a La-ra, mert a Th, Pa és U esetében a kitöltési orbitálisok szokásos sorrendjétől némi eltérés tapasztalható (\(\(\PageIndex{1}\) ) táblázat.
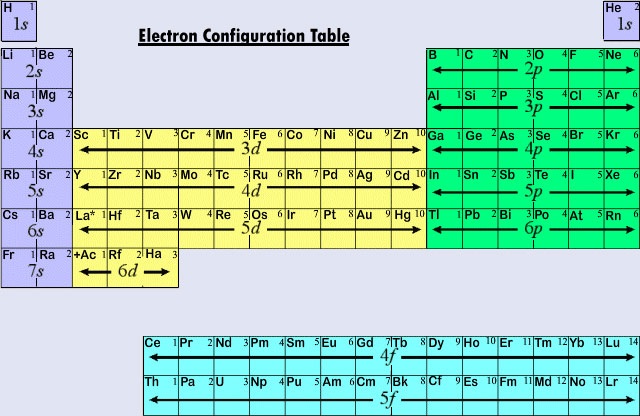
Mert mivel a lantanoidok és az aktinoidok többsége kémiailag úgy viselkedik, mintha a periódusos rendszer IIIB csoportjába tartoznának (ahol az Lu és az Lr található), mindkét csoportot elkülönítettük a táblázat többi részétől, és egy blokkban együtt helyeztük el alatta. A lantanoidokat és az aktinoidokat együttesen belső átmeneti elemeknek nevezik, mivel a betöltött f alhéjak olyan mélyen fekszenek az atomjaik fennmaradó elektronszerkezetében.
A \(\PageIndex{2}\) ábra összefoglalja, hogy a periódusos rendszer különböző régióiban található elemek atomjainál milyen típusú alhéjban található a megkülönböztető elektron. Ez az összefoglaló információ viszonylag egyszerűvé teszi a periódusos rendszer használatát az elektronkonfigurációk meghatározásához, amint azt a következő példa mutatja.
Példa \(\PageIndex{1}\): Elektronkonfiguráció
Meghatározzuk az elektronkonfigurációt a) Nb; b) Pr.
megoldás
a) Az Nb, a 41. elem, az ötödik periódusban és a periódusos rendszer azon régiójában található, ahol egy d alhéj töltődik ki (a második átmeneti sorozat). A periódusos rendszerben visszafelé haladva (az alacsonyabb atomszámok felé) a legközelebbi nemesgáz a Kr, ezért a Kr magot használjuk:
Nb _____
A 36K után a következő elem a 37Rb, amelyben az 5s alhéj töltődik ki. Még egy helyet jobbra lépve elérkezünk a 38Sr-hez, amelynek 5s2 párja van. Eddig Nb _____ 5s2 az Nb konfigurációhoz. Most tovább megyünk jobbra a periódusos rendszer 4d alhéj régiójába, és három helyet (Y, Zr, Nb) számolunk át, hogy elérjük az Nb-t. A teljes elektronkonfiguráció tehát Nb 4d35s2 (Megjegyzendő, hogy a d alhéj fő kvantumszáma 4 – eggyel kevesebb, mint a periódus száma. Továbbá, ha megnézzük az elektronkonfigurációk táblázatát, meg kell jegyezni, hogy az Nb kivételt képez a tipikus pályatöltési szabályok alól) b) Hasonló eljárást követünk az 59-es elemszámú Pr esetében is. A táblázatban visszafelé haladva a legközelebbi nemesgáz a Xe, ezért a Xe magot használjuk. Ismét előrefelé számolva a Cs és a Ba megfelel a 6s2-nek. Ezután a La, Ce és Pr további három elektronnak felel meg a 4f alhéjban. A konfiguráció tehát Pr…4f36s2
Még egy dolgot kell hangsúlyozni az elektronkonfiguráció és a periódusos rendszer közötti kapcsolatról. A periódusos rendszer azonos függőleges oszlopában lévő elemek atomjai hasonló elektronkonfigurációval rendelkeznek. Vegyük például az alkáliföldfémeket (IIA csoport). Az elektronkonfigurációk származtatására vonatkozó szabályainkat (1. példa) alkalmazva
| Elem | Elektronkonfiguráció | Lewis-diagram |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Tehát az ezen elemek kémiai viselkedésének és valenciájának korábban említett hasonlóságai korrelálnak a legkülső elektronfelhőik hasonlóságaival. Ezek a hasonlóságok magyarázzák Mendelejev felfedezetlen elemek tulajdonságaira vonatkozó előrejelzéseinek sikerét.
Megosztók és hozzászólások
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff és Adam Hahn.
