\
A só azonban a benne lévő ionok sav-bázis tulajdonságaitól függően vízben oldódva semleges, bázikus vagy savas oldatot kaphat.
Amikor egy só, például \(NaCl\) vízben oldódik, \(Na^+_{(aq)}\) és \(Cl^-_{(aq)}\) ionok keletkeznek. A Lewis-féle megközelítést alkalmazva az \(Na^+\) ion savnak tekinthető, mivel elektronpár-akceptor, bár alacsony töltése és viszonylag nagy sugara miatt nagyon gyenge sav. A \(Cl^-\) ion az erős sav \(HCl\) konjugált bázisa, tehát lényegében nincs bázikus jellege. Következésképpen \(NaCl\) vízben való feloldása nincs hatással az oldat \(pH\) értékére, és az oldat semleges marad.
Most hasonlítsuk össze ezt a viselkedést a kálium-cianid és a nátrium-acetát vizes oldatainak viselkedésével. Itt is a kationok (\(K^+\) és \(Na^+\)) lényegében nem savas jellegűek, de az anionok (\(CN^-\) és \(CH_3CO_2^-\)) gyenge bázisok, amelyek képesek reagálni a vízzel, mivel a gyenge savak \(HCN\) és az ecetsav konjugált bázisai.
\
\
Az írás szerint egyik reakció sem halad nagyon jobbra, mert a gyengébb sav-bázis pár kialakulása előnyös. Mind a \(HCN\), mind az ecetsav erősebb sav, mint a víz, a hidroxid pedig erősebb bázis, mint az acetát vagy a cianid, így az egyensúly mindkét esetben balra esik. Mindazonáltal mindegyik reakcióban elegendő hidroxidion keletkezik ahhoz, hogy bázikus oldatot kapjunk. Például egy 0,1 M nátrium-acetát vagy kálium-cianid 0,1 M-os oldatának \(pH\) értéke 25 °C-on 8,8, illetve 11,1. A \(\PageIndex{1}\) táblázatból és a \(\PageIndex{1}\) ábrából látható, hogy a \(CN^-\) erősebb bázis (\(pK_b = 4,79\)), mint az acetát (\(pK_b = 9.24\)), ami összhangban van azzal, hogy \(KCN\) azonos koncentráció mellett bázikusabb oldatot ad, mint a nátrium-acetát.
Ezzel szemben egy gyenge bázis konjugált savának gyenge savnak kell lennie (\(\ref{16.2}\) egyenlet). Például az ammónium-klorid és a piridinium-klorid az ammónia, illetve a piridin \(HCl\) reakciójával előállított sók. Mint már tudjuk, a kloridion olyan gyenge bázis, hogy vízzel nem lép reakcióba. Ezzel szemben a két só kationjai gyenge savak, amelyek a következőképpen reagálnak a vízzel:
\
\
Egyenlet \(\ref{16.2}\) azt mutatja, hogy \(H_3O^+\) erősebb sav, mint \(NH_4^+\) vagy \(C_5H_5NH^+\), és fordítva, az ammónia és a piridin egyaránt erősebb bázis, mint a víz. Az egyensúly tehát mindkét esetben messze balra esik, és a gyengébb sav-bázis párosnak kedvez. A reakciók során keletkező \(H_3O^+\) koncentráció azonban elég nagy ahhoz, hogy az oldat \(pH\) értéke jelentősen csökkenjen: az ammónium-klorid vagy a piridinium-klorid 0,10 M-os oldatának \(pH\) értéke 25°C-on 5,13, illetve 3,12 lesz. Ez összhangban van a 16.2. ábrán látható információval, ami arra utal, hogy a piridiniumion savasabb, mint az ammóniumion.
Mi történik egy olyan só, például az ammónium-acetát vizes oldatával, ahol mind a kation, mind az anion külön-külön reagálhat vízzel, és így sav, illetve bázis keletkezik? A 16.10. ábra szerint az ammóniumion csökkenti a \(pH\) értékét, míg a \(\ref{16.3}\) egyenlet szerint az acetátion növeli a \(pH\) értékét. Ez a különleges eset szokatlan, mivel a kation ugyanolyan erős sav, mint az anion bázis (pKa ≈ pKb). Következésképpen a két hatás kioltja egymást, és az oldat semleges marad. Az olyan sók esetében, amelyekben a kation erősebb sav, mint az anion bázis, a végső oldat \(pH\) < 7,00. Ezzel szemben, ha a kation gyengébb sav, mint az anion bázis, akkor a végső oldat \(pH\) > 7,00.
A fémionok egyszerű sóinak oldata is lehet savas, még akkor is, ha a fémion nem tud közvetlenül protont adni a víznek, hogy \(H_3O^+\) keletkezzen. Ehelyett a fémion Lewis-savként viselkedhet, és kölcsönhatásba léphet a vízzel, a Lewis-bázissal, az oxigénatomon lévő magányos elektronpárral való koordináció révén, hidratált fémiont képezve (\(\(\PageIndex{1}\) ábra a) rész). A fémionhoz koordinált vízmolekula két okból savasabb, mint a szabad vízmolekula. Először is, a pozitív töltésű fémion és a koordinált vízmolekula részben pozitív töltésű hidrogénatomjai közötti taszító elektrosztatikus kölcsönhatások miatt a koordinált víz könnyebben veszít egy protont.
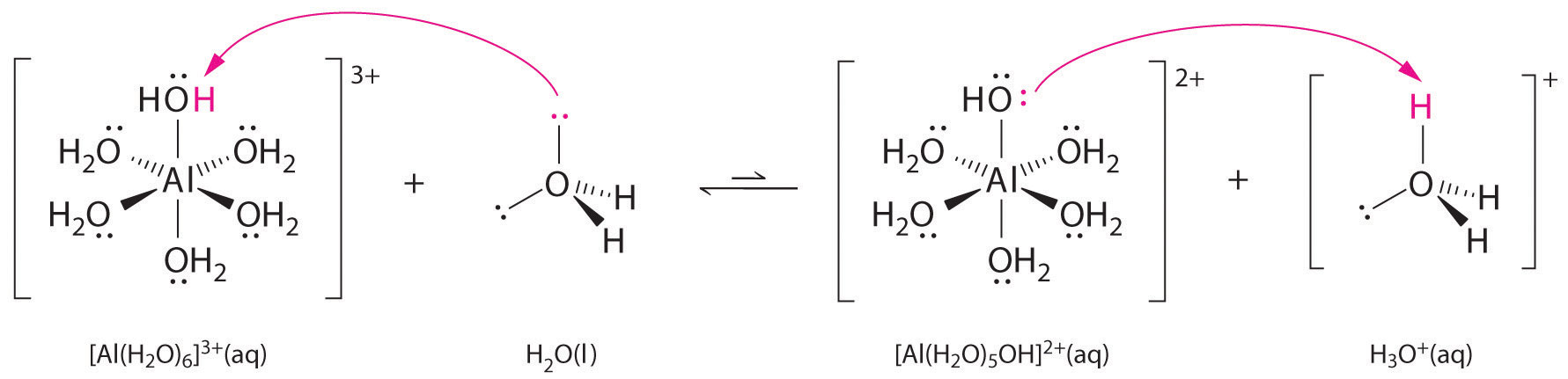
Második, a \(Al^{3+}\) ion pozitív töltése elektronsűrűséget vonz a vízmolekulák oxigénatomjaiból, ami csökkenti az elektronsűrűséget a \(\ce{O-H}\) kötésekben, ahogy az \(\(\PageIndex{1}\) ábra b) részében látható. Mivel az \(O\) atomok és a H atomok között kisebb az elektronsűrűség, a \(\ce{O-H}\) kötések gyengébbek, mint a szabad \(H_2O\) molekulában, így könnyebb elveszíteni egy \(H^+\) iont.
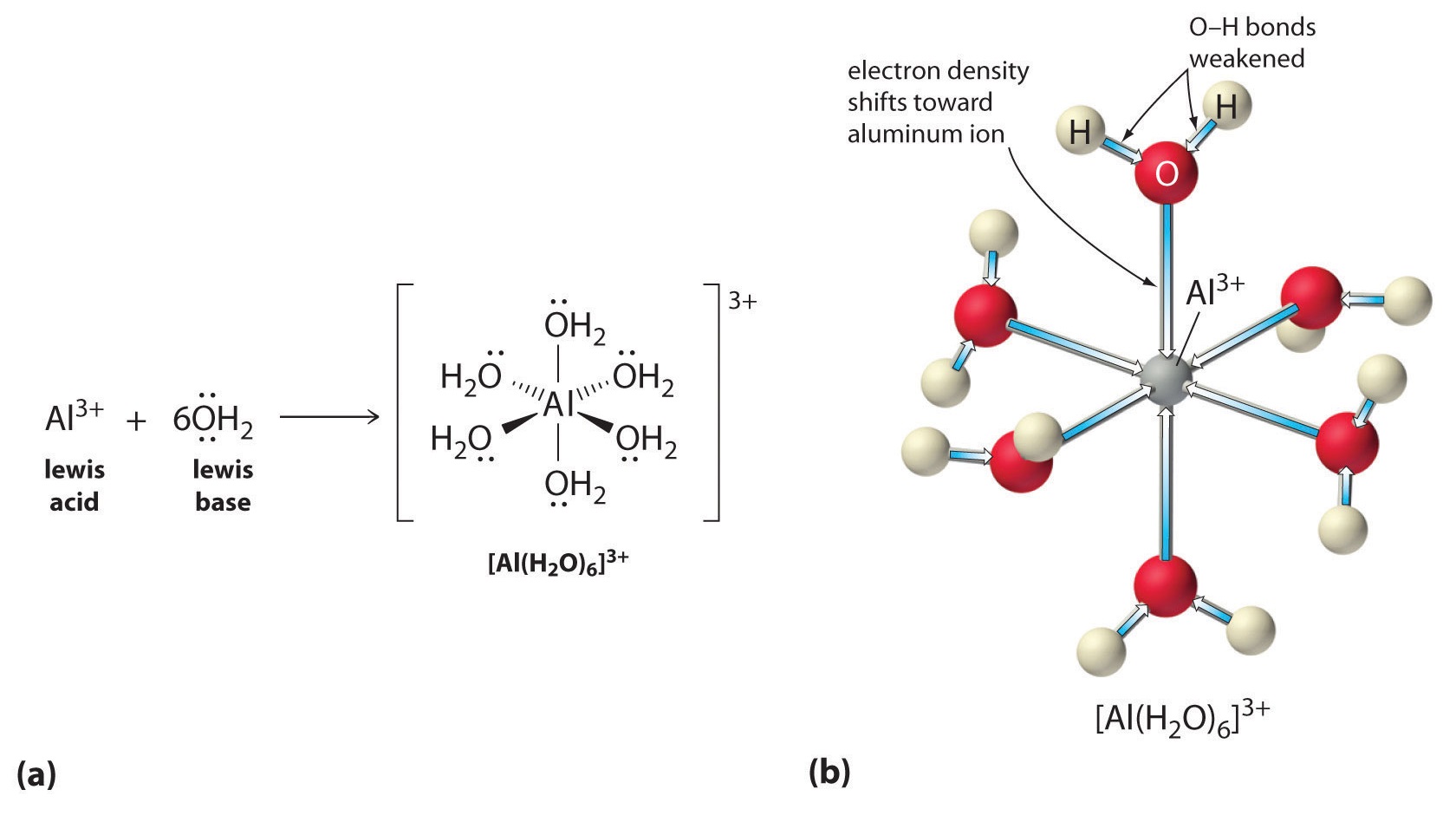
ábra \(\PageIndex{1}\): A fémion hatása a víz savasságára a) A fémion \(Al^{3+}\) reakciója vízzel a hidratált fémion képződésével a Lewis-sav-bázis reakció példája. (b) Az alumíniumion pozitív töltése elektronsűrűséget vonz az oxigénatomokról, ami eltolja az elektronsűrűséget az O-H kötésekről. Az elektronsűrűség csökkenése gyengíti a vízmolekulák O-H kötéseit, és megkönnyíti számukra a protonvesztést.
A hatás nagysága a következő két tényezőtől függ (\(\(\PageIndex{2}\) ábra):
- A fémion töltése. Egy kétértékű ion (\(M^{2+}\)) körülbelül kétszer olyan erős hatással van a koordinált vízmolekula elektronsűrűségére, mint egy azonos sugarú egyértékű ion (\(M^+\)).
- A fémion sugara. Azonos töltésű fémionok esetén minél kisebb az ion, annál rövidebb az internukleáris távolság a vízmolekula oxigénatomjától, és annál nagyobb a fém hatása a vízmolekulán belüli elektronsűrűség-eloszlásra.
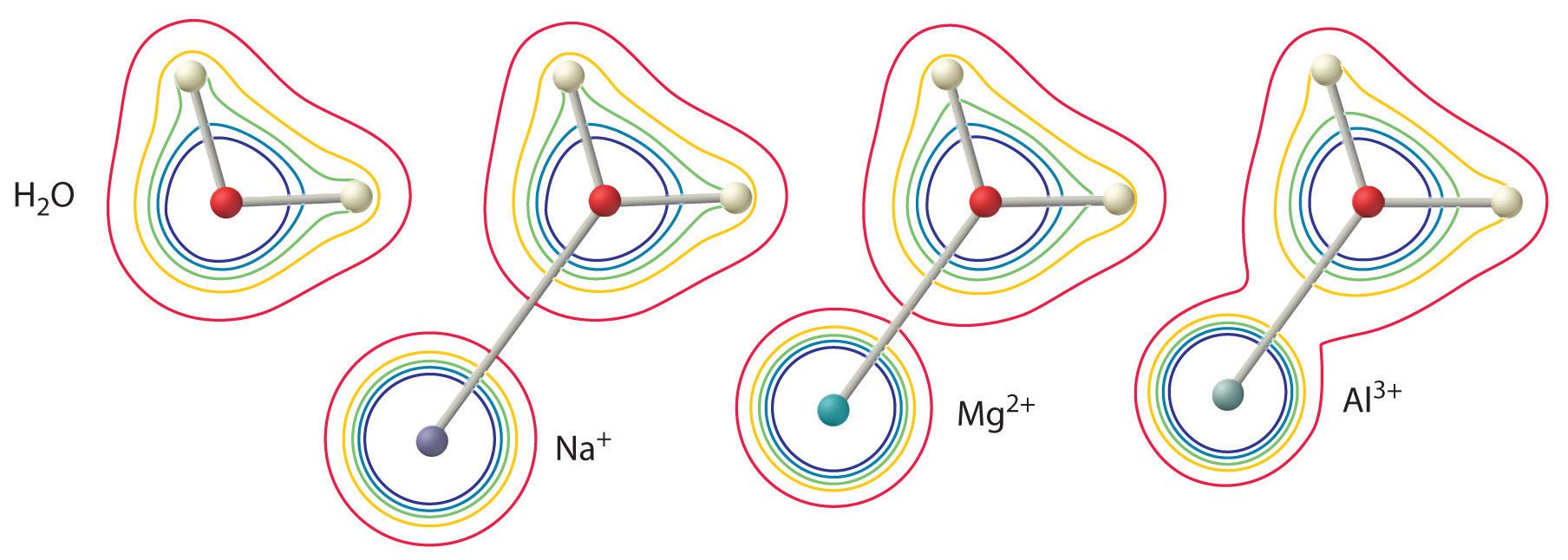
Ábra \(\PageIndex{2}\): A fémion töltésének és sugarának hatása a koordinált vízmolekula savasságára. A kontúrok az O- és H-atomok elektronsűrűségét mutatják egy szabad vízmolekulában (balra) és \(Na^+\), \(Mg^{2+}\) és \(Al^{3+}\) ionokkal koordinált vízmolekulákban. Ezek a kontúrtérképek azt mutatják, hogy a legkisebb, legnagyobb töltésű fémion (\(Al^{3+}\)) okozza a legnagyobb csökkenést a vízmolekula O-H kötéseinek elektronsűrűségében. E hatás következtében a hidratált fémionok savassága a fémion töltésének növekedésével és sugarának csökkenésével nő.
Ezért a kis, nagy töltésű fémionok, mint az \(Al^{3+}\) és \(Fe^{3+}\) vizes oldatai savasak:
\^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
Az \(^{3+}\) ion \(pK_a\) értéke 5,0, így majdnem olyan erős sav, mint az ecetsav. A korábban ismertetett két tényező miatt a fémionnak a koordinált vízmolekulák savasságára gyakorolt hatásának előrejelzésében a legfontosabb paraméter a fémion töltés-sugár aránya. A periódusos rendszerben egy átlós vonalon elhelyezkedő számos fémionpár, mint például \(Li^+\) és \(Mg^{2+}\) vagy \(Ca^{2+}\) és \(Y^{3+}\), különböző méretű és töltésű, de hasonló töltés-sugár arányú. Ennek eredményeként ezek a fémionpárok hasonló hatással vannak a koordinált vízmolekulák savasságára, és gyakran más jelentős kémiai hasonlóságokat is mutatnak.
A kis, nagy töltésű fémionok oldatai vízben savasak.
Az ebben a fejezetben tárgyaltakhoz hasonló reakciókat, amelyekben egy só vízzel reagálva savas vagy bázikus oldatot kap, gyakran hidrolízisreakcióknak nevezik. Külön nevet használni erre a reakciótípusra nem szerencsés, mert azt sugallja, hogy ezek valahogyan különböznek egymástól. Valójában a hidrolízisreakciók csak sav-bázis reakciók, amelyekben a sav egy kation, illetve a bázis egy anion; ugyanazoknak az elveknek és szabályoknak engedelmeskednek, mint az összes többi sav-bázis reakció.
A hidrolízisreakció sav-bázis reakció.
Példa \(\PageIndex{1}\)
Mondja meg, hogy e vegyületek vizes oldatai savasak, bázisosak vagy semlegesek-e.
- \(KNO_3\)
- \(CrBr_3 cdot H_2O\)
- \(Na_2SO_4\)
Adott: vegyület
Kérdezett: Vizes oldat savassága vagy bázicitása
Stratégia:
- Értelmezze a kation és az anion sav-bázis tulajdonságait. Ha a kation gyenge Lewis-sav, akkor nem befolyásolja az oldat \(pH\) értékét. Ha azonban a kation egy gyenge bázis vagy egy viszonylag nagy töltésű fémkation konjugált sava, akkor a vízzel reakcióba lépve savas oldatot kap.
- Ha az anion egy erős sav konjugált bázisa, akkor nem befolyásolja az oldat \(pH\) értékét. Ha viszont az anion egy gyenge sav konjugált bázisa, akkor az oldat bázikus lesz.
Az oldat:
a
- Az \(K^+\) kation kis pozitív töltéssel (+1) és viszonylag nagy sugárral rendelkezik (mert a periódusos rendszer negyedik sorában áll), ezért nagyon gyenge Lewis-sav.
- A \(NO_3-\) anion egy erős sav konjugált bázisa, tehát lényegében nincs bázikus jellege (16.1. táblázat). Ezért sem a kation, sem az anion nem reagál vízzel \(H^+\) vagy \(OH^-\) előállítására, és az oldat semleges lesz.
b.
- A \(Cr^{3+}\) ion egy viszonylag nagy töltésű fémkation, amelynek az \(Al^{3+}\) ionhoz hasonlóan kell viselkednie, és \(^{3+}\) komplexet kell képeznie, amely gyenge savként fog viselkedni: \^{3+}_{(aq)} \ce{ <=>>}} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_{(aq)} \nincs szám\]
- A \(Br^-\) anion nagyon gyenge bázis (az erős sav \(HBr\) konjugált bázisa), így nem befolyásolja az oldat \(pH\) értékét. Ezért az oldat savas lesz.
c.
- Az \(Na^+\) ion, akárcsak a \(K^+\), nagyon gyenge sav, ezért nem befolyásolhatja az oldat savasságát.
- Ezzel szemben a \(SO_4^{2-}\) az \(HSO_4^-\) konjugált bázisa, ami gyenge sav. Ezért az \(SO_4^{2-}\) ion a 16.6. ábrán látható módon reagál a vízzel, és enyhén bázikus oldatot kap.
Feladat \(\PageIndex{1}\)
Jósold meg, hogy az alábbiak vizes oldata savas, bázikus vagy semleges.
- semleges
- savas
- bázikus (az \(HS^-\) vízzel való reakciója következtében \(H_2S\) és \(OH^-\) keletkezik)
Összefoglaló
A só vízben oldódva semleges, bázikus vagy savas oldatot képez, attól függően, hogy anionként egy gyenge sav konjugált bázisát (\(A^-\)), kationként egy gyenge bázis konjugált savát (\(BH^+\)) vagy mindkettőt tartalmazza. A kis, nagy töltésű fémionokat tartalmazó sók savas oldatokat képeznek a vízben. Egy sónak a vízzel savas vagy bázikus oldatot eredményező reakcióját hidrolízisreakciónak nevezzük.
