BEVEZETÉS
Az elmúlt években végzett alapkutatások és klinikai kutatások közvetlen, kétirányú kapcsolatot állapítottak meg a krónikus vesebetegség és a szív- és érrendszeri betegségek között.1,2 A mindennapi klinikai gyakorlatban a szérum kreatininkoncentrációt és a Cockcroft-Gault3 képlet vagy a Modification of Diet in Renal Disease (MDRD)4 egyenlet segítségével becsült glomeruláris szűrési sebességet általában a vesefunkció becslésére használják. A plazma kreatininkoncentrációt azonban számos tényező befolyásolhatja, például a beteg életkora, neme, izomtömege, fizikai aktivitása, étrendje és gyógyszerezése.5
A cisztatin C a cisztein-proteáz fehérje inhibitora, amelyet minden sejtmagvú sejt stabil sebességgel szintetizál. Alacsony molekulatömege és magas izoelektromos pontja miatt szinte kizárólag glomeruláris szűréssel eliminálható. A cisztatin C koncentrációját nem befolyásolja az életkor, a nem vagy a fehérjefogyasztás, és érzékeny a glomeruláris filtráció kis változásaira. E jellemzők miatt a plazma cisztatin C-koncentrációját a glomeruláris filtrációs állapot legjobb markerei között tartják számon.6-9 A közelmúltban több tanulmány is beszámolt az emelkedett cisztatin C-értékek és a szív- és érrendszeri szövődmények kialakulása közötti összefüggésről koszorúér-betegségben szenvedő betegeknél. Jelenleg nem ismert, hogy ez az összefüggés annak köszönhető-e, hogy a cisztatin C jobb markere a vesefunkciónak, mint a szérumkreatinin, vagy a glomeruláris filtráción kívül vannak-e olyan tényezők, amelyek befolyásolják e fehérje koncentrációját, és ráadásul összefüggésben vannak a kardiovaszkuláris kockázattal10.
A vizsgálat célja az volt, hogy felmérje a plazma cisztatin C koncentrációjának prognosztikai értékét a magas kockázatú akut koronária szindróma (ACS) miatt kórházba került betegeknél, valamint hogy megvizsgálja a cisztatin C és a vesefunkció és a gyulladás egyéb markerei közötti kapcsolatot.
MÓDSZEREK
Ez egy 2006 májusa és 2007 júliusa között végzett prospektív, megfigyeléses vizsgálat. Összesen 203, 18 évnél idősebb, a központunk kardiológiai intenzív osztályán (intenzív osztály) nagy kockázatú ACS diagnózissal konzekvensen kórházba került beteget vontunk be.
A nagy kockázatú ACS diagnosztikai kritériumai közé tartozott a következő tényezők közül legalább kettő: iszkémiás jellegzetességű fájdalom, iszkémiára utaló elektrokardiográfiás elváltozások és/vagy emelkedett myocardialis necrosis markerek. Az alkalmazott kezelés és a beteg kórházi tartózkodása során elvégzett további vizsgálatok a kezelőorvos klinikai döntésein alapultak. A legtöbb betegnél invazív stratégiát alkalmaztak, amely magában foglalta a sürgős koszorúér-angiográfiát (ST szegmensemelkedéssel vagy bal ági blokkkal járó szívinfarktus esetén) vagy a kórházi felvételt követő első 24-72 órában végzett korai tervezett koszorúér-angiográfiát.
Klinikai jellemzők
A betegek klinikai kartonjából a következő adatokat rögzítették: demográfiai adatok, klasszikus kardiovaszkuláris kockázati tényezők jelenléte (diabetes mellitus, szisztémás hipertónia, diszlipidémia és dohányzás), valamint ismert érbetegségek (ischaemiás szívbetegség, cerebrovaszkuláris betegség, perifériás artériás betegség és korábbi myocardialis revaszkularizációs kezelés). Az egyéb elemzett klinikai változók közé tartozott az ACS típusa, a Killip-osztály a kórházi felvétel idején, a szisztolés és diasztolés nyomásértékek, a pulzusnyomás (a szisztolés és diasztolés artériás nyomás különbségeként becsülve) és a pulzusszám.
Minden betegnél echokardiográfiát végeztek, amelynek során a bal kamrai ejekciós frakciót Simpson-módszerrel becsülték 4 kamrás megközelítéssel; a sinusritmusú betegeknél 3 meghatározás átlagát, a pitvarfibrilláló betegeknél 5 meghatározás átlagát számították ki.
A betegek 95%-ánál koronarográfiát végeztek, és a koszorúér-elváltozások súlyosságát az érintett epikardiális koszorúerek számán alapuló pontszámmal értékelték.
Analitikai adatok
A kiindulási hemoglobin-, hematokrit-, leukocita-, glükóz- és kreatininértékeket a kórházi felvételkor a központunkban végzett első laborvizsgálatok során rögzítették. Az összkoleszterin, a nagy sűrűségű lipoprotein-koleszterin (HDL-C), a kis sűrűségű lipoprotein-koleszterin (LDL-C), a glükóz, a nagy érzékenységű C-reaktív fehérje és a cisztatin C koncentrációját az első 24 órában rögzítettük, a troponin I (TpI) csúcsértékével együtt.
A cisztatin C-t automatizált homogén immunpróba segítségével, Dade-Behring BN ProSpec nefelométerrel mértük. Az elemzéshez használt reagens a fehérje elleni antitestekkel bevont polisztirol részecskékből állt, amelyek a cisztatin C-t tartalmazó mintákkal keverve agglutinálódnak, és az analit koncentrációjával arányos intenzitással szórják a fényt.
A felnőttek szérum cisztatin C koncentrációjának referenciaintervalluma az alkalmazott nefelometriás módszerrel 0,51-0,95 mg/L. A nagy érzékenységű C-reaktív fehérje koncentrációját szintén immunpróbával határozták meg. A glomeruláris szűrési sebességet az MDRD-egyenlettel becsülték.
Az elemzett epizódok
Az elemzett kardiovaszkuláris szövődmények közé tartozott a kórházi halálozás, a követés során bekövetkező összhalálozás, új szívinfarktus kialakulása, amelyet mellkasi fájdalomként vagy azzal egyenértékű, EKG-változással járó anginális fájdalomként definiáltak, vagy emelkedett tumor nekrózis markerek a kórházi kezelést követő első 24 órában (a koronária intervenciós eljárások után emelkedett markereket mutató betegeket kizárták), valamint a szívelégtelenség kialakulása a kórházi kezelés vagy a követés során.
Klinikai követés
A követés átlagosan 186 (SD, 110; medián, 156) nap volt, amely idő alatt a betegek összes klinikai eseményét rögzítették. A nyomon követés telefonos kapcsolatfelvétel útján, ambulanciákon és a betegek kórházi kórlapjainak áttekintésével történt.
Statisztikai elemzés
Minden információt prospektív módon rögzítettek egy Microsoft Office Access 2003 SP2 programmal létrehozott adatbázisban. A statisztikai elemzéseket az SPSS (Statistical Package for the Social Sciences) 12.0-s verziójával végeztük. A kategorikus vagy dichotóm változókat abszolút értékekben és százalékokban fejeztük ki, és a Pearson χ2 teszttel hasonlítottuk össze. A normális eloszlású folytonos változókat átlagértékként (SD) írtuk le, és a csoportok közötti összehasonlításhoz a Student t-tesztet használtuk. A nem Gauss-eloszlást mutató változókat Mann-Whitney U-teszttel hasonlítottuk össze.
A cisztatin C koncentráció és a nagy érzékenységű C-reaktív fehérje, valamint a glomeruláris szűrési sebesség összefüggéseinek értékelésére a Spearman-féle korrelációs együtthatót használtuk. Logisztikus regressziós elemzéssel értékelték a klinikai és laboratóriumi tényezők független szerepét a cisztatin C tekintetében a kardiovaszkuláris szövődmények kialakulásának előrejelzésében a kórházi kezelés során, beleértve az egyváltozós elemzésben szignifikáns változókat is. A kiigazított esélyhányadosokat és a 95%-os konfidenciaintervallumokat (CI) mutattuk be. A követés során Kaplan-Meier-túlélési görbéket készítettünk, és a hosszú rangú teszt segítségével hasonlítottuk össze.
A vizsgált populáció leíró elemzésének elvégzéséhez néhány mennyiségi változót intervallumokba soroltunk: a glomeruláris szűrési ráta (>90, 90-60, 55% és 0,95 és
A .05-nél kisebb P-értéket statisztikailag szignifikánsnak tekintettük.
EREDMÉNYEK
2006 májusától 2007 júliusáig 203, magas kockázatú ACS diagnózissal kórházba került beteget vontak be a vizsgálatba. Az átlagéletkor 66,6 (13,16) év volt. A betegek 62,1%-ánál (n=126) nem ST-elevációs ACS, 37,9%-ánál (n=77) pedig ST-elevációs ACS fordult elő. A vizsgált populáció kiindulási jellemzőit az 1. táblázat tartalmazza.
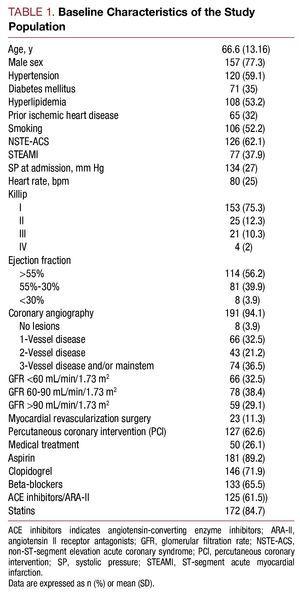
A cisztatin C koncentráció mediánja 1,01 (tartomány, 0,83-1,35) mg/l volt, a plazma kreatinin az első elvégzett elemzéskor 1 (0.9-1,3) mg/L, a glomeruláris szűrési ráta 72,4 (49,12-93,73) ml/min/1,73 m2 volt, a nagy érzékenységű C-reaktív fehérje pedig 1,37 (0,46-5,02) mg/L volt. A glomeruláris filtráció a kórházi felvétel idején a betegek 32,5%-ánál 2 volt, a szérum cisztatin C értéke pedig 113 (55,7%) betegnél >0,95 mg/l volt.
A magasabb cisztatin C-értékkel rendelkező betegek rosszabb klinikai profilt mutattak, idősebbek voltak, magas volt a magas vérnyomás előfordulása, rosszabb volt a Killip-osztályuk a kórházi felvétel idején, a koszorúér-angiográfián súlyosabb volt a koszorúér-betegségük, és magasabbak voltak a plazma kreatinin- és C-reaktív protein-értékeik (2. táblázat).
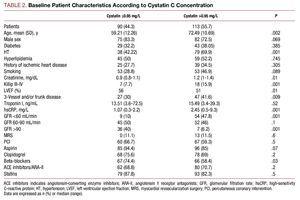
Az elvégzett koszorúér-beavatkozás tekintetében nem volt szignifikáns különbség a két cisztatin C-csoport között; a végső angiográfiás eredmény hasonló sikerességi arányt mutatott, és nem volt jelentős szövődmény (3,27% a ≤0,95 cisztatin C-vel rendelkező betegeknél és 4,09% a másik csoportban). A farmakológiai kezelés elemzése a béta-blokkolók és az aszpirin lényegesen nagyobb arányú alkalmazását mutatta a ≤0,95 cisztatin C-vel rendelkező csoportban (2. táblázat).
A szérum cystatin C-értékek magasabb korrelációt mutattak a becsült glomeruláris filtrációs rátával (r=-0,655; P=,001) (1. ábra), mint a mikroalbuminuriával (r=0,302, P=,01), és alacsonyabb korrelációt a C-reaktív fehérjével (r=0,29; P=,01).
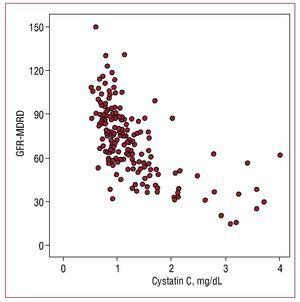
1. ábra. A cystatin C-értékek és az MDRD-formulával (GFR-MDRD) becsült glomeruláris filtrációs ráta közötti korreláció.
A >0,95 cystatin C-értékkel rendelkező betegek csoportjában 6,5%-ban normális glomeruláris filtrációs ráta, 46%-ban pedig 60 és 90 ml/min/1,73 m2 közötti glomeruláris filtrációs ráta volt. Ezen túlmenően a vesefunkciós zavarral küzdő betegek 10%-ánál a cisztatin C-értékek
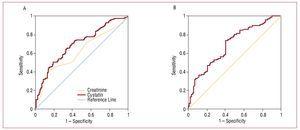
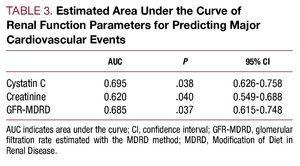
2. ábra. A, A cisztatin C és a kreatinin ROC-értékei a kardiovaszkuláris szövődmények (szívelégtelenség, infarktus és kardiovaszkuláris halálozás) kialakulásával kapcsolatban. B, Az MDRD-vel becsült glomeruláris filtrációs ráta ROC-görbéje a kardiovaszkuláris szövődmények (szívelégtelenség, infarktus és kardiovaszkuláris halálozás) kialakulásával összefüggésben.
A kórházi tartózkodás mediánja 9 (6-19) nap volt. A felvétel időpontjától a vizsgálati követés befejezéséig a teljes mintából 56 (27,58%) betegnél alakult ki szívelégtelenség, a legtöbbjük az emelkedett cisztatin C-értékkel rendelkező csoportban (45 beteg). A kórházi halálozás szignifikánsan magasabb volt az emelkedett cisztatin C-értékekkel rendelkező csoportban (17,6% vs. 3,3%; P=,001), és ezek a különbségek a követés során is fennmaradtak (3. ábra, 4. táblázat).
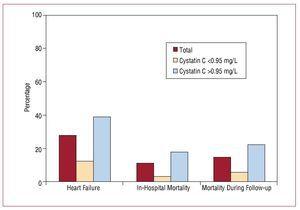
3. ábra. A cystatin C 0,95 mg/L és a kórházi kardiovaszkuláris események kialakulása közötti összefüggés.

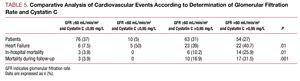
Az egyváltozós elemzésben nem volt összefüggés a kardiovaszkuláris szövődmények és az ACS típusa, a hiperlipidémia vagy a TpI csúcskoncentráció között, de összefüggést találtak a többi kardiovaszkuláris kockázati tényezővel: az érintett erek száma, az ejekciós frakció, a vesefunkciós markerek, a cystatin C és a nagy érzékenységű C-reaktív protein között. Amikor a >60 ml/min/1,73 m2 glomeruláris filtrációs rátával rendelkező betegek eredményeit elemeztük, azt találtuk, hogy a >0 cystatin C-vel rendelkező betegeknél.95 mg/L szignifikánsan nagyobb arányban mutattak kardiovaszkuláris szövődményeket, mint a >60 glomeruláris filtrációjú betegeknél, valamint a cisztatin C 60 és cisztatin C
A becsült eseménymentes túlélés (azaz szívelégtelenség, szívinfarktus vagy halálozás nélkül) az átlagos 186 napos követés után szignifikánsan magasabb volt a ≤0 cisztatinértékkel rendelkező betegek csoportjában.95 mg/l: 75% versus 44% (P=,02) (4. ábra).

4. ábra. Kaplan-Meier-görbék a súlyos kardiovaszkuláris eseményektől mentes túlélés valószínűségének becslésére a cisztatin C-érték szerint.
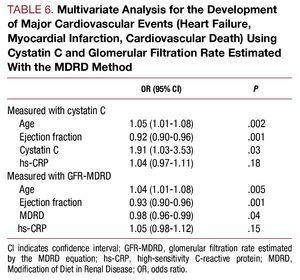
A többváltozós elemzés az életkort, az ejekciós frakciót és a cisztatin C-koncentrációt a kardiovaszkuláris szövődmények független előrejelző tényezőjeként azonosította a kórházi kezelés során (6. táblázat).
MEGJEGYZÉS
A jelen vizsgálat eredményei azt mutatják, hogy az emelkedett cystatin C-értékek a kórházi szívelégtelenség, a szívinfarktus és a kardiovaszkuláris halálozás kialakulását jelzik a magas kockázatú ACS-es betegeknél, más klasszikus kockázati tényezőktől függetlenül. Ezenkívül a plazma cisztatin C-értéke a kardiovaszkuláris szövődmények magas kockázatának kitett betegek kórházi kezelés alatti rétegzésére is alkalmasabb lehet, mint a vesefunkció értékelésének más módszerei. Azt találtuk, hogy az emelkedett cisztatin C érték még a normális glomeruláris filtrációjú betegek csoportjában is rosszabb kardiovaszkuláris prognózissal járt együtt. Tudomásunk szerint ez az első jelentés erről az összefüggésről, amely véleményünk szerint hatással lehet a rizikóstratifikációra ebben a betegpopulációban.
Az elmúlt években több cikk is leírta a vesefunkciózavar és a kardiovaszkuláris szövődmények közötti szoros összefüggést az akut és krónikus ischaemiás szívbetegségben, valamint a kardiovaszkuláris betegségek más klinikai megjelenési formáiban, különösen a szívelégtelenségben szenvedő betegek követése során.1,10-12 A glomeruláris filtráció 60 ml/perc alá csökkenése a halálozás, a szívinfarktus és a stroke kockázatának jelentős növekedésével jár, mind a korábbi kardiovaszkuláris betegségben szenvedő, mind a nem szenvedő betegek esetében.13 Különösen ezt az összefüggést írták le ST-szegment emelkedéssel járó és ST-szegment emelkedéssel nem járó ACS-es betegek esetében.10,13-15 A VALIANT vizsgálatban16 (ST-szegment emelkedéssel járó szívinfarktust követő kamrai diszfunkcióban és szívelégtelenségben szenvedő betegek) a vesefunkció romlása (a glomeruláris szűrési sebességgel értékelve) a követés során a halálozás és a kardiovaszkuláris szövődmények növekedésével járt együtt. Hasonló eredményekről számoltak be a SAVE (posztinfarktus utáni kamrai diszfunkció), a HOPE (magas kardiovaszkuláris kockázatú betegek, többségében krónikus ischaemiás szívbetegségben szenvedő betegek) és a PEACE (krónikus ischaemiás szívbetegségben szenvedő betegek) tanulmányokba bevont betegcsoportok esetében. Ezekben a vizsgálatokban a veseelégtelenség és a prognózis közötti kapcsolatot a csökkent glomeruláris filtrációs sebesség, valamint a vizelet-albumin-kiválasztás tekintetében figyelték meg.16-19
Amint már említettük, közvetlen kétirányú kapcsolatot írtak le a veseelégtelenség és a kardiovaszkuláris betegségek között. A krónikus veseelégtelenség kedvez a hipertónia és a diszlipidémia kialakulásának, és elősegíti a renin-angiotenzinaldoszteron rendszer aktiválódását. Úgy tűnik, hogy ezek a tényezők a gyulladásos mediátorok növekedésével együtt hozzájárulnak a szabad gyökök nagyobb mértékű termeléséhez, amelyek beavatkoznak az ateroszklerotikus folyamatba és a kardiovaszkuláris károsodásba. Ezenkívül az ásványianyag-anyagcsere-változások (a meszesedés promótereinek növekedése és a meszesedés gátlóinak csökkenése) kedveznek a koszorúerekben lévő kalciumlerakódásoknak.20,21 Végül, a veseelégtelenségben szenvedő betegeknél leírták az elismert klinikai és prognosztikai előnyökkel járó terápiás beavatkozások kevésbé intenzív alkalmazását. Konkrétan az ACS-ben szenvedőknél a kevésbé agresszív kezelés és az intervenciós koronária beavatkozások elvégzésének hosszabb késése, valamint a IIb/IIIa, a reninangiotenzin-aldoszteron tengely blokkolóinak, a béta-blokkolók, a sztatinok és a trombocitaellenes szerek kisebb mértékű alkalmazása hozzájárulhat az ebben a betegpopulációban leírt rosszabb prognózishoz.22
A napi klinikai gyakorlatban a vesefunkció értékelése általában szérumkreatinin-meghatározáson és a glomeruláris filtrációs ráta becslésén alapul a Cockcroft-Gault- vagy az MDRD-képlet segítségével. Mindkét módszer számos korlátozást mutat, amelyek közül sok a kreatinintermelést befolyásoló tényezőkből ered, mint például az életkor, a női nem, a faji jellegzetességek, a táplálkozás és a krónikus betegségek lefolyása.
Ezeket az egyenleteket nemrégiben értékelték szívelégtelenségben szenvedő betegeknél, és összehasonlították az NT-proBNP-vel, egy prognosztikai markerrel. Az NT-proBNP által nyújtott prognosztikai információ jobbnak bizonyult, mint az MDRD-formulával becsült vesefunkcióé.23
A cisztatin C olyan molekuláris és metabolikus jellemzőkkel rendelkezik, amelyek e fehérje plazmakoncentrációját jó biológiai markerré teszik a vesefunkció becslésére; a kis funkcionális elváltozások nagyobb érzékenységgel mutathatók ki, mint az erre a célra használt hagyományos paraméterek.24 Ez indokolhatja azt a tényt, hogy azon betegek csoportjában, akiknél a szérum cisztatin C koncentrációja a felső normális határérték felett volt, 15%-ban normális glomeruláris filtrációs rátát mutattak ki; a sztatin C meghatározása hasznos lehet a vesebetegség preklinikai állapotában lévő betegek azonosítására.6
A jelen vizsgálatban kapott eredmények bizonyos mértékig összhangban vannak azokkal a közölt eredményekkel, amelyek szerint a cisztatin C a kardiovaszkuláris szövődmények független előrejelzője a koszorúér-betegségben szenvedő betegeknél.25-27 Sőt, adataink ezt az elképzelést kiterjeszthetik a normális glomeruláris filtrációs rátával rendelkező betegekre is. Jernberg és munkatársai26 elemezték a plazma cisztatin C-értékei és a prognózis közötti kapcsolatot a nem ST-szegment-elevációval járó ACS miatt kórházba került betegek egy csoportjában, és szignifikáns összefüggésről számoltak be a cisztatin C-értékek és a halálozás között. Azt is leírták, hogy az emelkedett cisztatin C-koncentráció a halálozás, a kardiovaszkuláris szövődmények és a szívelégtelenség előfordulásának fokozott kockázatával jár együtt krónikus koszorúér-betegségben szenvedő járóbetegeknél.24 A manifeszt vesebetegséggel nem rendelkező időseknél a cisztatin C a halálozás, a kardiovaszkuláris betegségek és a krónikus vesebetegség kockázati markere.6 Jelen vizsgálatban azt találtuk, hogy az emelkedett cisztatin C-szintű betegek kockázati profilja rosszabb volt; meglepő volt azonban a viszonylag alacsony C-reaktív fehérjeszint. Úgy véljük, ez a fehérje kinetikájával magyarázható, amelynek specifikus, jellemzett spektruma van, amelyben értéke a mintavétel időpontjától függ (a csúcs a tünetek megjelenése után 49 órával következik be, ST-szegment-elevációjú akut myocardialis infarktusban pedig egy késleltetettebb csúcs figyelhető meg); vizsgálatunkban a kórházi kezelést követő első 24 órában vettük a mintákat.28 A vizsgálatunkban szereplő betegeket érintő kardiovaszkuláris szövődmények eltérnek a közelmúltbeli regiszterekben29 publikáltaktól, és ennek oka az lehet, hogy nagyon magas kockázatú és a szövődmények gyakoribb előfordulását mutató betegeket vontak be. A nemrégiben közzétett MASCARA regiszterben a bevont betegeknek csak 50%-a került eredetileg intenzív osztályra vagy kardiológiai intenzív osztályra, míg a mi betegeink mindegyike kardiológiai intenzív osztályról érkezett, ami kétségtelenül némi szelekciós torzítást jelent. Mindazonáltal az emelkedett cisztatin C-vel rendelkező betegcsoport olyan populációt alkotott, amelynek kockázati profilja és a kardiovaszkuláris szövődmények száma szignifikánsan magasabb volt, mint a többi betegé. A jelen tanulmány hozzájárul ezen összefüggések nagyobb pontosságának megállapításához azáltal, hogy először számol be arról, hogy az emelkedett cisztatin C-szintek a magas kockázatú ACS miatt történő kórházi kezelés első óráiban a kórházi kardiovaszkuláris szövődmények független előrejelzője. Ezenkívül a cystatin C és a kardiovaszkuláris szövődmények kockázata közötti összefüggés magasabb, mint a vesefunkció becslésére széles körben használt más paramétereké, és még a normális glomeruláris filtrációjú betegek csoportjában is fennmarad. Jelenleg nem pontosan ismert, hogy a magasabb szövődményi kockázat előrejelzésének képessége abból ered-e, hogy a cisztatin C a vesefunkció jobb markere, mint más elterjedt paraméterek (szérumkreatinin és glomeruláris filtrációs ráta), vagy hogy a glomeruláris filtráción kívül más tényezők is befolyásolják a cisztatin C koncentrációt, amelyek közvetlenül összefügghetnek a kardiovaszkuláris kockázattal. Ezen a vonalon a plazma C-reaktív fehérje értékeinek és a fibrinogénnek az emelkedett cisztatin C-koncentrációval és a kardiovaszkuláris betegség jelenlétével való pozitív korrelációját írták le.30 A PRIME tanulmányban (Prospective Epidemiological Study of Myocardial Infarction) a cisztatin C és az akut szívinfarktus szívhalál és angina pectoris kialakulása közötti összefüggést vizsgálták koszorúér-betegség nélküli betegeknél. A gyakori kardiovaszkuláris kockázati tényezőkre való korrekciót követően a plazma cisztatin C-szintje szignifikánsan összefüggött az első iszkémiás eredetű koszorúér-szövődmény kialakulásával. A szerzők véleménye szerint a csökkent glomeruláris filtrációs ráta nem indokolná az esetek által a kontrollokhoz képest mutatott magasabb cisztatin C-értékeket, és azt javasolták, hogy a gyulladás állhat a cisztatin C és a kardiovaszkuláris betegségek kockázata közötti kapcsolat hátterében.31,32 Ezekkel az adatokkal összhangban eredményeink pozitív korrelációt mutattak a cisztatin C és a nagy érzékenységű C-reaktív fehérje között (r=0,2), amely szintén a kardiovaszkuláris szövődmények független előrejelzője, és további bizonyítékot szolgáltatnak a vesebetegség, a gyulladás és a kardiovaszkuláris betegségek közötti közvetlen kapcsolat meglétének igazolására.
A bemutatott tanulmány főbb korlátai között meg kell említenünk, hogy az eredmények csak a szívgyógyászati intenzív osztályon kórházba került, nagy kockázatú ACS-ben szenvedő betegekre vonatkoznak, akiknek többségét agresszíven, korai koronária-angiográfiával kezelték. Másrészt ezeket a jellemzőket azért kell kiemelni, mert kevés információ áll rendelkezésre erről a speciális populációról, akiknél a cisztatin C-t a kórházi felvételkor mértük. Szinte az összes publikált tanulmányban nincs feltüntetve a meghatározások időpontja, és – legalábbis ACS-ben szenvedő betegek esetében – a plazma cisztatin C-koncentrációját befolyásolhatja az esemény óta eltelt idő, valamint az elvégzett diagnosztikus és terápiás beavatkozások. A rövid követési idő korlátozottsága megakadályozza megfigyeléseink kiterjesztését a közép- vagy hosszútávra. Mindazonáltal eredményeink lehetőséget nyújtanak a nagy kockázatú ACS miatt kórházba került betegeknél a rizikóstratifikáció javítására, ami hasznos lesz a terápia eldöntése, valamint a diagnózis felállítása szempontjából.
KÖVETKEZTETÉSEK
A magas kockázatú ACS-ben szenvedő betegek kórházi felvételekor végzett cisztatin C-meghatározása jó klinikai eszköz lehet a kardiovaszkuláris kockázat rétegzésében. E fehérje meghatározása kiegészítené a vesefunkció értékelésének egyéb módszerei által nyújtott információkat, és a diagnosztikai vonatkozásokon túlmenően hasznos lehet a legnagyobb kockázatú csoport azonosításában. Különös figyelmet kell fordítani a klinikai gyakorlati irányelvekben szereplő ajánlások teljesítésére ebben a populációban. Ezenkívül a cisztatin C fontos információkkal járulhat hozzá a magas kockázatú ACS-ben szenvedő, megőrzött vesefunkciójú betegek rétegzéséhez. A cystatin C ACS-ben betöltött szerepének pontosabb meghatározásához további, hosszabb követéses vizsgálatokra lehet szükség.
ABBREVIÁCIÓK
ACS: akut koronária szindróma
MDRD: Modification of Diet in Renal Disease
TpI: troponin I
