A gyógyszermolekulák agyba juttatása a védelmet jelentő vér-agy gáton való átjutást jelenti. Anthony King utánajár, hogyan szivárognak be a vegyészek az agy erődjébe
Az olyan mindennapi tevékenységek, mint a testmozgás vagy az étkezés, meglehetősen drámaian megváltoztathatják vérünk összetételét. Megnövekedhet például a vér káliumtartalma, és jelentős eltolódások lehetnek a lipid- és aminosavtartalmában. Az idegsejtekre mérgező anyagcseretermékek is bekerülhetnek a véráramba.
A vér-agy gát, szerencsére, megakadályozza, hogy a vérünkben lévő uszadékok vagy zagyvaságok bejussanak az agyunkba. Ez azért kulcsfontosságú, mert az agyban az idegsejtek jelzése elektromos jelekre és finom kémiai jelekre támaszkodik, amelyekhez pontosan szabályozott mikrokörnyezetre van szükség, és ezt könnyen megzavarhatják a vérből bejutó molekulák.
“Nem akarjuk, hogy a kommunikációs központunkat megzavarják olyan dolgok, amelyek a gyomorban, a bélben vagy a test más területein történhetnek. Azt akarjuk, hogy stabilan és tökéletesen működjön, akár alszunk, akár egy tigris üldöz minket” – magyarázza Lester Drewes, az amerikai Duluthban található Minnesota Egyetem munkatársa. A vér-agy gátat, vagy BBB-t az agyi ereket bélelő endotélsejtek alkotják. Ezek az erődsejtek nagyon szorosan összetapadnak, és más szervekkel és szövetekkel ellentétben nincsenek közöttük olyan rések, amelyeken a vérből származó anyagok beszivároghatnának az agyszövetbe.

Forrás: © HAMISH KIDD
A vér-agy-gát több mint 400 mérföldnyi kapilláris és véreret véd az agyban
Ez a védelem igazi fejfájást jelent az agydaganatok és más neurológiai betegségek kezelésében. A BBB által idegen molekulaként kezelt gyógyszerek nem tudnak átjutni. Valójában a gyógyszerek több mint 95 százaléka nem mutat hasznos aktivitást az agyban, és sok közülük rosszul hatol át a BBB-n. A nagy molekulájú gyógyszerek nagy része nem jut át, ami a biotechnológia összes termékét magában foglalja: rekombináns fehérjék, monoklonális antitestek és RNS interferencia gyógyszerek.
William Pardridge, az amerikai Los Angeles-i Kaliforniai Egyetem Vér-agy gát kutatási laboratóriumának igazgatója úgy véli, hogy az Alzheimer-kór és más agyi rendellenességek gyógyszerfejlesztési missziója szenvedett attól, hogy a központi idegrendszeri gyógyszerek felfedezésére összpontosított, miközben a hatóanyag-szállításra szemet hunytak. Szerinte ma a világon egyetlen nagy gyógyszergyártó cégnek sincs BBB-re irányuló gyógyszercélú programja.
Slipperes vásárlók
A gáton való átjutás korai stratégiája az volt, hogy a gyógyszereket lipidoldékonyabbá tették; ez lehetővé tette számukra, hogy áthatoljanak az agy lipidkedvelő endotélsejtjein. A legtöbb visszaélés kábítószere, mint például az alkohol, a kokain és a heroin, lipofil. Ennek azonban van egy hátulütője: “Ha valamit lipofilissé teszünk, az a test minden szervébe és sejtjébe behatol, ezért nagy mennyiségben kell használni. Ha rossz mellékhatása lehet egy másik szervre vagy szövetre, akkor az bekövetkezik” – mondja Drewes.
Néhány kisméretű gyógyszer – például a Parkinson-kór kezelésére használt L-DOPA – természetes “tápanyagszállító rendszereken” keresztül szállítható be, de ez a megközelítés bonyodalmakat okoz a megfelelő adagolási rendszer megtalálásában, mivel a betegek transzporterei eltérő hatékonysággal rendelkeznek. Továbbá, bár a lipidben oldódó gyógyszerek bejuthatnak az agyi endotélsejtek membránjába, az efflux transzporterek ugyanolyan gyorsan kidobhatják őket.
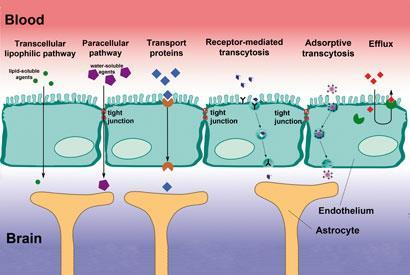
Forrás: © ADAPTED FROM ARMIN K?BELBECK
Sokféle mechanizmus létezik arra, hogy a létfontosságú molekulák átjussanak a gáton, némelyiket gyógyszerekkel lehet hasznosítani
“A biológia valóban a gyógyszerek agyba juttatása ellen van, ezért okos stratégiákra van szükség” – mondja Joan Abbott, az angliai King’s College London idegkutatója. “A múltban a nagy gyógyszergyártó cégek leegyszerűsítették a dolgokat azzal, hogy ragaszkodtak a megfelelő kémiai összetételű kismolekulákhoz, és elkerülték az efflux transzportereket”. Az egyik fontos új felismerés az, hogy a nagyobb lipidoldékonyság nem feltétlenül jobb; a legtöbb gyógyszer esetében a “szabad, nem kötött” koncentráció a fontos az agyban, míg a lipofil gyógyszerek hajlamosak megtapadni az agyon belüli más struktúrákhoz, beleértve a lipidmembránokat is. “A vállalati gyógyszerkémikusok ezt most már figyelembe veszik” – teszi hozzá Abbott.
A vállalatok azonban manapság rájönnek, hogy sokkal intelligensebb gyógyszerekre van szükségük, hogy specifikusabbá tegyék őket, kevesebb mellékhatással. ‘Ezért próbálnak új kémiai eljárásokat, újfajta hordozóeszközöket, sőt olyan technikákat is feltárni, amelyekkel a BBB-t rövid időre meg lehet nyitni, majd a gyógyszer bejutása után újra be lehet zárni’ – mondja Abbott.
Az ideiglenes portálok
Az agyból kiinduló daganatok a legagresszívabb és leghalálosabb rákos megbetegedések közé tartoznak, a kezelési lehetőségeket azonban korlátozza a BBB. Tavaly nyáron tajvani kutatók arról számoltak be, hogy fókuszált ultrahanggal sikeresen megbontották a gátat (lásd Chemistry World, 2010. szeptember, 24. oldal). Kuo-Chen Wei, a Chang Gung Egyetem munkatársa vezetésével a csoport kemoterápiás szerrel bevont mágneses nanorészecskéket fecskendezett patkányokba. Ultrahanggal nyitották meg a BBB egy kis területét, és mágneses mezővel irányították a részecskéket az agy pontos helyére.1
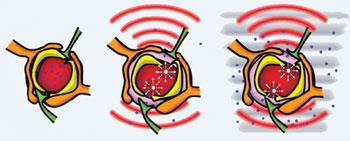
Source:
Az ultrahang képes megbontani a gátat, lehetővé téve a mágneses részecskék átvezetését
Az ultrahang olyan betegségekben is segíthet, mint az Alzheimer- és Parkinson-kór, mondja Kullervo Hynynen a kanadai Torontói Egyetem orvosi karáról, aki hasonló munkát végzett ultrahanggal és mikrobuborékokkal. Az ultrahang pontos fizikai és biológiai mechanizmusa nem ismert – mutat rá. ‘Tudjuk, hogy a buborékok az ultrahanghullámmal együtt tágulnak és húzódnak össze, és néhány gyors mikroszkópos kísérlet kimutatta, hogy a kis erek – legalábbis in vitro – a buborékkal együtt tágulnak és húzódnak össze. Az endotélsejtek tehát megnyúlnak”.
Az elektronmikroszkópia alátámasztotta a gátsejtek fizikai megnyúlásának ezt az elképzelését, bár némi aktív vákuumszállítás is indukálódik az endotélsejteken keresztül, jegyzi meg Hynynen. Bármely BBB-megszakítási módszer potenciális kockázata az, hogy hagyja lankadni az éberségét. A molekulák a felszakítás során bejutnak az agyba, de ez a kockázat kicsi, mivel az agynak csak egy meghatározott területe van kitéve. Az ultrahanggal kapcsolatos nehézségek azzal kapcsolatosak, hogy nem ismerjük a hatásmechanizmusát, valamint a biztonságossággal, a hatékonysággal és az időtartammal (például azzal, hogy mennyi ideig van nyitva a gát) kapcsolatos tényezőkkel.
Source: © BEN BRAHIM MOHAMMED
Az endotélsejtek szorosan körbetekerik az ereket, hogy kizárják
Egy másik zavaró megközelítés az, hogy hiperozmotikus oldatot (olyat, amelynek magasabb az oldott anyag koncentrációja, mint a környező sejteké) fecskendeznek a nyaki verőerekbe, hogy egy időre megnyissák a BBB-t. Így a BBB megnyílik. Ezt a módszert már néhány éve Edward Neuwelt, a portlandi Oregon Egészségügyi és Tudományos Egyetem (USA) munkatársa képviseli. Az ereken átáramló folyadék hiperozmotikus, és így vizet von ki az endotélsejtekből, aminek következtében azok összezsugorodnak – magyarázza Drewes. ‘Ez széthúzza a szoros kötéseket, hézagokat és tereket képezve. Ha a véráramba daganatellenes gyógyszert juttatunk, az be tud diffundálni az agyba és a daganatba”. A sejtek fokozatosan visszaduzzadnak a szokásos méretükre, így a hatás átmeneti.
Míg az agyban kialakuló daganatok viszonylag ritkák; tízszer annyi embernél alakul ki agydaganat olyan rákból, amely a test máshol kezdődik. A BBB meggátolja a modern rákterápiákat, amelyek a test más részein hatnak. Amerikai kutatók azonban nemrégiben a merevedési zavarok kezelésére szolgáló gyógyszerek segítségével fellendítették a területet. Julia Ljubimova, a Los Angeles-i Cedars-Sinai Orvosi Központ munkatársa és kollégái megállapították, hogy a Viagra (szildenafil) és a
Levitra (vardenafil), amelyek egy foszfodiészteráz 5 (PDE5) nevű enzimet gátolnak, megnövelték a vér-agy gát átjárhatóságát. Egy egérmodell segítségével kimutatták, hogy ezek a gyógyszerek képesek növelni a Herceptin, egy tüdő- és emlőrák kezelésére használt nagy monoklonális antitest mennyiségét, amely átjut a BBB-n, és növeli annak daganatellenes hatását az agyban.2
Piggy-backing a BBB-n
Beverly Davidson, az amerikai Iowai Egyetem neurológusa olyan gyermekek számára keresett terápiát, akik lizoszomális tárolási betegségben szenvednek, amelyet egy bizonyos agyi enzim hiánya okoz . Tudjuk, hogy nem tudjuk egyszerűen a vérbe juttatni az enzimet, hogy az hozzáférjen az agyhoz, ezért olyan módszereket próbálunk kidolgozni, amelyekkel leküzdhetjük ezt a problémát – magyarázza. Csoportja a gát endotélsejtjeit úgy alakította át, hogy a hiányzó enzimet előállítsák, és magába az agyba szekretálják.3 “Lényegében a BBB-t a barátunkká tesszük, nem pedig az ellenségünkké”.
Az enzimet előállító rekombináns DNS-t egy olyan vírusvektor segítségével juttatták az endotélsejtekbe, amelyet a kutatók úgy módosítottak, hogy a beteg agyi endotéliumokba kerüljön. Davidson reméli, hogy az új genetikai anyag hosszú évekig az endotéliumokban marad. Nincs bizonyítékunk arra, hogy ezek a sejtek egyáltalán osztódnának, legalábbis a rágcsálókban – magyarázza, így egyetlen génterápiás kör akár évtizedekig is eltarthat. A kezelés egy egérmodell egész agyában helyreállította az enzimaktivitást; a következő lépés a betegség nagy állatmodelljére való áttérés.
A kanadai AngioChem vállalat egy másik módszert fejlesztett ki arra, hogy a terápiákat átcsempéssze a gáton – saját transzportreceptorainak hasznosításával. Ezek a receptorok, mint például a lipoproteinreceptorral kapcsolatos fehérje (LRP-1), normális esetben olyan létfontosságú anyagokat engednek be az agyba, mint a glükóz, az inzulin és a növekedési hormonok. Úgy tűnik, ez az első siker a daganatot megtámadó anyagok bejuttatásában” – mondja Drewes. “Van némi izgalom ezzel kapcsolatban, és megpróbálják ezt egy általánosabb gyógyszerhordozó rendszerré fejleszteni”.
Közvetítő járművek és trójai falovak
Az igazi növekedés másik területe a mesterséges konstrukciók, vagyis a mesterséges hordozóeszközök, mondja Abbott: “A következő 10 évben sok ilyenre számítok”. A nanorészecskéket és a különböző polimereket úgy lehet megtervezni, hogy megfelelő tulajdonságokkal rendelkezzenek a gyógyszerek megkötéséhez, de felismerjék az agyi endotélsejtek receptorait is, így átjutnak a gáton. A polimerek egyik előnye, hogy kémiailag beállíthatók – jegyzi meg Martin Garnett, a Nottinghami Egyetem Gyermek Agytumor Kutatóközpontjának munkatársa, aki megkezdte a polimer nanorészecskékkel kapcsolatos munkáját.
Ljubimova úgy véli, hogy a nanomedicina nagy előrelépést hozhat a rákkezelésben, és a kezelések toxicitásának csökkentésével javíthatja a betegek életminőségét. ‘Rengeteg dolog van a klinikai vizsgálatokban, amelyek “öt-tíz éven belül” nagy előrelépéseket jósolnak’ – mondja. Abbott azonban óvatosságra int az ilyen gyógyszerhordozókkal kapcsolatban. ‘A nehézség ugyanaz, mint a BBB transzporterek esetében. Elég nehéz kiszámítani, hogy egy gyógyszerből mennyi jut be az agyba a hordozóeszközökön keresztül. A legtöbb bizonyíték arra utal, hogy a megfelelő célpontot elérő mennyiség meglehetősen kicsi, ezért a valóban aktív hatóanyagokat kell választani.

Forrás: © HAMISH KIDD
A molekuláris trójai faló átcsempészheti a GDNF-hez hasonló gyógyszereket a gáton
A trójai faló módszerét, amely a terápiás szereket olyan molekulákhoz köti, amelyek normális esetben áthaladnak a gáton, Pardridge pártolja. Molekuláris trójai falóként újraalkotta a gliából származó neurotrofikus faktort (GDNF). A GDNF egy erős neurotrofin, amely a Parkinson-kór állatmodelljeiben képes feléleszteni a sérült idegeket; ez egy potenciális terápia a stroke és a kábítószer-függőség kezelésére is, de nem lépi át a BBB-t.
A beültetett gyógyszer-tartályok és kamrai katéterek – mindkettő invazív eljárás – használatával a kutatók felfedezték, hogy az általuk bejuttatott GDNF biológiailag aktív, de klinikai hatékonysága nem volt. A problémát az elosztás jelentette; a katéterek nagyon pontos elhelyezésére volt szükség, és ezt nem minden klinikai vizsgálatban sikerült elérni. Pardridge Trojanja egy monoklonális antitest a humán inzulinreceptor ellen, amely képes a GDNF-et a BBB-n keresztül juttatni.4 A Rhesus majmokkal végzett kísérletek során nem tapasztalt mellékhatásokat az antitest-GDNF fúziós fehérje nagy adagjainak beadásával kapcsolatban.
Kitörés a laboratóriumból
Abbott szerint a BBB gyógyszerbejuttatás terén elért fejlődés egyik oka a finanszírozás és az ipari érdeklődés hiánya. Elmagyarázza, hogy a nagy gyógyszergyártók nagyrészt kivonultak az agykémia és a gyógyszeradagolás aspektusaiból, mert sok pénzt fektettek olyan programokba, amelyekről kiderült, hogy nem voltak eredményesek. Most óvatosabbak, pesszimistábbak, vagy olyan területekre összpontosítanak, amelyeknek nagyobb esélyük van a sikerre. Egyes vállalatok talán még azt is érzik, hogy nem illetékesek olyan agyi célpontok követésében, ahol a BBB kihívást jelent. Összetett kémiája megnehezíti a kiszámíthatóságot.
Forrás: © JULIA LJUBINOV
Az agyi daganatok különösen nagy problémát jelentenek, mivel a legtöbb szokásos rákgyógyszer nem képes átjutni a gáton
Vannak azonban pozitív jelek. A gát in vitro sejtkultúrás modelljeit – amelyek a gyógyszerek áteresztőképességi vizsgálataihoz szükségesek – az elmúlt néhány évben továbbfejlesztették. Az olyan képalkotó eljárások, mint a pozitronemissziós tomográfia (PET) és a mágneses rezonancia képalkotás (MRI) segítenek megmutatni, hogy mit csinál a BBB, és mely gyógyszerek jutnak megfelelő koncentrációban a megfelelő célpontokhoz.
Ez kritikus fontosságú, mivel a kutatók rájöttek, hogy a gát nem egy statikus védelmi struktúra. Ez egy aktív, szabályozott és szabályozó felület; megváltozik például egy stroke utáni sérülés helyén és környékén. Neuwelt szerint az agydaganatok, az epilepszia, az Alzheimer-kór és a Parkinson-kór mind “a normál BBB perturbációival jár együtt, amelyek hozzájárulnak a patológiájukhoz. “5
A megfelelő terápiák kidolgozásához és finomításához szükség lehet a gát állapotára vonatkozó információkra egy adott beteg esetében. Egyre inkább felismerik például a poszttraumás stressz okozta sérüléseknél, hogy a kezelés beállításához tudni kell, mit csinál a gát – mondja Abbott. Előfordulhat, hogy a kezelést hónapok vagy hetek alatt kell kiigazítani.
Garnett szerint a gyógyszeripari vállalatok eddig inkább a kis gyógyszermolekulákra koncentráltak, mint a gyógyszerhordozó rendszerekre, de úgy véli, hogy ez most megváltozik. Ráadásul az egyetemeken és kutatóintézetekben aktív kutatóközösség működik, amely az ultrahangot, a trójai fúziós fehérjéket, a polimer konstrukciókat és más olyan eszközöket vizsgál, amelyekkel leküzdhető a gát és a terápia eljuttatható oda, ahol szükség van rá.
Abbott bizakodó értékeléssel zárja a BBB-ről és a terápiák átjuttatására irányuló erőfeszítésekről: “Az elmúlt öt évben rengeteg előrelépés történt. Mindenféle dolgot látunk, ami ma már lehetséges – tehát az alapvető megértés szempontjából úgy gondolom, hogy a dolgok nagyon jól állnak. De valószínűleg igaz az a megállapítás, hogy az innováció nagy része kis cégektől származik; ezek közül néhányan nagyobb cégekkel társulnak, vagy nagyobb cégek vették át őket. A hagyományos nagy gyógyszergyártók még mindig meglehetősen óvatosak az új módszerek kipróbálásában, amelyekkel az agyba juttathatók a dolgok, bár ez kezd megváltozni.
Anthony King szabadúszó tudományos szakíró, székhelye Dublin, Írország
.
