Tanulmányi célok
- Az izomösszehúzódásban résztvevő komponensek leírása
- Magyarázza, hogyan működnek az izmok összehúzódnak és ellazulnak
- Írd le az izomösszehúzódás csúszószálas modelljét
Az egyes izomrostok összehúzódását eredményező események sorozata egy jellel – a neurotranszmitterrel – kezdődik, ACh-val, amely az adott rostot innerváló motoros neurontól származik. A rost helyi membránja depolarizálódik, ahogy a pozitív töltésű nátriumionok (Na+) belépnek, ami akciós potenciált vált ki, amely elterjed a membrán többi részére is depolarizálódik, beleértve a T-tubulusokat is. Ez kiváltja a kalciumionok (Ca++) felszabadulását a szarkoplazmatikus retikulum (SR) raktárából. A Ca++ ezután elindítja az összehúzódást, amelyet az ATP tart fenn (1. ábra). Amíg a Ca++ ionok a szarkoplazmában maradnak, hogy a troponinhoz kötődjenek, ami “árnyékolatlanul” tartja az aktinkötő helyeket, és amíg ATP áll rendelkezésre a kereszthíd-ciklusok működtetéséhez és az aktinszálak miozin általi húzásához, az izomrost tovább rövidül az anatómiai határig.

1. ábra. Egy izomrost összehúzódása. Kereszthíd képződik az aktin és a miozinfejek között, ami kiváltja az összehúzódást. Amíg a Ca++ ionok a szarkoplazmában maradnak, hogy a troponinhoz kötődjenek, és amíg ATP áll rendelkezésre, az izomrost tovább rövidül.
Az izomösszehúzódás általában akkor áll le, amikor a motoros neuronból érkező jeladás véget ér, ami repolarizálja a szarkolemmát és a T-tubulusokat, és bezárja a feszültségkapcsolt kalciumcsatornákat az SR-ben. A Ca++ ionok ezután visszapumpálódnak az SR-be, aminek hatására a tropomiozin újra megvédi (vagy újra befedi) a kötőhelyeket az aktinszálakon. Az izom akkor is abbahagyhatja az összehúzódást, ha elfogy az ATP és elfárad (2. ábra).

2. ábra. Egy izomrost relaxációja. A Ca++ ionok visszapumpálódnak az SR-be, aminek hatására a tropomiozin újra megvédi a kötőhelyeket az aktinszálakon. Az izom akkor is abbahagyhatja az összehúzódást, ha elfogy az ATP és elfárad.
Az izomrostok rövidülésének molekuláris eseményei a rost szarkomerjeiben játszódnak le (lásd a 3. ábrát). A harántcsíkolt izomrost összehúzódása úgy történik, hogy a myofibrillumokban lineárisan elhelyezkedő szarkomerek megrövidülnek, ahogy a miozinfejek az aktin filamentumokra húzódnak.
A vastag és vékony filamentumok átfedési területe sűrűnek tűnik, mivel a filamentumok között kevés hely van. Ez a zóna, ahol a vékony és vastag filamentumok átfedik egymást, nagyon fontos az izomösszehúzódás szempontjából, mivel itt kezdődik a filamentumok mozgása. A vékony filamentumok, amelyeket a végükön a Z-korongok rögzítenek, nem nyúlnak be teljesen a központi régióba, amely csak a vastag filamentumokat tartalmazza, amelyek a bázisukon az M-vonalnak nevezett ponton rögzülnek. Egy myofibrillum sok, hosszában futó szarkomerből áll; így a myofibrillumok és az izomsejtek a szarkomerek összehúzódásával összehúzódnak.
A kontrakció csúszószálas modellje
A motoros neuron jelzésére a vázizomrost összehúzódik, mivel a vékony filamentumok húzódnak, majd elcsúsznak a vastag filamentumok mellett a rost szarkomereiben. Ezt a folyamatot az izomösszehúzódás csúszószálas modelljének nevezik (3. ábra). A csúszás csak akkor következhet be, ha az aktin filamentumokon lévő miozinkötő helyek az aktin filamentumokon egy olyan lépéssorozat révén szabaddá válnak, amely a Ca++ bejutásával kezdődik a szarkoplazmába.

3. ábra. Az izomösszehúzódás csúszószálas modellje. Amikor egy szarkomer összehúzódik, a Z-vonalak közelebb kerülnek egymáshoz, és az I sáv kisebb lesz. Az A sáv ugyanolyan széles marad. Teljes összehúzódáskor a vékony és vastag filamentumok átfedik egymást.
A tropomiozin egy olyan fehérje, amely az aktin filamentum láncai köré tekeredik, és elfedi a miozinkötő helyeket, hogy megakadályozza az aktin kötődését a miozinhoz. A tropomiozin a troponinhoz kötődve troponin-tropomiozin komplexet alkot. A troponin-tropomioozin komplex megakadályozza, hogy a miozin “fejek” az aktin mikrofilamentumokon lévő aktív helyekre kötődjenek. A troponinnak van egy kötőhelye a Ca++ ionok számára is.
Az izomösszehúzódás megindításához a tropomiozinnak ki kell tennie a miozin kötőhelyet egy aktin filamentumon, hogy lehetővé tegye a kereszthíd kialakulását az aktin és a miozin mikrofilamentumok között. Az összehúzódás folyamatának első lépése, hogy a Ca++ a troponinhoz kötődik, így a tropomiozin el tud csúszni az aktinszálakon lévő kötőhelyektől. Ez lehetővé teszi a miozinfejek számára, hogy ezekhez a szabadon lévő kötőhelyekhez kapcsolódjanak, és kereszthidakat képezzenek. A vékony filamentumokat ezután a miozinfejek húzzák, hogy a vastag filamentumok mellett a szarkomer közepe felé csússzanak. De minden fej csak egy nagyon rövid távolságot tud húzni, mielőtt elérné a határait, és “újrakockázni” kell, mielőtt újra húzni tudna, amihez ATP-re van szükség.
ATP és az izomösszehúzódás
Az izomösszehúzódás során a vékony filamentumok további csúszásához a vastag filamentumok mellett a miozinfejeknek húzniuk kell az aktint a kötőhelyeken, leválniuk, újrakockázniuk, újabb kötőhelyekhez kapcsolódniuk, húzniuk, leválniuk, újrakockázniuk stb. kell. Ezt az ismétlődő mozgást kereszthíd-ciklusnak nevezzük. A miozinfejeknek ez a mozgása hasonló az evezőkhöz, amikor az egyén evez egy csónakban: Az evezők lapátja (a miozinfejek) húznak, kiemelkednek a vízből (leválnak), újrapozícionálódnak (újrakockázódnak), majd újra bemerülnek, hogy ismét húzzanak (4. ábra). Minden ciklushoz energiára van szükség, és a szarkomerekben lévő, a vékony filamentumokat ismétlődően húzó miozinfejek működése szintén energiát igényel, amelyet az ATP biztosít.
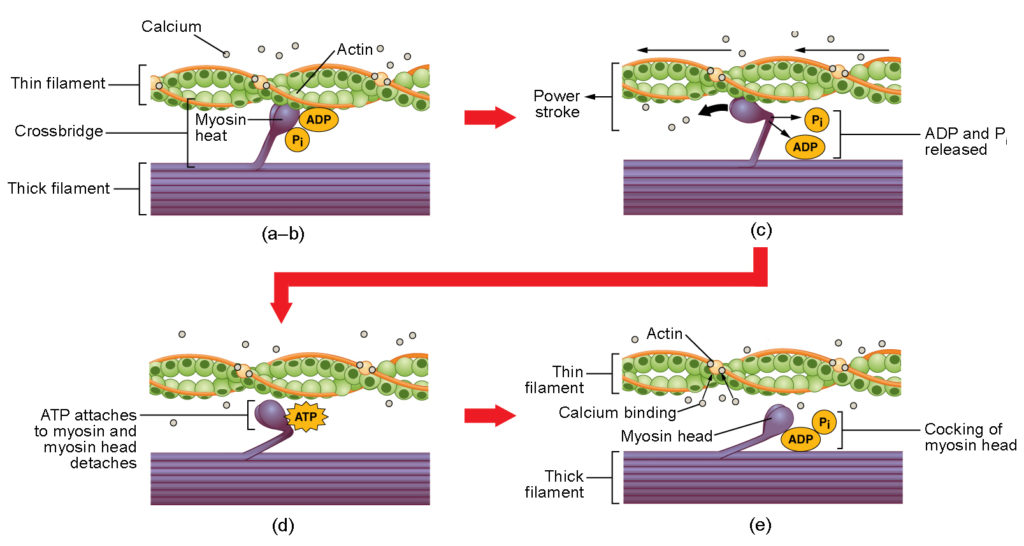
4. ábra. A vázizomzat összehúzódása. (a) Az aktin aktív helye feltárul, amint a kalcium a troponinhoz kötődik. (b) A miozinfej vonzódik az aktinhoz, és a miozin az aktin-kötőhelyén megköti az aktint, kialakítva a kereszthidat. (c) Az erőütés során az előző összehúzódási ciklusban keletkezett foszfát felszabadul. Ennek eredményeképpen a miozinfej a szarkomer közepe felé fordul, majd a megkötött ADP és a foszfátcsoport felszabadul. (d) Egy új ATP-molekula kötődik a miozinfejhez, ami a kereszthíd leválását okozza. (e) A miozinfej az ATP-t ADP-vé és foszfáttá hidrolizálja, ami a miozint visszavezeti a kakas helyzetbe.
A kereszthíd kialakulása akkor következik be, amikor a miozinfej az aktinhoz kapcsolódik, miközben az adenozin-difoszfát (ADP) és a szervetlen foszfát (Pi) még mindig a miozinhoz kötődik (4a,b ábra). Ezután a Pi felszabadul, aminek hatására a miozin erősebb kötődést alakít ki az aktinhoz, majd a miozinfej az M-vonal felé mozog, magával húzva az aktint. Ahogy az aktin húzódik, a filamentumok körülbelül 10 nm-t mozognak az M-vonal felé. Ezt a mozgást nevezzük erőmozgásnak, mivel a vékony filamentum mozgása ennél a lépésnél következik be (4c. ábra). ATP hiányában a miozinfej nem válik le az aktinról.
A miozinfej egyik része az aktinon lévő kötőhelyhez kapcsolódik, de a fejnek van egy másik kötőhelye is az ATP számára. Az ATP-kötés hatására a miozinfej leválik az aktinról (4d. ábra). Miután ez megtörtént, az ATP-t a miozin belső ATPáz aktivitása ADP-vé és Pi-vé alakítja. Az ATP-hidrolízis során felszabaduló energia a miozinfej szögét ferde állásba változtatja (4e. ábra). A miozin fej most a további mozgáshoz szükséges pozícióban van.
Amikor a miozin fej ferdén áll, a miozin magas energiájú konfigurációban van. Ez az energia elhasználódik, ahogy a miozin fej végigmegy az erőütésen, és az erőütés végén a miozin fej alacsony energiájú helyzetben van. Az erőütés után az ADP felszabadul; a kialakult kereszthíd azonban még mindig a helyén van, és az aktin és a miozin összekapcsolódik. Amíg az ATP rendelkezésre áll, könnyen kötődik a miozinhoz, a kereszthíd-ciklus ismétlődhet, és az izomösszehúzódás folytatódhat.
Megjegyezzük, hogy minden egyes vastag, nagyjából 300 miozinmolekulából álló filamentumnak több miozinfeje van, és az izomösszehúzódás során folyamatosan sok kereszthíd alakul ki és szakad el. Ha ezt megszorozzuk az egy izomrostban lévő összes szarkomerrel, az egy izomrostban lévő összes izomrosttal és az egy vázizomban lévő összes izomrosttal, akkor megérthetjük, miért van szükség annyi energiára (ATP) a vázizmok működésének fenntartásához. Valójában az ATP elvesztése az, ami a halál beállta után nem sokkal megfigyelhető hullamerevséget eredményezi. Mivel nincs lehetőség további ATP-termelésre, nem áll rendelkezésre ATP ahhoz, hogy a miozinfejek leváljanak az aktinkötő helyekről, így a kereszthidak a helyükön maradnak, ami a vázizomzat merevségét okozza.
Az ATP forrásai
Az ATP szolgáltatja az energiát az izomösszehúzódáshoz. A kereszthíd-ciklusban betöltött közvetlen szerepe mellett az ATP biztosítja az energiát az SR-ben lévő aktív transzportáló Ca++ pumpák számára is. Az izomösszehúzódás nem megy végbe megfelelő mennyiségű ATP nélkül. Az izomban tárolt ATP mennyisége nagyon alacsony, csak néhány másodpercnyi összehúzódáshoz elegendő. Mivel lebomlik, az ATP-t ezért gyorsan regenerálni és pótolni kell, hogy az összehúzódás tartósan fennmaradhasson. Az ATP regenerálására három mechanizmus létezik: a kreatinfoszfát-anyagcsere, az anaerob glikolízis, az erjedés és az aerob légzés.
A kreatinfoszfát olyan molekula, amely foszfátkötéseiben képes energiát tárolni. A nyugalmi állapotban lévő izomban a felesleges ATP átadja energiáját a kreatinnak, ADP és kreatinfoszfát keletkezik. Ez egy olyan energiatartalékként működik, amelyből gyorsan több ATP-t lehet előállítani. Amikor az izom összehúzódik és energiára van szüksége, a kreatinfoszfát visszaadja foszfátját az ADP-nek, így ATP és kreatin keletkezik. Ezt a reakciót a kreatin-kináz enzim katalizálja, és nagyon gyorsan megy végbe; így a kreatin-foszfátból származó ATP az izomösszehúzódás első néhány másodpercét táplálja. A kreatinfoszfát azonban csak körülbelül 15 másodpercnyi energiát képes biztosítani, ekkor más energiaforrást kell felhasználni (5. ábra).

5. ábra. Az izom anyagcseréje. A nyugalmi állapotban lévő izomban tárolódik némi ATP. Ahogy az összehúzódás megkezdődik, ez másodpercek alatt elhasználódik. A kreatinfoszfátból körülbelül 15 másodpercig több ATP keletkezik.
Amint a kreatinfoszfát által termelt ATP kimerül, az izmok ATP-forrásként a glikolízishez fordulnak. A glikolízis egy anaerob (nem oxigénfüggő) folyamat, amely a glükózt (cukrot) bontja le ATP előállítása céljából; a glikolízis azonban nem képes olyan gyorsan ATP-t termelni, mint a kreatinfoszfát. Így a glikolízisre való átállás azt eredményezi, hogy az ATP lassabban áll az izom rendelkezésére. A glikolízisben felhasznált cukrot a vércukor vagy az izomban tárolt glikogén metabolizálásával lehet biztosítani. Egy glükózmolekula lebontásakor két ATP és két molekula piroszőlősav keletkezik, amely felhasználható az aerob légzésben, vagy alacsony oxigénszint esetén tejsavvá alakul (6. ábra).

6. ábra. Glikolízis és aerob légzés. Minden glükózmolekulából két ATP és két molekula piroszőlősav keletkezik, amely felhasználható az aerob légzésben vagy tejsavvá alakítható. Ha nem áll rendelkezésre oxigén, a piruvinsav tejsavvá alakul át, ami hozzájárulhat az izomfáradáshoz. Ez megerőltető testmozgás során fordul elő, amikor nagy mennyiségű energiára van szükség, de az oxigén nem jut elegendő mennyiségben az izomhoz.
Ha oxigén áll rendelkezésre, a piruvinsav felhasználásra kerül az aerob légzésben. Ha azonban nem áll rendelkezésre oxigén, a piruvinsav tejsavvá alakul át, ami hozzájárulhat az izomfáradáshoz. Ez az átalakulás lehetővé teszi a NAD+ enzim NADH-ból történő újrahasznosítását, ami a glikolízis folytatásához szükséges. Ez megerőltető testmozgás során fordul elő, amikor nagy mennyiségű energiára van szükség, de az oxigén nem jut elegendő mennyiségben az izomhoz. Maga a glikolízis nem tartható fenn nagyon hosszú ideig (kb. 1 perc izomaktivitás), de hasznos a rövid, nagy intenzitású kitörések elősegítésében. Ennek oka, hogy a glikolízis nem hasznosítja túl hatékonyan a glükózt, és glükózmolekulánként nettó két ATP-t termel, a végtermék pedig tejsav, amely felhalmozódva hozzájárulhat az izomfáradáshoz.
Aerob légzés a glükóz vagy más tápanyagok lebontása oxigén (O2) jelenlétében szén-dioxid, víz és ATP előállítására. A nyugalmi vagy mérsékelten aktív izmok számára szükséges ATP körülbelül 95 százalékát az aerob légzés biztosítja, amely a mitokondriumokban zajlik. Az aerob légzés bemeneti anyagai közé tartozik a véráramban keringő glükóz, a piroszőlősav és a zsírsavak. Az aerob légzés sokkal hatékonyabb, mint az anaerob glikolízis, mivel glükózmolekulánként körülbelül 36 ATP-t termel, szemben a glikolízisből származó néggyel. Az aerob légzés azonban nem tartható fenn a vázizomzat folyamatos O2-ellátása nélkül, és sokkal lassabb (7. ábra). Ennek ellensúlyozására az izmok kis mennyiségű felesleges oxigént tárolnak a myoglobin nevű fehérjékben, ami hatékonyabb izomösszehúzódást és kisebb fáradtságot tesz lehetővé. Az aerob edzés a keringési rendszer hatékonyságát is növeli, így az izmokat hosszabb ideig lehet O2-vel ellátni.

7. ábra. Sejtlégzés. Az aerob légzés a glükóz lebontása oxigén (O2) jelenlétében szén-dioxid, víz és ATP előállítása céljából. A nyugalmi vagy mérsékelten aktív izmok számára szükséges ATP körülbelül 95 százalékát az aerob légzés biztosítja, amely a mitokondriumokban zajlik.
Az izomfáradás akkor következik be, amikor az izom nem képes tovább összehúzódni az idegrendszer jelzéseire válaszul. Az izomfáradás pontos okai nem teljesen ismertek, bár bizonyos tényezőket összefüggésbe hoztak a fáradás során bekövetkező csökkent izomösszehúzódással. A normális izomösszehúzódáshoz ATP-re van szükség, és az ATP-tartalékok csökkenésével az izomműködés csökkenhet. Ez inkább a rövid, intenzív izomterhelésnél, mint a tartós, alacsonyabb intenzitású erőfeszítéseknél játszhat szerepet. A tejsav felhalmozódása csökkentheti az intracelluláris pH-t, ami hatással van az enzimek és fehérjék aktivitására. A Na+ és K+ szintek kiegyensúlyozatlansága a membrán depolarizáció következtében megzavarhatja a Ca++ áramlását az SR-ből. A hosszú ideig tartó tartós edzés károsíthatja az SR-t és a szarkolemmát, ami a Ca++ szabályozás károsodását eredményezi.
Az intenzív izomtevékenység oxigénadósságot eredményez, ami az izomösszehúzódás során oxigén nélkül termelt ATP kompenzálásához szükséges oxigénmennyiség. Oxigénre van szükség az ATP és a kreatin-foszfát szintjének helyreállításához, a tejsav piroszőlősavvá alakításához, valamint a májban a tejsav glükózzá vagy glikogénné történő átalakításához. Az edzés során használt egyéb rendszereknek is szükségük van oxigénre, és mindezek a folyamatok együttesen eredményezik az edzés után fellépő megnövekedett légzésszámot. Amíg az oxigénadósság nem teljesül, az oxigénfelvétel megemelkedik, még az edzés abbahagyása után is.
A vázizomzat ellazulása
A vázizomrostok és végső soron a vázizomzat ellazulása a motoros neuronnal kezdődik, amely leállítja kémiai jelének, az ACh-nak a kibocsátását a szinapszisba az NMJ-nél. Az izomrost repolarizálódik, ami bezárja a kapukat az SR-ben, ahol Ca++ szabadult fel. Az ATP által hajtott szivattyúk a Ca++-t a szarkoplazmából visszaviszik az SR-be. Ez a vékony filamentumokon lévő aktinkötő helyek “visszapajzsolását” eredményezi. A vékony és vastag filamentumok közötti kereszthidak kialakításának képessége nélkül az izomrost elveszíti a feszültségét és ellazul.
Az izomerő
A vázizomrostok száma egy adott izomban genetikailag meghatározott és nem változik. Az izomerő közvetlenül összefügg az egyes rostokban lévő myofibrillumok és szarkomerek mennyiségével. Az izomra ható tényezők, például a hormonok és a stressz (és a mesterséges anabolikus szteroidok) növelhetik a szarkomerek és a miofibrillumok termelését az izomrostokon belül, ezt a változást nevezzük hipertrófiának, ami a vázizom megnövekedett tömegét és tömege eredményezi. Hasonlóképpen, egy vázizom csökkent használata atrófiát eredményez, ahol a szarkomerek és a miofibrillumok száma eltűnik (de az izomrostok száma nem). Gyakori, hogy egy gipszben lévő végtagon a gipsz levételekor elsorvadt izmok jelennek meg, és bizonyos betegségek, mint például a gyermekbénulás, elsorvadt izmokat mutatnak.
Az izomrendszer betegségei
A Duchenne-izomdisztrófia (DMD) a vázizmok progresszív gyengülése. Ez egyike a több betegségnek, amelyeket együttesen “izomdisztrófia” néven emlegetnek. A DMD-t a dystrophin nevű fehérje hiánya okozza, amely segíti a myofibrillumok vékony filamentumainak a szarkolemmához való kötődését. Elegendő dystrophin nélkül az izomösszehúzódások következtében a szarkolemma elszakad, ami Ca++ beáramlását okozza, ami sejtkárosodáshoz és az izomrostok lebomlásához vezet. Idővel, ahogy az izomkárosodás felhalmozódik, az izomtömeg csökken, és nagyobb funkcionális károsodások alakulnak ki.
A DMD egy örökletes rendellenesség, amelyet egy rendellenes X-kromoszóma okoz. Elsősorban férfiakat érint, és általában kora gyermekkorban diagnosztizálják. A DMD általában először egyensúly- és mozgásszervi nehézségként jelentkezik, majd járásképtelenségig fejlődik. A betegség a testben felfelé haladva az alsó végtagoktól a felsőtest felé halad, ahol a légzésért és a keringésért felelős izmokat érinti. Végül légzési elégtelenség miatt halált okoz, és az érintettek általában nem érik meg a 20-as éveiket.
Mivel a DMD-t a dystrophint kódoló gén mutációja okozza, úgy gondolták, hogy egészséges myoblastok bejuttatása a betegekbe hatékony kezelést jelenthet. A mioblasztok az izomfejlődésért felelős embrionális sejtek, és ideális esetben egészséges géneket hordoznának, amelyek képesek lennének a normális izomösszehúzódáshoz szükséges dystrophint előállítani. Ez a megközelítés nagyrészt sikertelen volt az embereknél. Egy újabb megközelítésben megpróbálták fokozni az izomban az utrofin termelését, egy olyan, a dystrophinhez hasonló fehérje, amely képes lehet átvenni a dystrophin szerepét, és megakadályozhatja a sejtkárosodást.
Self-Check Questions
Töltse ki az alábbi kvízt, hogy ellenőrizze az izomrostok összehúzódásának és ellazulásának megértését:
