TANULÁSI CÉLOK
- A kovalens és ionos kötések energetikájának leírása. keletkezését és felbomlását
- A kovalens kötések átlagos energiáinak felhasználásával becsüljük meg a reakcióentalpiákat
A kötés erőssége leírja, hogy az egyes atomok milyen erősen kapcsolódnak egy másik atomhoz, és ezért mennyi energia szükséges a két atom közötti kötés felbontásához.
Lényeges megjegyezni, hogy a kémiai kötések felbontásához energiát kell hozzáadni (endoterm folyamat), míg a kémiai kötések kialakításához energia szabadul fel (exoterm folyamat). A ![]() esetében a kovalens kötés nagyon erős; nagy mennyiségű energiát, 436 kJ-t kell hozzáadni ahhoz, hogy az egy mól hidrogénmolekulában lévő kötések felbomoljanak, és az atomok szétváljanak:
esetében a kovalens kötés nagyon erős; nagy mennyiségű energiát, 436 kJ-t kell hozzáadni ahhoz, hogy az egy mól hidrogénmolekulában lévő kötések felbomoljanak, és az atomok szétváljanak:
![]()
Megfordítva, ugyanannyi energia szabadul fel, amikor két mól H atomból egy mól ![]() molekula keletkezik:
molekula keletkezik:
![]()
Kötési szilárdság: Kovalens kötések
A stabil molekulák azért léteznek, mert kovalens kötések tartják össze az atomokat. A kovalens kötés erősségét a kötés felbontásához szükséges energiával mérjük, vagyis azzal az energiával, amely a kapcsolt atomok szétválasztásához szükséges. Bármely kötött atompár szétválasztása energiát igényel. Minél erősebb egy kötés, annál nagyobb energia szükséges a felbontásához.
Az egy mól gázmolekulában egy adott kovalens kötés felbontásához szükséges energiát kötési energiának vagy kötésdisszociációs energiának nevezzük. Egy kétatomos molekula kötési energiája, ![]() , az endoterm reakció standard entalpiaváltozásaként definiálható:
, az endoterm reakció standard entalpiaváltozásaként definiálható:
![]()
Például a tiszta kovalens H-H kötés kötési energiája, ![]() , 436 kJ egy mol H-H kötésbontásonként:
, 436 kJ egy mol H-H kötésbontásonként:
![]()
A három vagy több atomot tartalmazó molekuláknak két vagy több kötése van. Egy ilyen molekulában az összes kötési energia összege egyenlő a molekula összes kötését felbontó endoterm reakció standard entalpiaváltozásával. Például a ![]() négy C-H kötési energiájának összege, 1660 kJ, megegyezik a reakció standard entalpiaváltozásával:
négy C-H kötési energiájának összege, 1660 kJ, megegyezik a reakció standard entalpiaváltozásával:

A C-H kötés átlagos energiája, ![]() 1660/4 = 415 kJ/mol, mivel a reakcióban egy mólra négy mól C-H kötés szakad. Bár a négy C-H kötés egyenértékű az eredeti molekulában, nem mindegyiknek ugyanannyi energiára van szüksége a felszakításhoz; miután az első kötés felszakadt (ami 439 kJ/mol-t igényel), a többi kötést könnyebb felszakítani. A 415 kJ/mol érték az átlag, nem a pontos érték, amely bármelyik kötés felszakításához szükséges.
1660/4 = 415 kJ/mol, mivel a reakcióban egy mólra négy mól C-H kötés szakad. Bár a négy C-H kötés egyenértékű az eredeti molekulában, nem mindegyiknek ugyanannyi energiára van szüksége a felszakításhoz; miután az első kötés felszakadt (ami 439 kJ/mol-t igényel), a többi kötést könnyebb felszakítani. A 415 kJ/mol érték az átlag, nem a pontos érték, amely bármelyik kötés felszakításához szükséges.
A két atom közötti kötés erőssége a kötésben lévő elektronpárok számának növekedésével nő. Általában a kötés erősségének növekedésével a kötés hossza csökken. Így azt találjuk, hogy a hármas kötések erősebbek és rövidebbek, mint az azonos két atom közötti kettős kötések; hasonlóképpen a kettős kötések erősebbek és rövidebbek, mint az azonos két atom közötti egyszerű kötések. Néhány gyakori kötés átlagos kötési energiája az alábbi táblázatban látható, a kötéshosszok és kötéserősségek összehasonlítása pedig néhány gyakori kötés esetében a következő táblázatban látható. Amikor egy atom egy csoport különböző atomjaihoz kötődik, a kötés erőssége általában csökken, ahogy haladunk lefelé a csoportban. Például: ![]() 439 kJ/mol,
439 kJ/mol, ![]() 330 kJ/mol, és
330 kJ/mol, és ![]() 275 kJ/mol.
275 kJ/mol.
| kötési energiák (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| kötés | kötési energia | > | Bond | Bond Energy | Bond | Bond Energy | |
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Average bond lengths and bond energy for Some Gyakori kötések | ||
|---|---|---|
| Bond | Bond Length (Å) | Bond Energy (kJ/mol) |
| 1.54 | 345 | |
| 1.34 | 611 | |
| 1.20 | 837 | |
| 1.43 | 290 | |
| 1.38 | 615 | |
| 1.16 | 891 | |
| 1.43 | 350 | |
| 1.23 | 741 | |
| 1.13 | 1080 | |
A kötési energia a kötéstávolságban bekövetkező energiaminimum és a két elválasztott atom energiájának különbsége. Ez a kötés kialakulásakor felszabaduló energiamennyiség. Fordítva, ugyanennyi energia szükséges a kötés felbontásához. A fenti táblázatban látható ![]() molekula esetében a 74 pm kötéstávolságnál a rendszer energiája 7,24 × 10-19 J-val alacsonyabb, mint a két elválasztott hidrogénatomé. Ez kis számnak tűnhet. Azonban, mint később részletesebben meg fogjuk ismerni, a kötési energiákat gyakran mólonkénti alapon tárgyalják. Például egy H-H kötés felbontásához 7,24 × 10-19 J szükséges, de 1 mólnyi H-H kötés felbontásához 4,36 × 105 J szükséges. Néhány kötéshossz és energia összehasonlítása a fenti táblázatokban látható. Sok ilyen kötést találunk a legkülönbözőbb molekulákban, és ez a táblázat átlagos értékeket mutat. Például a
molekula esetében a 74 pm kötéstávolságnál a rendszer energiája 7,24 × 10-19 J-val alacsonyabb, mint a két elválasztott hidrogénatomé. Ez kis számnak tűnhet. Azonban, mint később részletesebben meg fogjuk ismerni, a kötési energiákat gyakran mólonkénti alapon tárgyalják. Például egy H-H kötés felbontásához 7,24 × 10-19 J szükséges, de 1 mólnyi H-H kötés felbontásához 4,36 × 105 J szükséges. Néhány kötéshossz és energia összehasonlítása a fenti táblázatokban látható. Sok ilyen kötést találunk a legkülönbözőbb molekulákban, és ez a táblázat átlagos értékeket mutat. Például a ![]() első C-H kötésének felbontásához 439,3 kJ/mol szükséges, míg a
első C-H kötésének felbontásához 439,3 kJ/mol szükséges, míg a ![]() (egy gyakori festékhígító) első C-H kötésének felbontásához 375 kJ/mol szükséges.5 kJ/mol.
(egy gyakori festékhígító) első C-H kötésének felbontásához 375 kJ/mol szükséges.5 kJ/mol.
Amint a fenti táblázatokból látható, egy átlagos szén-szén egyszerű kötés 347 kJ/mol, míg egy szén-szén kettős kötésben a ![]() kötés 267 kJ/mollal növeli a kötés szilárdságát. Egy további
kötés 267 kJ/mollal növeli a kötés szilárdságát. Egy további ![]() kötés hozzáadása további 225 kJ/mol növekedést okoz. Hasonló mintát láthatunk, amikor más
kötés hozzáadása további 225 kJ/mol növekedést okoz. Hasonló mintát láthatunk, amikor más ![]() és
és ![]() kötéseket hasonlítunk össze. Így minden egyes
kötéseket hasonlítunk össze. Így minden egyes ![]() kötés általában gyengébb, mint a megfelelő
kötés általában gyengébb, mint a megfelelő ![]() kötés ugyanazon két atom között. Egy
kötés ugyanazon két atom között. Egy ![]() kötésben nagyobb mértékű az orbitális átfedés, mint egy
kötésben nagyobb mértékű az orbitális átfedés, mint egy ![]() kötésben.
kötésben.
A kötési energiák segítségével közelítő entalpiaváltozásokat számíthatunk olyan reakciók esetében, ahol a képződési entalpiák nem állnak rendelkezésre. Az ilyen típusú számítások azt is megmondják, hogy egy reakció exoterm vagy endoterm. Exoterm reakció (ΔH negatív, termelt hő) akkor jön létre, ha a termékek kötései erősebbek, mint a reaktánsok kötései. Endoterm reakció (ΔH pozitív, felvett hő) akkor következik be, ha a termékekben lévő kötések gyengébbek, mint a reaktánsokban lévő kötések.
A kémiai reakció entalpiaváltozása, ΔH, megközelítőleg egyenlő a reaktánsokban lévő összes kötés felbontásához szükséges energia (energia “be”, pozitív előjel) és a termékekben lévő összes kötés kialakulásakor felszabaduló energia (energia “ki”, negatív előjel) összegével. Ez matematikailag a következőképpen fejezhető ki:
![]()
Ebben a kifejezésben a ![]() szimbólum azt jelenti, hogy “az összege”, D pedig a kötési energiát jelenti kilojoule/molban, ami mindig pozitív szám. A kötési energiát egy táblázatból kapjuk, és attól függ, hogy az adott kötés egyszerű, kettős vagy hármas kötés. Ezért az entalpiák ilyen módon történő kiszámításakor fontos, hogy minden reaktánsban és termékben figyelembe vegyük a kötést. Mivel a D értékek általában egy kötéstípusra vonatkozó átlagértékek sok különböző molekulában, ez a számítás egy durva becslést ad, nem pedig pontos értéket a reakcióentalpiára.
szimbólum azt jelenti, hogy “az összege”, D pedig a kötési energiát jelenti kilojoule/molban, ami mindig pozitív szám. A kötési energiát egy táblázatból kapjuk, és attól függ, hogy az adott kötés egyszerű, kettős vagy hármas kötés. Ezért az entalpiák ilyen módon történő kiszámításakor fontos, hogy minden reaktánsban és termékben figyelembe vegyük a kötést. Mivel a D értékek általában egy kötéstípusra vonatkozó átlagértékek sok különböző molekulában, ez a számítás egy durva becslést ad, nem pedig pontos értéket a reakcióentalpiára.
Nézzük meg a következő reakciót:
![]()
vagy
![]()
Két mólnyi ![]() , egy mól H-H kötést és egy mól Cl-Cl kötést kell felbontani. E kötések felbontásához szükséges energia a H-H kötés (436 kJ/mol) és a Cl-Cl kötés (243 kJ/mol) kötési energiájának összege. A reakció során két mol H-Cl kötés jön létre (kötési energia = 432 kJ/mol), ami 2 × 432 kJ, azaz 864 kJ felszabadulását jelenti. Mivel a termékek kötései erősebbek, mint a reaktánsoké, a reakció több energiát szabadít fel, mint amennyit elhasznál:
, egy mól H-H kötést és egy mól Cl-Cl kötést kell felbontani. E kötések felbontásához szükséges energia a H-H kötés (436 kJ/mol) és a Cl-Cl kötés (243 kJ/mol) kötési energiájának összege. A reakció során két mol H-Cl kötés jön létre (kötési energia = 432 kJ/mol), ami 2 × 432 kJ, azaz 864 kJ felszabadulását jelenti. Mivel a termékek kötései erősebbek, mint a reaktánsoké, a reakció több energiát szabadít fel, mint amennyit elhasznál:
Ez a többletenergia hő formájában szabadul fel, tehát a reakció exoterm. A G. függelékben a standard moláris képződési entalpia értéke \text{HCl} (g) , ![]() , -92,307 kJ/mol. Ennek az értéknek a kétszerese -184,6 kJ, ami jól egyezik a korábban két mol HCl képződésére kapott válasszal.
, -92,307 kJ/mol. Ennek az értéknek a kétszerese -184,6 kJ, ami jól egyezik a korábban két mol HCl képződésére kapott válasszal.
PÉLDA
A kötési energiák felhasználása a közelítő entalpiaváltozások kiszámításához
Metanol, ![]() , kiváló alternatív üzemanyag lehet. A gőz és a szén magas hőmérsékletű reakciója során a szénmonoxid,
, kiváló alternatív üzemanyag lehet. A gőz és a szén magas hőmérsékletű reakciója során a szénmonoxid, ![]() és hidrogén,
és hidrogén, ![]() , amelyből metanol állítható elő. A fenti táblázatokban szereplő kötési energiák felhasználásával számítsa ki az itt lezajló reakció közelítő entalpiaváltozását, ΔH-t:
, amelyből metanol állítható elő. A fenti táblázatokban szereplő kötési energiák felhasználásával számítsa ki az itt lezajló reakció közelítő entalpiaváltozását, ΔH-t:
![]()
Solution
Először fel kell írnunk a reaktánsok és a termékek Lewis szerkezetét:

Ebből látható, hogy a reakció ΔH-értéke tartalmazza a C-O hármas kötés és két H-H egyszeres kötés felbontásához szükséges energiát, valamint a három C-H egyszeres kötés, egy C-O egyszeres kötés és egy O-H egyszeres kötés kialakulásakor keletkező energiát. Ezt a következőképpen fejezhetjük ki:
A táblázatban szereplő kötési energiaértékek felhasználásával, megkapjuk:
Ezt az értéket összehasonlíthatjuk a G függelékben található ![]() adatok alapján számított értékkel:
adatok alapján számított értékkel:
Megjegyezzük, hogy a két különböző módszerrel számított értékek között meglehetősen jelentős különbség van. Ez azért fordul elő, mert a D értékek a különböző kötéserősségek átlaga; ezért gyakran csak durva egyezést adnak más adatokkal.
Check Your Learning
Etil-alkohol, ![]() , az egyik első, ember által szándékosan szintetizált szerves vegyi anyag volt. Az iparban számos felhasználási területe van, és ez az alkoholos italokban található alkohol. Cukor erjesztésével nyerhető, vagy etilén hidratálásával szintetizálható a következő reakcióban:
, az egyik első, ember által szándékosan szintetizált szerves vegyi anyag volt. Az iparban számos felhasználási területe van, és ez az alkoholos italokban található alkohol. Cukor erjesztésével nyerhető, vagy etilén hidratálásával szintetizálható a következő reakcióban:

A táblázatban szereplő kötési energiák felhasználásával számítsa ki a reakció közelítő entalpiaváltozását, ΔH-t.
-35 kJ
Ionkötés erőssége és rácsenergia
Az ionos vegyület a pozitív és negatív ionok közötti elektrosztatikus vonzás miatt stabil. A vegyület rácsenergiája ennek a vonzásnak az erősségét méri. Egy ionos vegyület rácsenergiáját (ΔHlattice) úgy határozzuk meg, hogy mekkora energia szükséges ahhoz, hogy a szilárd anyag egy mólja szétváljon a komponensek gázionjaira. Az MX ionos szilárd anyag esetében a rácsenergia a folyamat entalpiaváltozása:
![]()
Megjegyezzük, hogy azt a konvenciót használjuk, amikor az ionos szilárd anyagot ionokra választjuk szét, így a rács-energiáink endotermek (pozitív értékek) lesznek. Egyes szövegek ezzel egyenértékű, de ellentétes konvenciót használnak, és a rácsenergiát a különálló ionok rácsot alkotó egyesülésekor felszabaduló energiaként határozzák meg, és negatív (exoterm) értékeket adnak meg. Ha tehát a rácsenergiát egy másik hivatkozásban keresi, mindenképpen ellenőrizze, hogy melyik definíciót használják. Mindkét esetben a rácsenergia nagyobb értéke stabilabb ionos vegyületet jelez. Nátrium-klorid esetében ![]() . Tehát 769 kJ-ra van szükség egy mol szilárd
. Tehát 769 kJ-ra van szükség egy mol szilárd ![]() gáznemű
gáznemű ![]() és \text{Cl}^- ionokra. Amikor egy-egy mol gáznemű
és \text{Cl}^- ionokra. Amikor egy-egy mol gáznemű ![]() és \text{Cl}^- ionból szilárd
és \text{Cl}^- ionból szilárd ![]() , 769 kJ hő szabadul fel.
, 769 kJ hő szabadul fel.
A rácsenergia ![]() egy ionkristályban a következő (az elektromos töltések közötti erőket szabályozó Coulomb-törvényből levezetett) egyenlet segítségével fejezhető ki:
egy ionkristályban a következő (az elektromos töltések közötti erőket szabályozó Coulomb-törvényből levezetett) egyenlet segítségével fejezhető ki:
![]()
melyben C a kristályszerkezet típusától függő állandó; Z+ és Z- az ionok töltései; Ro pedig az interionikus távolság (a pozitív és negatív ionok sugarainak összege). Így egy ionkristály rácsenergiája gyorsan nő, ahogy az ionok töltései nőnek és az ionok mérete csökken. Ha minden más paramétert állandó értéken tartunk, a kation és az anion töltésének megduplázása négyszeresére növeli a rácsenergiát. Például a ![]() (Z+ és Z- = 1) 1023 kJ/mol, míg a \text{MgO} \text{MgO} (Z+ és Z- = 2) 3900 kJ/mol (a Ro közel azonos – kb. 200 pm mindkét vegyület esetében).
(Z+ és Z- = 1) 1023 kJ/mol, míg a \text{MgO} \text{MgO} (Z+ és Z- = 2) 3900 kJ/mol (a Ro közel azonos – kb. 200 pm mindkét vegyület esetében).
A különböző atomok közötti távolságok különböző rácsenergiákat eredményeznek. Például összehasonlíthatjuk a ![]() (2957 kJ/mol) és a
(2957 kJ/mol) és a ![]() (2327 kJ/mol) rácsenergiáját, hogy megfigyeljük az F-nek az I-hez képest kisebb ionméretének a rácsenergiára gyakorolt hatását.
(2327 kJ/mol) rácsenergiáját, hogy megfigyeljük az F-nek az I-hez képest kisebb ionméretének a rácsenergiára gyakorolt hatását.
PÉLDA
Rácsenergia összehasonlítások
A drágakő rubin alumínium-oxid, ![]() , amely nyomokban tartalmaz
, amely nyomokban tartalmaz ![]() . A
. A ![]() vegyületet egyes félvezető eszközök gyártásánál használják. Melyiknek nagyobb a rácsenergiája,
vegyületet egyes félvezető eszközök gyártásánál használják. Melyiknek nagyobb a rácsenergiája, ![]() vagy
vagy ![]() ?
?
Solution
Ebben a két ionos vegyületben a Z+ és Z- töltések azonosak, így a rácsenergia különbsége a Ro-tól függ. A ![]() ion kisebb, mint a
ion kisebb, mint a ![]() ion. Így
ion. Így ![]() rövidebb interiontávolsággal rendelkezne, mint
rövidebb interiontávolsággal rendelkezne, mint ![]() , és
, és ![]() lenne a nagyobb rácsenergia.
lenne a nagyobb rácsenergia.
Check Your Learning
Cink-oxid, ![]() , nagyon hatékony fényvédőszer. Hogyan lenne a
, nagyon hatékony fényvédőszer. Hogyan lenne a ![]() és a
és a ![]() között. ” height=”16″ width=”48″ style=”vertical-align: 0px”>?
között. ” height=”16″ width=”48″ style=”vertical-align: 0px”>?
KULCSMÓDOK
A kovalens kötés szilárdságát a kötés disszociációs energiájával mérjük, vagyis azzal az energiamennyiséggel, amely az adott kötés felbontásához szükséges egy mól molekulában. A többszörös kötések erősebbek, mint az azonos atomok közötti egyszerű kötések. A reakció entalpiája a kötések felbontásához szükséges energiabevitel és az új kötések kialakulásakor felszabaduló energia alapján becsülhető. Ionkötések esetén a rácsenergia az az energia, amely a vegyület egy móljának a gázfázisú ionokra való szétválasztásához szükséges. A rácsenergia a nagyobb töltéssel rendelkező ionok és az ionok közötti rövidebb távolságok esetén nő.
- Kötési energia egy kétatomos molekula esetében:
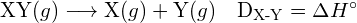
- Entalpiaváltozás:

- Rácsenergia egy szilárd MX esetében:
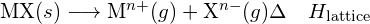
- rácsos energia egy ionos kristályhoz:
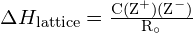
KÖZPONT FELADATOK
- Az alábbi kötéspárok közül melyik kötés a legerősebb? (a)
 vagy
vagy 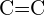 b)
b) 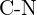 vagy
vagy 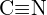 c)
c) 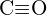 vagy
vagy 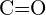 d)
d) 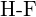 vagy
vagy 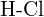 e)
e) 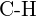 vagy
vagy 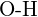 f)
f) 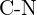 vagy
vagy 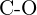
- A táblázatban szereplő kötési energiák felhasználásával határozzuk meg az alábbi reakciók mindegyikének közelítő entalpiaváltozását: (a)
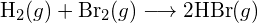 b)
b) 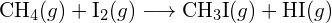 (c)
(c) 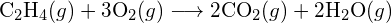 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - A táblázatban szereplő kötési energiák felhasználásával határozzuk meg az alábbi reakciók mindegyikének közelítő entalpiaváltozását: (a)
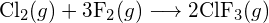 b)
b) 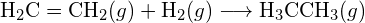 (c)
(c) 
- Rajzold fel egy olyan rendszer energiáját leíró görbét, amelyben a H és Cl atomok különböző távolságban vannak egymástól. Ezután keresse meg ennek a görbének a minimális energiáját kétféleképpen. a) A táblázatokban található kötési energiák segítségével számítsa ki az energiát egyetlen
 kötés energiájának kiszámításához (Tipp: Hány kötés van egy mólban?)(b) A reakcióentalpia és a H2 és Cl2 kötési energiái segítségével oldjuk meg egy mól
kötés energiájának kiszámításához (Tipp: Hány kötés van egy mólban?)(b) A reakcióentalpia és a H2 és Cl2 kötési energiái segítségével oldjuk meg egy mól  kötésének energiája.
kötésének energiája.
Magyarázza meg, hogy a kötések miért meghatározott átlagos kötéstávolságon jönnek létre ahelyett, hogy az atomok végtelenül közelednének egymáshoz.
A meghatározott átlagos kötéstávolság a legkisebb energiájú távolság. A kötéstávolságnál kisebb távolságoknál a két atommag pozitív töltései taszítják egymást, és az összenergia megnő. - Ha egy molekula két különböző szerkezetet tud kialakítani, általában az erősebb kötésekkel rendelkező szerkezet a stabilabb forma. A kötési energiák segítségével jósolja meg a hidroxil-amin molekula helyes szerkezetét:
 A bal oldali ábrán a nagyobb kötési energia látható. Ez a stabilabb forma.
A bal oldali ábrán a nagyobb kötési energia látható. Ez a stabilabb forma. - Hogyan alakul a \text{HCl} kötési energiája. (g) eltér a \text{HCl} standard képződési entalpiájától. (g) ?
- A G. függelékben található standard képződési entalpia adatok felhasználásával mutassa meg, hogy a \text{HCl} standard képződési entalpiája hogyan tér el a \text{HCl} (g) kötési energiájának meghatározására használható.
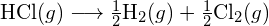
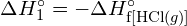
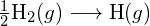
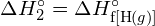
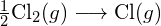
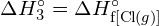
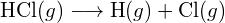
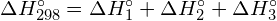
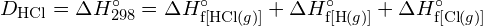
- A G függelékben található standard képződési entalpia adatok felhasználásával számítsuk ki a szén-kén kettőskötés kötési energiáját
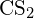 -ben.
-ben. - A G függelékben található standard képződési entalpia adatok felhasználásával határozzuk meg, hogy melyik kötés erősebb: az S-F kötés a
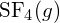 vagy a
vagy a 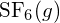 kötésben?
A
kötésben?
A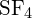 S-F kötés erősebb.
S-F kötés erősebb. - A G függelékben található standard képződési entalpia adatok felhasználásával határozza meg, hogy melyik kötés erősebb: a P-Cl kötés a
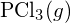 vagy a
vagy a 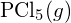 kötésben?
kötésben? - Töltse ki a következő Lewis-szerkezetet kötések (nem atomok) hozzáadásával, majd jelölje meg a leghosszabb kötést:

 A C-C egyszeres kötések a leghosszabbak.
A C-C egyszeres kötések a leghosszabbak. - A kötési energia segítségével számítsa ki a ΔH közelítő értékét a következő reakcióhoz. Melyik a
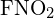 stabilabb formája?
stabilabb formája?
- Az alábbi kérdések megválaszolásához használjuk az atomszerkezet alapelveit:1 a) A Ca atom sugara 197 pm; a
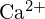 ion sugara 99 pm. Adjon számot a különbségről. (b) A \text{CaO} rácsenergiája (s) -3460 kJ/mol; a
ion sugara 99 pm. Adjon számot a különbségről. (b) A \text{CaO} rácsenergiája (s) -3460 kJ/mol; a 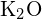 -2240 kJ/mol. Számoljuk ki a különbséget. (c) Ezen ionizációs értékek ismeretében magyarázza meg a Ca és a K közötti különbséget az első és második ionizációs energiájuk tekintetében.
-2240 kJ/mol. Számoljuk ki a különbséget. (c) Ezen ionizációs értékek ismeretében magyarázza meg a Ca és a K közötti különbséget az első és második ionizációs energiájuk tekintetében.
Elem Első ionizációs energia (kJ/mol) Második ionizációs energia (kJ/mol) K 419 .
3050 Ca 590 1140 (d) Az Mg első ionizációs energiája 738 kJ/mol, az Al-é 578 kJ/mol. Adjon magyarázatot erre a különbségre.
(a) Amikor két elektron eltávolodik a valenciahéjból, a Ca sugárban elveszíti a legkülső energiaszintet, és visszatér az alacsonyabb n = 3 szintre, amely sokkal kisebb sugarú.(b) A kalcium +2 töltése a K-hoz képest sokkal közelebb húzza az oxigént, ezáltal növeli a rács energiáját egy kevésbé töltött ionhoz képest.
(c) A Ca 4s elektronjának eltávolítása több energiát igényel, mint a K 4s elektronjának eltávolítása a mag erősebb vonzása és az elektronok párosodásának felbontásához szükséges többletenergia miatt. A K második ionizációs energiája megköveteli, hogy az elektront egy alacsonyabb energiaszintről távolítsuk el, ahol az elektron számára sokkal erősebb az atommag vonzása. Ezenkívül energiára van szükség ahhoz, hogy két elektron párosodását feloldják egy teljes orbitálon. A Ca esetében a második ionizációs potenciál csak egy magányos elektron eltávolítását igényli a kitett külső energiaszinten.
(d) Az Al esetében az eltávolított elektron viszonylag védtelen és párosítatlan egy p orbitálon. Az Mg esetében a magasabb energia elsősorban a 2s elektron párosíthatatlanságát tükrözi.
- Az alábbi anyagok közül melyikhez szükséges a legkevesebb energia ahhoz, hogy a szilárd anyag egy molját különálló ionokká alakítsuk? (a) \text{MgO} b)
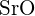 c)
c) 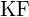 d)
d) 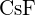 (e)
(e) 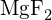 (d)
(d) - Egy fém,
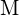 egy halogénnel,
egy halogénnel, 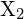 , exoterm reakcióban megy végbe, amint azt ez az egyenlet mutatja:
, exoterm reakcióban megy végbe, amint azt ez az egyenlet mutatja: 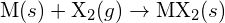 . Jelölje meg az alábbiak közül mindegyiknél, hogy melyik lehetőség esetén lesz a reakció exotermebb. Magyarázza meg válaszát. (a) nagy sugár vs. kis sugár
. Jelölje meg az alábbiak közül mindegyiknél, hogy melyik lehetőség esetén lesz a reakció exotermebb. Magyarázza meg válaszát. (a) nagy sugár vs. kis sugár 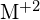 (b) nagy ionizációs energia vs. alacsony ionizációs energia a
(b) nagy ionizációs energia vs. alacsony ionizációs energia a 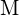 (c) a halogén növekvő kötési energiája (d) a halogén csökkenő elektronaffinitása (e) a halogén által képzett anion növekvő mérete
(c) a halogén növekvő kötési energiája (d) a halogén csökkenő elektronaffinitása (e) a halogén által képzett anion növekvő mérete - A
 1023 kJ/mol, a Li-F távolsága pedig 201 pm. \text{MgO} ugyanabban a szerkezetben kristályosodik, mint
1023 kJ/mol, a Li-F távolsága pedig 201 pm. \text{MgO} ugyanabban a szerkezetben kristályosodik, mint  , de az Mg-O távolság 205 pm. Az alábbi értékek közül melyik közelíti meg leginkább a \text{MgO} \text{MgO} rácsenergiáját. : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol vagy 4008 kJ/mol? Magyarázza meg a választását.
4008 kJ/mol; a \text{MgO} mindkét ionja \text{MgO} kétszer akkora töltéssel rendelkeznek, mint a
, de az Mg-O távolság 205 pm. Az alábbi értékek közül melyik közelíti meg leginkább a \text{MgO} \text{MgO} rácsenergiáját. : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol vagy 4008 kJ/mol? Magyarázza meg a választását.
4008 kJ/mol; a \text{MgO} mindkét ionja \text{MgO} kétszer akkora töltéssel rendelkeznek, mint a ; a kötéshossz nagyon hasonló, és mindkettőnek ugyanaz a szerkezete; az energia megnégyszereződése várható a rácsenergia egyenlete alapján
; a kötéshossz nagyon hasonló, és mindkettőnek ugyanaz a szerkezete; az energia megnégyszereződése várható a rácsenergia egyenlete alapján - Az alábbi párok közül melyik vegyületnek nagyobb a rácsenergiája? Megjegyzés:
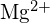 és
és 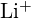 hasonló sugárral rendelkeznek;
hasonló sugárral rendelkeznek; 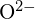 és
és 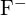 hasonló sugarakkal rendelkeznek. Magyarázzátok meg a választásotokat. (a) \text{MgO} vagy
hasonló sugarakkal rendelkeznek. Magyarázzátok meg a választásotokat. (a) \text{MgO} vagy 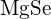 b)
b)  vagy \text{MgO} c)
vagy \text{MgO} c) 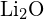 vagy
vagy 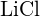 d)
d) 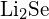 vagy \text{MgO}
vagy \text{MgO} - Az alábbi párok közül melyik vegyületnek van a nagyobb rácsenergiája? Megjegyzés:
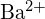 és
és 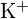 hasonló sugarakkal rendelkezik;
hasonló sugarakkal rendelkezik; 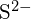 és \text{Cl}^- hasonló sugarakkal rendelkeznek. Magyarázza meg a választását. (a)
és \text{Cl}^- hasonló sugarakkal rendelkeznek. Magyarázza meg a választását. (a) 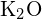 vagy
vagy 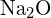 b)
b) 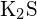 vagy \text{BaS} c)
vagy \text{BaS} c) 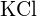 vagy \text{BaS} (d) \text{BaS} vagy
vagy \text{BaS} (d) \text{BaS} vagy 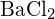 (a)
(a)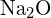 ;
; 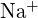 kisebb sugarú, mint
kisebb sugarú, mint 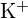 ; b) \text{BaS}} ;
; b) \text{BaS}} ; 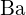 nagyobb töltéssel rendelkezik, mint
nagyobb töltéssel rendelkezik, mint 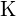 ; c) \text{BaS} ;
; c) \text{BaS} ; 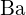 és
és 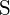 nagyobb töltéssel rendelkezik; (d) \text{BaS} \text{BaS} ;
nagyobb töltéssel rendelkezik; (d) \text{BaS} \text{BaS} ; 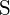 nagyobb töltéssel rendelkezik
nagyobb töltéssel rendelkezik - Az alábbi vegyületek közül melyiknek van a legnagyobb energiaigénye ahhoz, hogy a szilárd anyag egy molját különálló ionokká alakítsa? (a) \text{MgO} b)
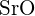 c)
c) 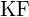 d)
d) 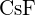 e)
e) 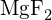
- Az alábbi vegyületek közül melyiknek van a legnagyobb energiaigénye ahhoz, hogy a szilárd anyag egy molját különálló ionokká alakítsa? (a)
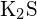 b)
b) 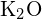 c)
c) 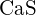 d)
d) 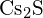 e)
e) 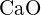 (e)
(e)
Lábjegyzet
- 1 Ez a kérdés a Chemistry Advanced Placement Examination vizsgakérdésből származik, és az Educational Testing Service engedélyével került felhasználásra.
Glosszárium
kötési energia (más néven, kötés disszociációs energia) gáznemű anyagban egy kovalens kötés felbontásához szükséges energia rácsenergia (ΔHlattice) egy ionos szilárd anyag egy móljának alkotórészeire való szétválasztásához szükséges energia. gázionok
gázionos szilárd anyag egy moljának komponensekre történő szétválasztásához szükséges energia
