A: AMINO ACIDS
BIOKÉMIA – DR. JAKUBOWSKI
Utolsó frissítés: 02/27/16
Tanulási célok/célkitűzések a 2A fejezethez: Az órát és ezt az olvasmányt követően a tanulók képesek lesznek
- megadni az aminosav-oldalláncok töltését a Henderson Hasselbach-egyenlet és a közelítő töltés vizsgálatával bármely adott pH-n
- megrajzolni a nukleofil Lys és Cys oldalláncok és gyakori kémiai módosítószerek reakciójának mechanizmusát és azonosítani a termékeket, és ezt a megértést kiterjeszteni a His reakcióira.
- rajzoljon mechanizmusokat a szulfhidrinek diszulfidcsere-reakcióihoz, felhasználva azokat és az oxidációs számokat a cisztein/cisztin redoxireakcióinak magyarázatára.
A7. Cisztein kémia
Két cisztein oldallánc kovalens kölcsönhatásba léphet egy fehérjében, hogy diszulfidot hozzon létre. Ahogy a HOOH (hidrogén-peroxid) oxidáltabb, mint a HOH (a H2O2-ben lévő O oxidációs száma 1-, míg a H2O-ban lévő O oxidációs száma 2-) , az RSSR a tiolok oxidált formája (S oxidációs száma 1-) és az RSH a redukált formája (S oxidációs száma 2-). Ezek oxidációs száma analóg, mivel az O és az S egyaránt a periódusos rendszer 6. csoportjában található, és mindkettő elektronegatívabb, mint a C.
A redoxireakciók és az oxidációs számok gyors áttekintése.
Ábra: DISZULFID – CYS – REAKCIÓK
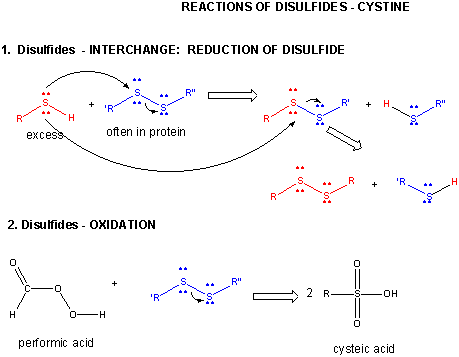
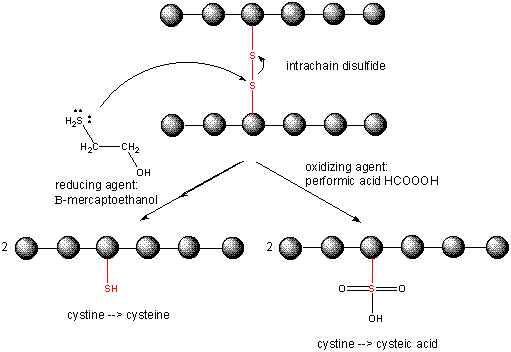
A fehérje hajtogatásakor két Cys oldallánc közeledhet egymáshoz, és egy intrachain diszulfidkötést képezhet. Hasonlóképpen, két Cys oldallánc különálló fehérjéken megközelítheti egymást, és láncközi diszulfidkötést képezhet. Az ilyen diszulfidokat fel kell hasítani, és a láncokat szét kell választani, mielőtt a fehérje szekvenciáját elemeznénk. A fehérjében lévő diszulfidot redukálószerekkel, például béta-merkaptoetanollal, ditiotreitollal, trisz(2-karboxietil)foszfinnal (TCEP) vagy oxidálószerekkel lehet hasítani, amelyek tovább oxidálják a diszulfidot, és így a cisztás savakat szétválasztják.
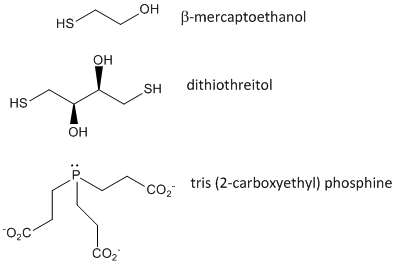
Ábra: Disulfid-oxidáló szerek – b-merkaptoetanol, ditiotreitol és foszfinok
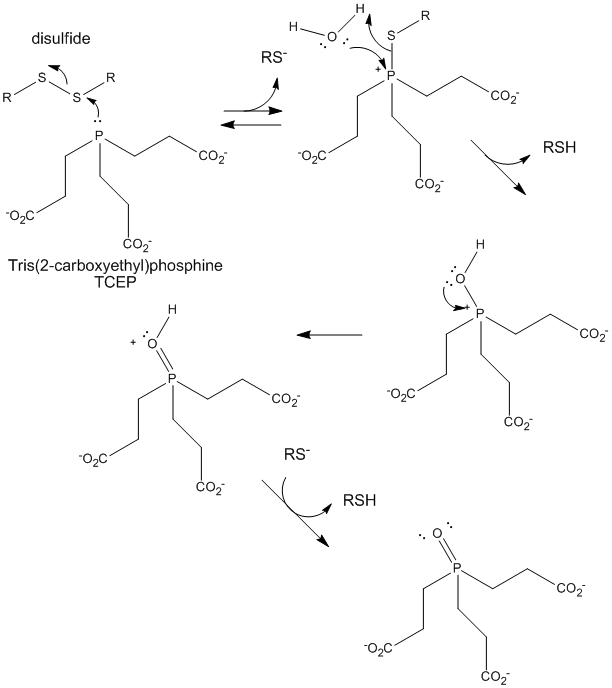
Ábra: A diszulfidok TCEP redukciója
A sejtek belsejét számos “redukáló” szer, például a tripeptid g-glu-cys-gly (glutation) jelenléte tartja redukált környezetben. Ezért a sejten belüli fehérjék általában nem tartalmaznak diszulfidokat, amelyek az extracelluláris fehérjékben (például a vérben találhatóak) vagy bizonyos organellumokban, például az endoplazmatikus retikulumban és a mitokondriális intermembrán térben, ahol diszulfidokc kerülhetnek be, bőségesen előfordulnak.
Ábra:
Diszulfidkötések felbontása a fehérjékben
Cisztein redoxkémia
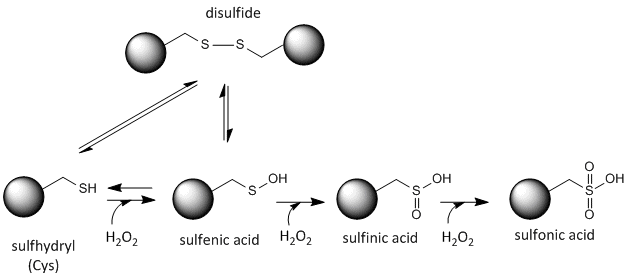
A ciszteinben lévő kén redox-aktív, ezért a helyi redox-környezettől és az oxidáló és redukáló anyagok jelenlététől függően sokféle állapotban létezhet. A sejtekben előállítható erős oxidálószer a hidrogén-peroxid, amely a Cys oldalláncok drasztikusabb és irreverzibilis kémiai módosításaihoz vezethet. Ha egy reaktív Cys fontos a fehérje működése szempontjából, akkor a fehérje működése különböző oxidálószerekkel módosítható (néha reverzibilisen, néha irreverzibilisen), ahogy az alábbi ábrán látható.
Ábra:A cisztein redoxi állapota
Navigáció
Return toChapter 2A: Aminosavrészletek
Return toBiochemistry Online Table of Contents
Archived version of fullChapter 2A: Amino Acids
.
