Az ionos, a kovalens (egyszerű molekuláris és óriásatomos) és a fémes vegyületek mind különböző tulajdonságokkal rendelkeznek. Ezért ahhoz, hogy egy anyagot az ilyen vegyületek valamelyikébe soroljunk, egy sor vizsgálatot/kísérletet kell elvégezni, hogy kiderüljön, milyen tulajdonságokkal rendelkezik. Figyeld meg az alábbi táblázatot:
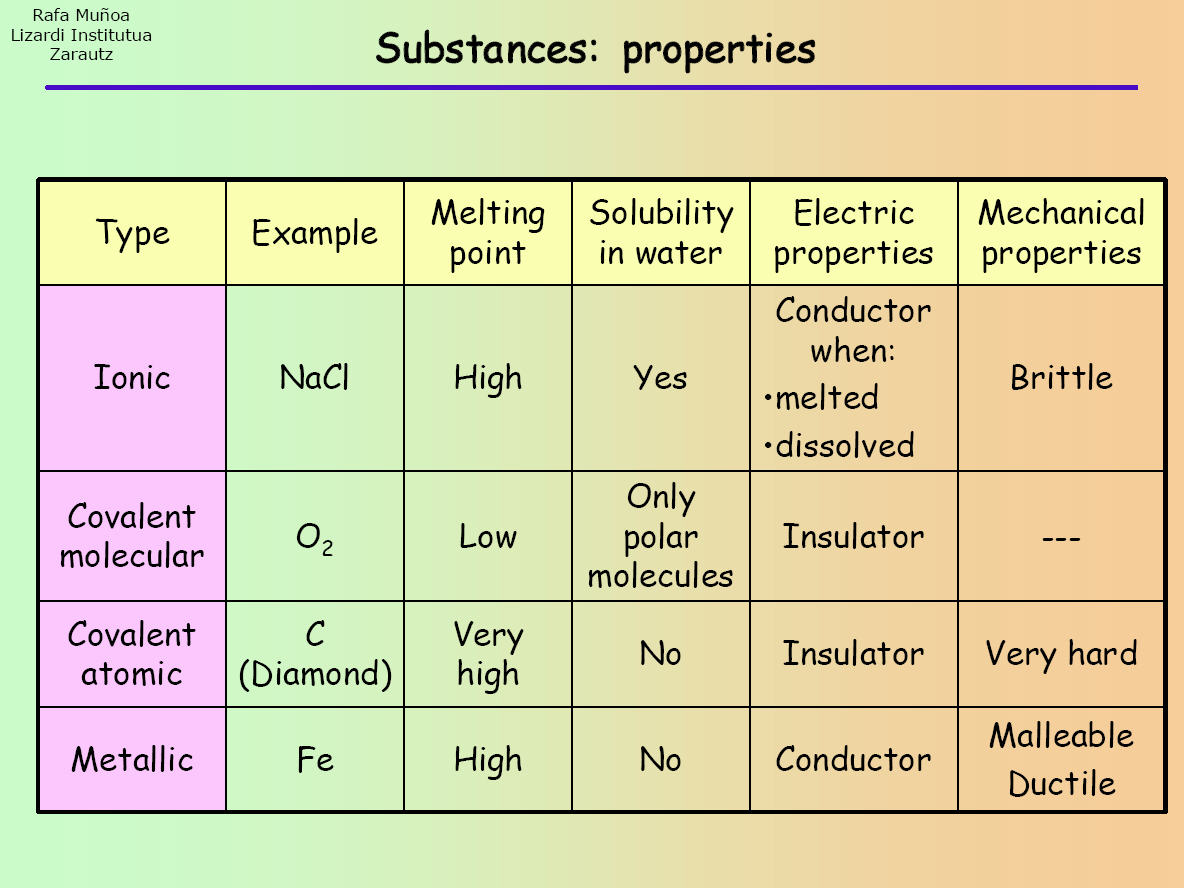
A kísérlet elvégzése után a kapott eredményeket össze lehet hasonlítani a táblázatban szereplő eredményekkel, hogy megállapítsd, milyen vegyületről van szó.
Először is, az ismeretlen anyagból egy mintát egy kémcsőbe lehet tenni, és láng fölé tenni. Ez az olvadáspont meghatározásához történik. Ha az anyag megolvad, akkor valószínűleg kovalens egyszerű molekulájú anyagról van szó (ahogy a táblázatban látható). Ha azonban nem következik be olvadás, akkor az anyag lehet ionos, kovalens óriásatomos vagy fémes.
Valójában ezért kell egynél több vizsgálatot végezni az ismeretlen anyagon, mert egyes vegyületkategóriák hasonló tulajdonságokkal rendelkeznek (például az ionos és a kovalens vegyületeknek egyaránt magas az olvadáspontjuk).
A következő lépésben megpróbálhatod az anyag egy részét vízben (vagy más poláros oldószerben) feloldani. Ha feloldódik, akkor vagy ionos vagy kovalens egyszerű molekuláris vegyület lehet. Az előző és a következő vizsgálat során kapott eredményeid segítenek leszűkíteni az eredményeket egyféle vegyületre.
A következő lépésben a mintát egy olyan áramkörhöz csatlakoztathatod, mint az alábbiakban látható, hogy megnézd, vezeti-e az elektromos áramot.
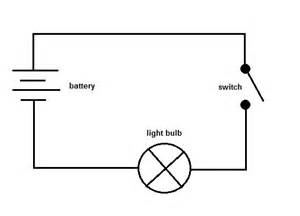
A kapcsolót kicserélheted a mintára. Ha az izzó világít, akkor az egy vezető, ha nem, akkor nem vezető.
Így például a kísérlet végén, ha a minta nem olvadt meg, feloldódott a vízben és vezette az elektromos áramot, akkor az egy ionos vegyület.
Mindezeket a megfigyeléseket tovább magyarázhatjuk, ha megvizsgáljuk a kötéseket és a molekulák közötti vonzóerőket, amelyek a vegyület összetevőit összetartják.
