Amikor egy egyenletes áramlású gáz áthalad egy szűkületen, pl. egy nyíláson vagy szelepen, általában hőmérsékletváltozás következik be. Ez részben a mozgási energia változásának köszönhető, de van egy másik része is, amelyhez a gáz nemidealitása járul hozzá. Ha a fel- és leáramló csatornák elég nagyok ahhoz, hogy a kinetikus energia elhanyagolható legyen ezeken az állomásokon, a fel- és leáramló hőmérsékleteket a szűkület által létrehozott zavartól elég messze mérjük, és a rendszer adiabatikus; a mért hatás kizárólag a nemidealitásnak köszönhető. A termodinamika első törvénye alapján egy ilyen folyamat izenthalpikus, és a Joule-Thomson-együtthatót hasznosan definiálhatjuk:
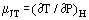
mint a szűkületen keresztüli nyomásesésből eredő hőmérsékletváltozás mértékét.
A legtöbb valós gáz esetében, körülbelül környezeti körülmények között, μ pozitív – azaz a hőmérséklet csökken, ahogy áthalad a szűkületen. A hidrogén és a hélium esetében negatív, és a hőmérséklet nő. Magasabb hőmérsékleten a legtöbb gáz esetében μ csökken, és akár negatívvá is válhat, μ negatívvá válhat nyomás alkalmazásával, még környezeti hőmérsékleten is, de ehhez általában 200 bar feletti nyomás szükséges.
