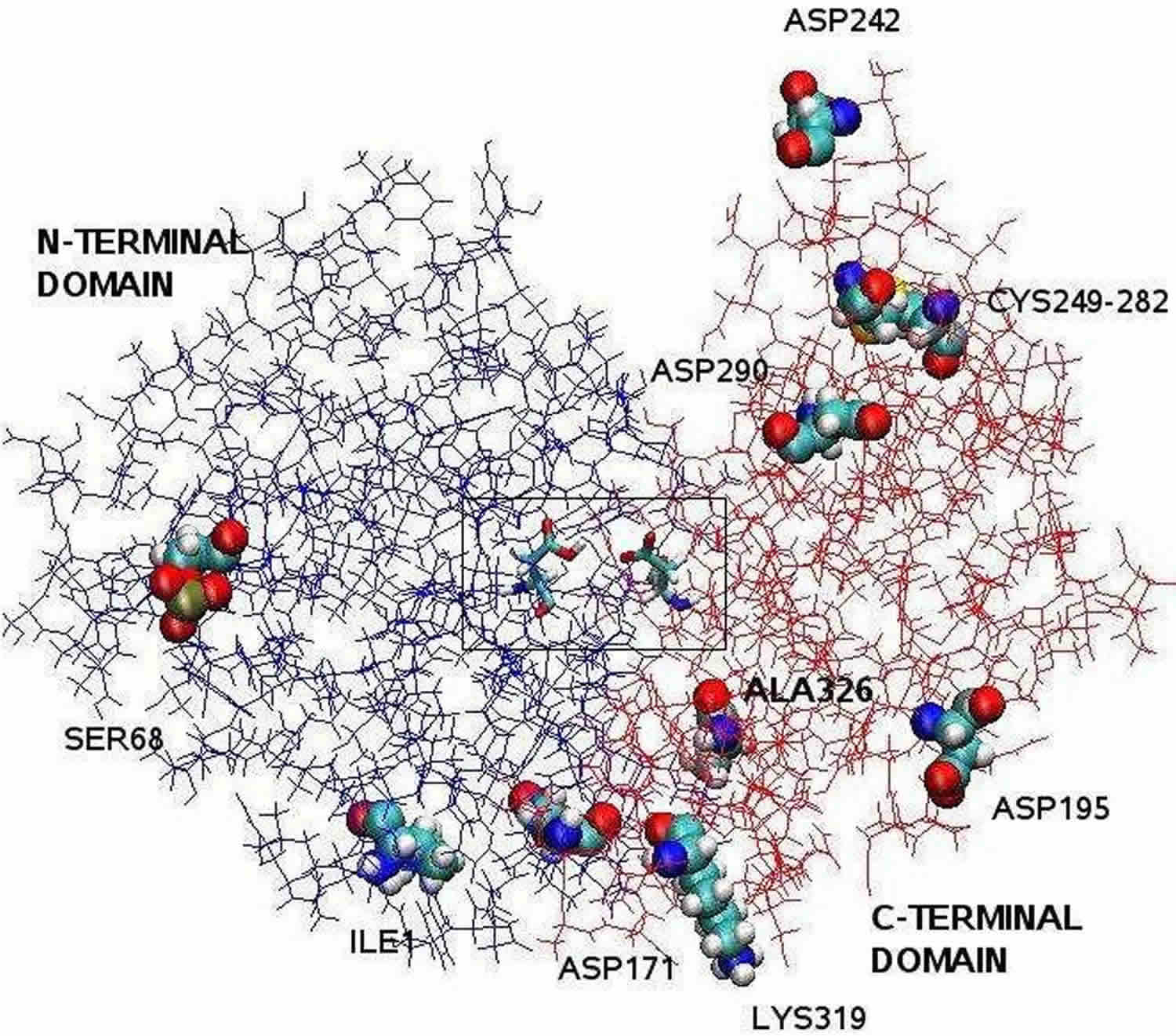
 Lábjegyzet: A röntgenkrisztallográfiával tisztázott pepszin szerkezete bilobális, a két lebeny között nagy aktív centrumhasadékkal. Az 1-től 175-ig terjedő maradékok alkotják az N-terminális domént, míg a 176-tól 326-ig terjedő maradékok a C-terminális domént. A hasadék közepén lévő két aszpartát, az Asp32 és Asp215 katalitikus maradékként funkcionál. Az Asp32-ből és Asp215-ből álló katalitikus hely a hasadék közepén található. A fehérje felszínén található töltött aminosavmaradványok: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminális), Ala326 (C-terminális). A foszforilált Ser68 teljesen ki van téve az oldószer felé, és a Cys 249 és Cys 282 közötti diszulfidhíd a fehérje felszínén helyezkedik el.
Lábjegyzet: A röntgenkrisztallográfiával tisztázott pepszin szerkezete bilobális, a két lebeny között nagy aktív centrumhasadékkal. Az 1-től 175-ig terjedő maradékok alkotják az N-terminális domént, míg a 176-tól 326-ig terjedő maradékok a C-terminális domént. A hasadék közepén lévő két aszpartát, az Asp32 és Asp215 katalitikus maradékként funkcionál. Az Asp32-ből és Asp215-ből álló katalitikus hely a hasadék közepén található. A fehérje felszínén található töltött aminosavmaradványok: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminális), Ala326 (C-terminális). A foszforilált Ser68 teljesen ki van téve az oldószer felé, és a Cys 249 és Cys 282 közötti diszulfidhíd a fehérje felszínén helyezkedik el.
A pepszin, mint aszparaginsav-proteáz, nagyon alacsony pH-optimummal rendelkezik. Kondjoyan, Daudin és Santé-Lhoutellier 9) a myofibrilláris fehérjék emészthetőségét vizsgálva 2 körüli pH-nál találták a pepszin maximális aktivitását. Pletschke, Naudé és Oelofsen 10) a hemoglobin sertés és strucc pepszinnel történő hidrolízisét tanulmányozta, és szintén 2,0 pH-optimumot talált a pepszinaktivitáshoz. Miután pH <4,5 pH-nál aktiválódott, a pepszin enzim 7,0 feletti pH-nál könnyen denaturálódik, ami a pepszin jellemzőit meghatározó tulajdonságokat képezi 11).
A pH hatásával ellentétben az ionerősség enzimaktivitásra gyakorolt hatását ritkábban tárgyalják. Dale és White 12) korábbi munkája azt mutatta, hogy az ionerősség növelése egyértelműen csökkenti az immobilizált hasnyálmirigy ribonukleáz reakciósebességét, míg Butré, Wierenga és Gruppen 13) a tejsavófehérje-izolátum alkaláz és neutráz enzimatikus hidrolízisét vizsgálta, és szintén azt találták, hogy 0.5M NaCl jelenléte csökkentette a hidrolízis sebességét.
A pepszin két erős, természetben előforduló inhibitora ismert: a pepstatin, egy Streptomycesből származó pentapeptid, és egy egyedülálló fehérje inhibitor az Ascarisból. A pepszin visszacsatolt gátláson is átesik; a fehérjeemésztés egy terméke a pepszin gátlásával lassítja a reakciót 14).
Hol termelődik a pepszin?
A fősejtek a pepszint egy inaktív enzim prekurzor, a pepszinogén formájában választják ki. Amikor a pepszinogén a parietális sejtekből származó sósavval érintkezik, gyorsan lebomlik, pepszint képezve 15). A pepszin kezdi meg szinte mindenféle táplálékfehérje polipeptidekké történő emésztését. Ez az enzim savas környezetben a legaktívabb, amit a gyomornedvben lévő sósav biztosít.
2. ábra. Gyomorsejtek (gyomormirigyek)
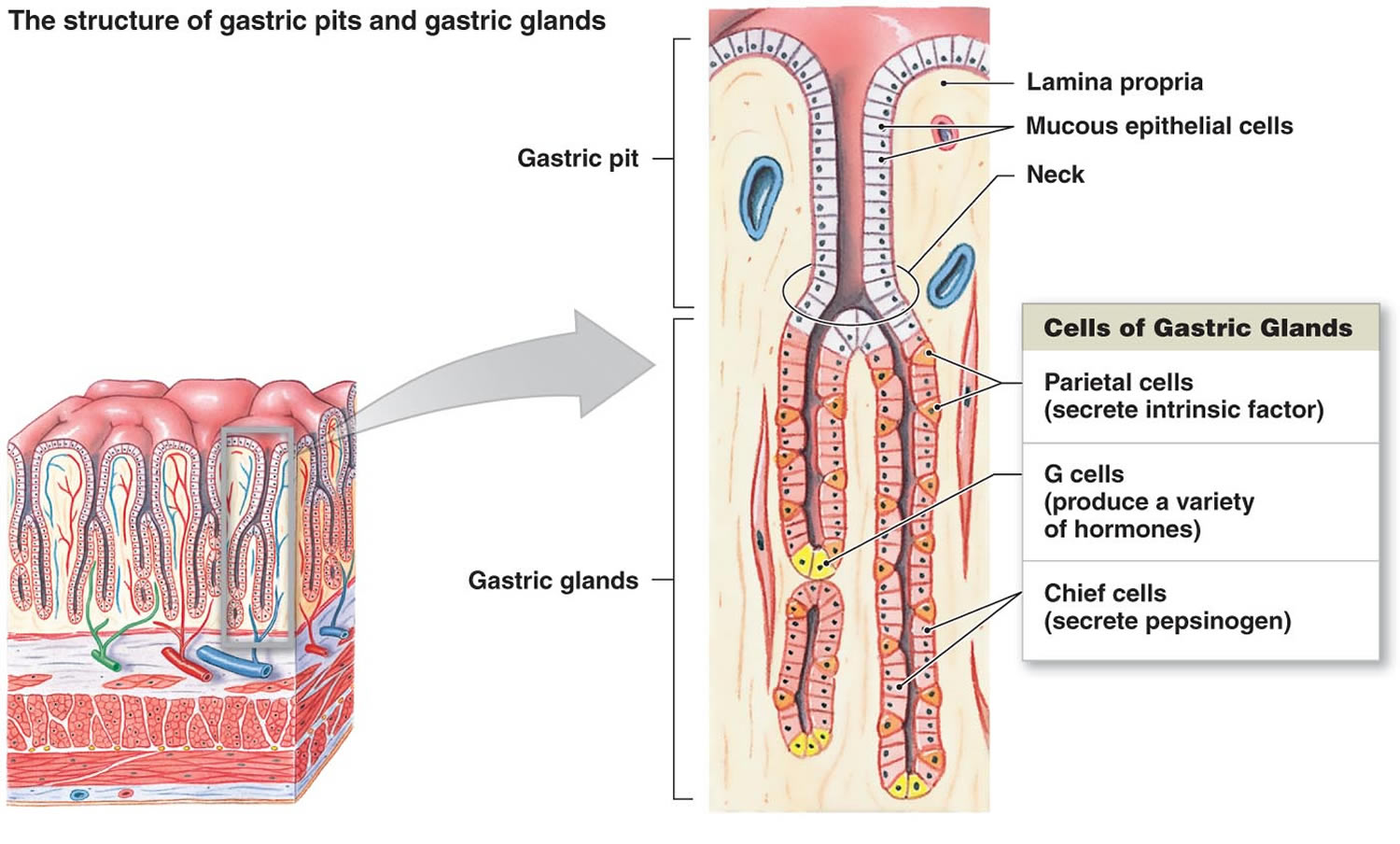 Lábjegyzet: A gyomor bélése. A gyomor mirigyei közé tartoznak a nyálkasejtek, a parietális sejtek és a fősejtek. A gyomor nyálkahártyáját gyomornyílások tarkítják, amelyek a gyomormirigyek nyílásai.
Lábjegyzet: A gyomor bélése. A gyomor mirigyei közé tartoznak a nyálkasejtek, a parietális sejtek és a fősejtek. A gyomor nyálkahártyáját gyomornyílások tarkítják, amelyek a gyomormirigyek nyílásai.
Mit csinál a pepszin?
A pepszinogénből (a pepszin inaktív formája) sósav jelenlétében képződő pepszin szinte mindenféle táplálékfehérjét polipeptidekké (kisebb fehérje vegyületekké) emészt. A pepszin a fehérjéket erős gyomorsavban emészti meg. A pepszin a tápláléknak a gyomor savas környezetében történő emésztésére van optimalizálva, és az első proteáz, amellyel a táplálékfehérjék az emésztőrendszerben találkoznak. A pepszin 37 °C és 42 °C közötti savas környezetben a legaktívabb 16).
A pepszin specifitását (azaz a peptidkötések pepszin általi hasításának valószínűségét) elsősorban a P1 és P1′ pozícióban lévő aminosavmaradékok befolyásolják, de a többi alhelyen lévő aminosavmaradékok is szerepet játszhatnak. Általában a pepszin előszeretettel hasít fenilalanin, leucin és metionin után, míg hisztidin, lizin, prolin és arginin után ritkán hasít 17). A P1′ pozícióban a tirozin, triptofán és fenilalanin aromás maradékokat részesíti előnyben. A prolin a P2, P2′ és P3′ pozícióban erősen kedvezőtlen, míg a hisztidin, lizin és arginin a P3 pozícióban kedvezőtlen. A P4 és P4′ pozícióknak csekély hatása van 18).
3. ábra. Pepszin funkció