 Open Access Article
Open Access Article This Open Access Article is licensed under a
This Open Access Article is licensed under a
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc és Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
First published on 27th March 2017
Polyethylene glycol (PEG) derivatives have been widely used in bio-related research. A PEG oligomerek (különböző molekulatömeggel) vagy a PEG alapú monomerek (különböző láncvégcsoportokkal) azonban valójában eltérő kémiai és fizikai tulajdonságokkal rendelkeznek, ami potenciális toxicitáshoz vezethet. Ebben a munkában egy sor PEG-származék (oligomerek és monomerek) citotoxicitását mértük emberi méhnyakráksejtek (HeLa) és egy egérből származó fibroblaszt sejtvonal (L929) mint modellsejtek felhasználásával. A legtöbb PEG oligomer mindkét sejttípusra biztonságos, kivéve a trietilénglikolt (TEG), amely nagy koncentrációban mérgező az L929 sejtekre. Másrészt a PEG-alapú monomerek, köztük a poli(etilénglikol)metiléter-akrilát (mPEGA) és a poli(etilénglikol)metiléter-metakrilát (mPEGMA) nyilvánvaló citotoxicitást mutattak. Ezt követően ezeket a toxikus PEG-származékokat tanulmányozták, hogy feltárják toxicitásuk különböző mechanizmusait. Ez a jelenlegi kutatás értékelte a PEG-származékok citotoxicitását, és rámutatott a “biztonságos” bioanyagok potenciális veszélyére, ami hasznos támpontot nyújthat az emberek számára a PEG-származékok jövőbeli orvosbiológiai kutatásokban való felhasználásához.
Bevezetés
A polietilénglikolt (PEG) széles körben alkalmazzák különböző orvosi területeken olyan kiváló tulajdonságai miatt, mint a kielégítő biztonság, biokompatibilitás, hidrofilitás stb. A PEG-et például kiváló nedvességmegtartó és kenési képessége miatt használják néhány, az Élelmiszer- és Gyógyszerügyi Hivatal által jóváhagyott hashajtószerben.1-3 Egy másik példa szerint a gyógyszerek/fehérjék PEG-gel történő módosítása (PEGilálás) hatékonyan javíthatja a gyógyszerek vízoldékonyságát és keringési felezési idejét,4,5 ami fokozott biztonságot és terápiás hatást eredményez. Valójában a PEGilálás az egyik legvonzóbb biotechnológiává válik, és hatalmas sikereket ér el az alapkutatásban és a piacon.6-11 Mára számos PEG-származékot kiváló kiindulási anyagként használtak számos új polimer anyag szintéziséhez bioalkalmazásokhoz.12 Például egy lineáris PEG-et difunkcionalizált PEG-ként (DF-PEG) módosították, amelyből gyorsan létrehozható egy érdekes öngyógyító hidrogél.13,14,14 Néhány PEG oligomert a szervetlen nanorészecskék felületének módosítására használtak a vízoldhatóság javítása és a szervetlen anyagok toxicitásának csökkentése érdekében15.-17 Néhány kereskedelmi forgalomban kapható PEG-alapú monomert, például poli(etilénglikol)metiléter-akrilátot (mPEGA) és poli(etilénglikol)metiléter-metakrilátot (mPEGMA) használtak elágazó polimerek előállítására későbbi fehérjekonjugáció, önszerveződés, gyógyszeradagolás stb. céljából.18-27
Bár a PEG-et általában szinte nem toxikusnak tekintik, a kutatók észrevettek néhány nem biztonságos problémát az alacsony molekulatömegű PEG esetében. Smyth és munkatársai a PEG oligomer (Mn ∼ 200) krónikus orális toxicitásáról számoltak be patkányokon,28,29 a káros eredményeket majmokon is megfigyelték,30 ami e “biztonságos” anyagok lehetséges biztonsági problémáira utal. Tekintettel tehát a PEG-származékok széleskörű felhasználására a kutatási területeken, e PEG-oligomerek és PEG-alapú monomerek szisztematikus citotoxicitási vizsgálata szükséges és fontos a biológiailag kapcsolódó területeken történő további alkalmazásukhoz (1. séma).
A jelen munkában néhány PEG oligomer (különböző molekulatömegű) és kereskedelmi forgalomban kapható PEG alapú monomerek (különböző láncvégcsoportokkal) citotoxicitását vizsgáltuk emberi méhnyakráksejtekre (HeLa) és egy egérből származó fibroblaszt sejtvonalra (L929). Megfigyelték a PEG-oligomerek molekulatömegfüggő citotoxicitását, és először tárták fel a PEG-oligomerek és a PEG-alapú monomerek eltérő citotoxicitási mechanizmusait. Ezek a PEG-származékok citotoxicitási információi értékes referenciák lehetnek az emberek számára, hogy a PEG-et kiindulási anyagként válasszák, és tisztítási útvonalakat tervezzenek biokompatibilis PEG-alapú anyagok előállításához további orvosbiológiai alkalmazásokhoz.
Anyagok és módszerek
2.1 Vegyszerek
Trietilénglikol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poli(etilénglikol)metiléter-akrilát 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), a poli(etilénglikol)metil-éter-metakrilát 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) és a poli(etilénglikol)metil-éter-metakrilát 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) további tisztítás nélkül közvetlenül használtuk.
A humán méhnyakráksejteket (HeLa) és egy egerekből származó fibroblaszt sejtvonalat (L929) az American type culture collection-től (ATCC) szereztük be. Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), foszfát pufferelt sóoldat (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), magzati szarvasmarha szérum (FBS, Gibco), Roswell Park Memorial Institute 1640 táptalaj (RPMI 1640 táptalaj, Gibco), penicillin-streptomicin oldat (Gibco), tripszin-EDTA (Gibco, 0.25%), 4-(3-(3-(2-(2-metoxi-4-nitrofenil)-2-(4-nitrofenil)-2H-tetrazol-3-ium-5-il)benzol-1,3-diszulfonát (CCK-8, Beyotime), 2,7-diklór-dihidrofluorescein-diacetát (DCFH-DA, Beyotime), oxidált glutation (GSSG, Beyotime), nikotinamid-adenin-dinukleotid-foszfát (NADPH, Beyotime), 5,5′-ditiobisz-(2-nitrobenzoesav) (DTNB, Beyotime), fluoreszcein-diacetát (FDA, Sigma) és propidium-jodid (PI, 94%, Sigma).
2.2. Sejtkultúra
A sejtkultúrát 37 °C-os inkubátorban tartottuk 5% CO2 mellett, a táptalajt egy-két naponta cseréltük a sejtek exponenciális növekedésének fenntartása érdekében. A HeLa sejtek méhnyakráksejtekből származtak, és 10% magzati szarvasmarha szérummal (FBS) és 1% penicillinnel és streptomicinnel kiegészített DMEM táptalajban tenyésztették őket. Az L929 sejtek egerekből származnak, és 10% magzati szarvasmarha szérummal (FBS) és 1% penicillinnel és streptomicinnel kiegészített RPMI 1640 táptalajban tenyésztették őket.
2.3. Citotoxicitási elemzés
Az eredményeket átlag ± standard eltérés (SD) formában mutattuk be, és a PEG-származékok 50%-os félmaximális gátló koncentrációjának (IC50) értékeit SPSS 15.0 segítségével számoltuk ki.
Egy korábbi munkánknak megfelelően32,33 a fluoreszcein-diacetát (FDA) és a propidium-jodid (PI) gyors és kényelmes kettős festési módszerrel megfigyelhető a sejtek életképessége. Az L929 sejteket 24 lyukú lemezbe vetettük ∼5 × 104 sejt/ml sűrűséggel. A kötődés után a sejteket PBS-szel mostuk, majd különböző koncentrációjú PEG-származékokkal tenyésztettük a táptalajban 24 órán keresztül, majd a táptalajt eltávolítottuk, a sejteket PBS-szel mostuk. Ezt követően PBS-FDA-PI kevert oldatot (FDA: 3 μg mL-1; PI: 3 μg mL-1) adtunk hozzá, majd a 24 lyukú lemezt 37 °C-on 15 percig inkubáltuk. Fluoreszcens mikroszkópot (Leica Germany) használtunk az élő és elhalt sejtek megfigyelésére 450-490 nm és 515-560 nm sávszűrős gerjesztő szűrők (I3 és N2.1) alatt (100 W-os higanylámpa).
Röviden, az L929 sejteket 24 lyukú lemezbe vetettük, és 0,5 mL táptalajban inkubáltuk különböző koncentrációjú TEG (A, A′) 1 órán keresztül (ábra. 1), az A1-A6 lyukakat a glutation teljes mennyiségének (GSH + GSSG), míg az A′1-A′6 lyukakat az oxidált glutation (GSSG) mennyiségének mérésére használtuk TEG jelenlétében. 1 óra elteltével a sejteket tripszin emésztéssel és centrifugálással (1000 rpm, 5 perc) gyűjtöttük össze. Ezután háromszoros térfogatú fehérjeeltávolító oldatot (50 mg mL-1) adtunk a zajos fehérjék eltávolításához. Háromszoros gyors fagyasztási-olvasztási ciklusok után folyékony nitrogénben és 37 °C-os vízfürdőben a szuszpenziót 5 percre hűtőszekrénybe (4 °C) helyeztük, majd centrifugálás (10 000 rpm, 10 perc) után a sejtek felülúszójának mintáit nyertük. Az A1-A6 lyukakból vett mintákat az összes glutation (GSH + GSSG) szintjének mérésére használtuk. NADPH oldatot (0,5 mg mL-1) adtunk az összes glutation GSH-vá történő redukciójához, majd 5,5′-ditiobisz-(2-nitrobenzoesav) (DTNB) segítségével oxidáltuk a GSH-t. A 405 nm-en megváltozott abszorbanciát mikrolemez olvasóval (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader) rögzítettük.35,36 Az A′1-A′6 kutakból származó mintákat az oxidált glutation (GSSG) szintjének mérésére használtuk. A GSH eltávolító oldat használatával csak GSSG maradt a mintaoldatban. A mintákat a fentiekkel megegyező módszerrel elemeztük a GSSG szintjének mérésére. A redukált glutation szintjének kiszámításához a teljes glutation mennyiségét és az oxidált glutation mennyiségét gyűjtöttük össze, míg kontrollként a tiszta táptalajban lévő sejtek GSH szintjét használtuk. Az eredményeket átlag ± SD-ben adtuk meg.
000 rpm, 10 perc) után a sejtek felülúszójának mintáit nyertük. Az A1-A6 lyukakból vett mintákat az összes glutation (GSH + GSSG) szintjének mérésére használtuk. NADPH oldatot (0,5 mg mL-1) adtunk az összes glutation GSH-vá történő redukciójához, majd 5,5′-ditiobisz-(2-nitrobenzoesav) (DTNB) segítségével oxidáltuk a GSH-t. A 405 nm-en megváltozott abszorbanciát mikrolemez olvasóval (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader) rögzítettük.35,36 Az A′1-A′6 kutakból származó mintákat az oxidált glutation (GSSG) szintjének mérésére használtuk. A GSH eltávolító oldat használatával csak GSSG maradt a mintaoldatban. A mintákat a fentiekkel megegyező módszerrel elemeztük a GSSG szintjének mérésére. A redukált glutation szintjének kiszámításához a teljes glutation mennyiségét és az oxidált glutation mennyiségét gyűjtöttük össze, míg kontrollként a tiszta táptalajban lévő sejtek GSH szintjét használtuk. Az eredményeket átlag ± SD-ben adtuk meg.
A B és B′ sorban lévő kutakat a GSH és a GSSG teljes mennyiségének vizsgálatára használtuk mPEGA-480 jelenlétében ugyanezzel az eljárással.
Eredmények és megbeszélés
3.1. A sejtek életképességének vizsgálata
A HeLa sejt (a rákos sejtek modellje) használata esetén (2A ábra) az összes PEG oligomer citotoxicitása alacsony koncentrációban (≤5 mg mL-1) elhanyagolható volt. A koncentráció növelésével (≥10 mg mL-1) a PEG-minták molekulatömegfüggő citotoxicitása volt megfigyelhető. A trietilénglikol (TEG) 10 mg mL-1 felett nyilvánvaló citotoxicitást mutatott (p < 0,05; ellentétben bármely más oligomerrel, ha a koncentráció 5 mg mL-1 felett van), és a TEG IC50 értékét a HeLa sejtekre 19,8 mg mL-1-ben számították ki. Eközben a többi PEG oligomer (Mn ∼ 400-4000) szintén csekély citotoxicitást mutatott.
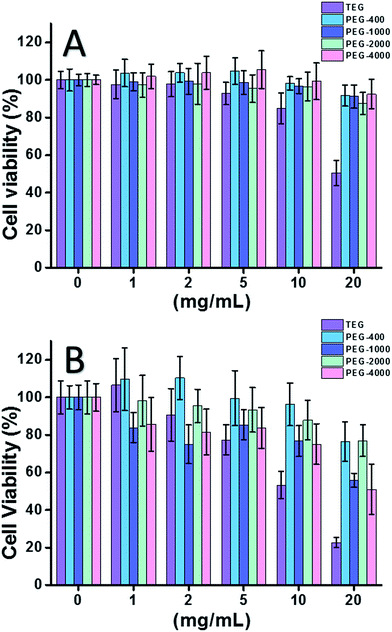
A PEG oligomerek citotoxicitását az L929 sejtekre (a normál sejtek modellje) is értékeltük (2B ábra). A sejtek életképessége a PEG-koncentráció növekedésével a várakozásoknak megfelelően csökkent. A TEG mellett néhány, a HeLa sejtekre biztonságos PEG oligomer (PEG-1000, PEG-4000) is kimutatható citotoxicitást mutatott, a TEG, PEG-1000 és PEG-4000 IC50 értéke 12,4, 22,5, illetve 20,0 mg ml-1 volt az L929 sejtekre, ami szintén a PEG oligomerek molekulatömegfüggő citotoxicitását jelzi.
A fenti eredmények azt sugallták, hogy a HeLa sejtek jobban tolerálják a PEG oligomereket, mint az L929 sejtek, a rákos sejtek kitartó vitalitása miatt, és a TEG sokkal nagyobb citotoxicitással rendelkezik, mint más, nagyobb molekulatömegű PEG oligomerek (p < 0,05; ellentétben bármely más oligomerrel, ha a koncentráció 5 mg mL-1 felett van). Megfigyelhető, hogy a jelenlegi kutatás kimutatta a PEG-1000 és PEG-4000 mérsékelt citotoxicitását az L929 sejtekre, és a PEG-400 és PEG-2000 szinte nem citotoxicitását, ami eltér attól az általános benyomástól, hogy a nagy molekulatömegű PEG-eknek biokompatibilisebbnek kell lenniük, mint alacsony molekulatömegű társaiknak. Bár a PEG citotoxicitásának oka még mindig nem tisztázott, a PEG-400 és a PEG-2000 jobb választásnak tűnik az emberek számára biokompatibilis anyagok szintéziséhez.
Az mPEGMA-500 vizsgálatakor mind a HeLa sejtek, mind az L929 sejtek sejtéletképessége csökkent az mPEGMA-500 koncentrációjának növelésével (3A ábra), és nem volt látható különbség a két sejttípus között. Az mPEGMA-500 IC50 értéke a HeLa sejtek esetében 4,7 mg mL-1, az L929 sejtek esetében pedig 5,3 mg mL-1 24 órás tenyésztés után, ami az mPEGMA-500 jelentősebb citotoxicitását jelzi, mint a fent említett PEG oligomerek, és arra utal, hogy a PEG-származékok láncvégcsoportjai döntő szerepet játszanak a toxicitásukban. Amikor az mPEGMA-950-et, egy másik PEG-alapú metakrilátot, amelynek láncvégcsoportja azonos, de molekulatömege nagyobb, ugyanezzel az eljárással vizsgáltuk (3B. ábra), az mPEGMA-950 sokkal kisebb citotoxicitást tapasztaltunk a HeLa sejtekre vagy az L929 sejtekre (p < 0,05; 2 mg mL-1 feletti koncentráció esetén), az mPEGMA-950 IC50 értékei 20,8 mg mL-1 a HeLa sejtekre és 21.7 mg mL-1 az L929 sejtekre 24 órás tenyésztés után, ami szintén a PEG-alapú metakrilát molekulatömegfüggő citotoxicitását bizonyítja.
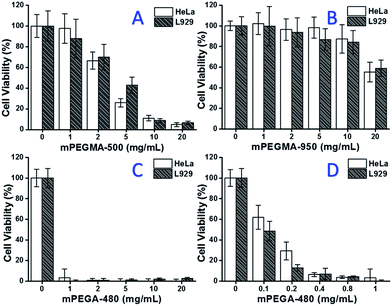
Vizsgáltuk továbbá a PEG-alapú akrilát mPEGA-480-t is. Bár az mPEGA-480 és az mPEGMA-500 közötti különbség csak egy metilcsoport a lánc végén, az mPEGA-480 akut citotoxicitást mutatott (3C ábra). A sejtek több mint 95%-a elvesztette életképességét még 1 mg mL-1 mPEGA-480 esetén is a táptalajban. Ezért további kísérleteket kell végezni alacsonyabb koncentrációkkal a citotoxicitás meghatározásához (3D ábra), és az mPEGA-480 IC50 értékét 0,2 mg mL-1 HeLa sejtekre és 0,1 mg mL-1 L929 sejtekre számítottuk ki 24 órás tenyésztés után.
A sejtéletképességi kísérletek megerősítették, hogy mind a láncvégcsoportok, mind a molekulatömeg fontos befolyásoló elemei a PEG-származékok citotoxicitásának, és a PEG-alapú monomerek sokkal feltűnőbb citotoxicitást mutattak a PEG-oligomerekhez képest.
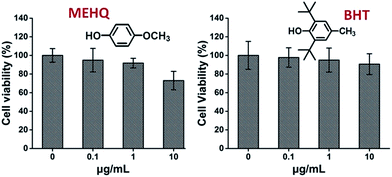
Eközben a PEG-alapú monomerekben lévő inhibitorok, a hidrokinon-metil-éter (MEHQ, 100 ppm a mPEGA-ban) és a butilált hidroxitoluol (BHT, 300 ppm a mPEGMA-ban) citotoxicitását is vizsgáltuk (4. ábra), és az L929 sejtek alacsony koncentrációjú inhibitorok (≤1 μg ml-1) esetén is magas életképességet (≥90%) mutattak. Az 1 mg mL-1 mPEGA-480-ban 0,1 μg mL-1 MEHQ, az 10 mg mL-1 mPEGA-500-ban pedig 3 μg mL-1 BHT található, míg az mPEG-480 és az mPEGMA-500 ezekben a koncentrációkban nyilvánvaló citotoxicitást mutatott. Úgy tűnik tehát, hogy a PEG-alapú monomerekben lévő nyomnyi mennyiségű inhibitorok elhanyagolható hatással vannak a monomerek citotoxicitására.
3.2. A sejtmorfológia megfigyelése
A PEG-származékok L929 sejtekre gyakorolt citotoxicitásának közvetlen értékelésére optikai mikroszkópos megfigyelést használtunk. A 20 mg mL-1 TEG-nek és 0,1 mg mL-1 mPEGA-nak 24 órán keresztül kitett L929 sejtek optikai képeit az 5A. és B. ábra mutatja.
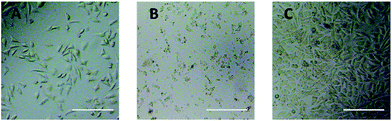
A 20 mg mL-1 TEG-vel történő 24 órás inkubáció után a sejtek megtartották a kontrollcsoporthoz (5A. ábra) hasonló morfológiát (5C. ábra, sejtek tiszta táptalajban), de a sejtek száma drámaian csökkent, ami a TEG magas koncentrációjú citotoxicitására utal, ami a sejtek elhalásához vezetett, majd leváltak a mikrolemez aljáról. Az 5B. ábra az L929 sejtek morfológiáját mutatta 0,1 mg mL-1 mPEGA-480-zal történő inkubáció után. Szinte minden sejt elvesztette normális morfológiáját, ami az mPEGA-480 akut citotoxicitására utal még ilyen alacsony koncentrációban is.
Kiegészítésképpen a sejteket fluoreszceinnel is megfestettük. Az FDA/PI kettős festés egy gyors, egyszerű és egyidejű eljárás az élő és elhalt sejtek megfigyelésére.43 Az FDA bejuthat a teljes sejtekbe és felhalmozódhat a sejtekben, ezért szükséges a teljes sejtmembrán, hogy megakadályozza a fluoreszcein kiszivárgását a sejtből. Ezzel szemben a PI nem tud áthatolni az ép sejtmembránon, de a sérült sejtmembránon áthaladva meg tudja festeni az elhalt sejtek sejtmagját. Amint a 6. ábra mutatja, a 20 mg mL-1 TEG-vel inkubált L929 sejtekben az FDA festés után kevesebb életképes sejt van (6b. ábra) a kontrollhoz képest (6a. ábra), és több elhalt sejt figyelhető meg a PI festés után (6b. ábra). Az mPEGA-480 akut citotoxicitása az FDA/PI kettős festési eljárás után is megfigyelhető volt, a sejtek 0,1 mg mL-1 mPEG-480-zal történő 24 órás inkubálása után nem lehetett zöld jelet azonosítani (6c. és c′′ ábra).
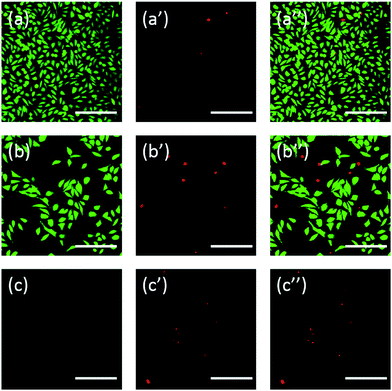
Mind az optikai, mind a fluoreszcens képek intuitív módon bizonyították az említett PEG-származékok citotoxicitását, ami tovább erősíti a CCK-8 vizsgálatokkal kapott következtetést. Megfigyelhető, hogy az mPEGA-480 toxikusabbnak tűnt az FDA/PI kettős festési próbával, ami annak tulajdonítható, hogy az FDA/PI kettős festés megkülönbözteti az élő/halott sejtmembrán teljességét, míg a CCK-8 próba a mitokondriumokban lévő dehidrogenáz aktivitását mutatja, ami arra utal, hogy az FDA/PI festés kiváló kiegészítője a CCK-8 próbának, hogy több részletet nyújtson a sejt állapotáról.
3.3 Mechanizmusvizsgálat
A sejtéletképességi kísérletek alapján kiszámítottuk és összegeztük a PEG-oligomerek és a PEG-alapú monomerek IC50 értékeit HeLa és L929 sejtekre 24 órás tenyésztés után (1. táblázat), ami arra utal, hogy a PEG-alapú monomerek sokkal toxikusabbak a sejtekre, mint a PEG-oligomerek, és az mPEGA rendelkezik a legnagyobb citotoxicitással. Ezért a ROS keletkezését és a GSH csökkenését a sejtekben, a citotoxicitás két fő mechanizmusát elemeztük, hogy megvizsgáljuk a citotoxicitás lehetséges okát.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa sejtek | 19.8 | 32.5 | 36.2 | 38.2 | 29.6 | 4.7 | 20.8 | 0.2 |
| L929 sejtek | 12.4 | 24.7 | 22.5 | 28.7 | 20.0 | 5.3 | 21.7 | 0.1 |
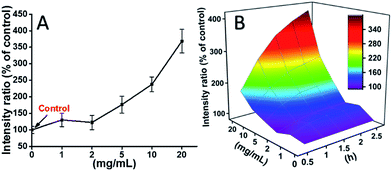
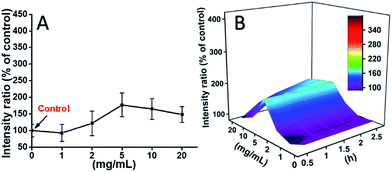
L929 sejteket inkubáltunk TEG-gel, és a ROS-szinteket különböző időpontokban (0, 0,5, 1,0, 1,5, 1,5, 2 óra) korábbi jelentéseinknek megfelelően detektáltuk, és a 7. ábrán látható. Példaként a ROS-szinteket különböző koncentrációjú TEG-gel történő 2 órás inkubációt követően a 7A. ábrán mutattuk be. Világosan látható, hogy a ROS-szintek alacsony TEG-koncentráció (≤2 mg mL-1) esetén stabilak maradtak, de jelentősen megnőttek, ha a TEG-koncentráció 2 mg mL-1-nél magasabb, ami összhangban van a 2B. ábrán látható sejtéletképességi kísérlet eredményével. Hasonlóképpen, a ROS-szint és a TEG-koncentráció függvényében a különböző időpontokban készült ábrákat megrajzoltuk és egyesítettük, hogy 3D-s térképet kapjunk (7B. ábra). A maximális ROS-szintet 20 mg mL-1 TEG-nél 2 óránál találtuk, a kontrollhoz (ROS-szint = 100) képest körülbelül 400%-kal megnövekedett ROS-szintet észleltünk, ami a legfényesebb fluoreszcencia-intenzitást eredményezte. Ezek az eredmények arra utalnak, hogy a ROS-termelés a TEG citotoxicitásának lehetséges mechanizmusa, és a TEG által indukált magas ROS-szint lehet a sejt apoptózisának fő oka.
A mPEGA-480 által 2 h után indukált ROS-szinteket is vizsgáltuk (8A ábra). A TEG-től eltérően az mPEGA nem okozott gyors ROS-növekedést a sejtekben, a kontrollhoz képest csak ∼170%-os ROS-növekedés volt a maximum. A 3D ROS-szint vs. mPEGA & idő (8B ábra) az mPEGA-480 által indukált ROS-szintet hullámként mutatta, és a csúcs mérsékelt mPEGA-koncentrációnál (5 mg mL-1) jelent meg, nem figyelhető meg jelentős ROS-termelés, ami arra utal, hogy a ROS-termelés csak részben járulhat hozzá az mPEGA-480 citotoxicitásához.
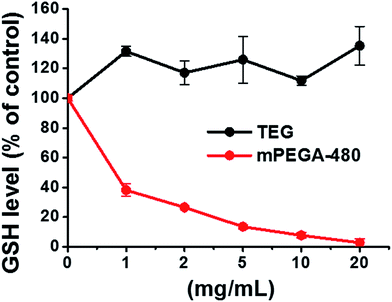
A GSH redukáló tiolcsoportja fontos antioxidációs forrás a szervezetekben. Az mPEGA-480 citotoxicitásának egyik lehetséges mechanizmusát a tiolcsoport és a vinilkötés közötti Michael-addíciós reakciónak tulajdonítják, ami az intracelluláris redox egyensúly felbomlásához és a sejt apoptózisához vezet. Korábbi kutatások szerint a tiol és az akrilát közötti Michael-addíció sokkal gyorsabb, mint a tiol és a metakrilát közötti,52 ami ésszerű oka lehet az mPEGA-480 és az mPEGMA-500 eltérő akut citotoxicitásának.
Következtetések
A PEG oligomerek és PEG alapú monomerek citotoxicitását HeLa sejtekre és L929 sejtekre először értékeltük. A PEG-oligomerek és a PEG-alapú monomerek koncentrációfüggő citotoxicitását megerősítették, és IC50-értékként mutatták be HeLa sejtekre és L929 sejtekre. A PEG-400, PEG-2000 a jelenlegi kutatásban szinte nem tűnik citotoxikusnak. A PEG-1000, PEG-4000 és mPEGMA-950 mérsékelt citotoxicitást mutatott, különösen magas koncentrációban. A TEG és az mPEGMA-500 jelentős citotoxicitást, az mPEGA-480 pedig akut citotoxicitást mutatott. Ezenkívül a sejttípusok is befolyásolják a citotoxicitási vizsgálat eredményeit, a HeLa sejtek az L929 sejteknél robusztusabban tűrik a PEG-származékokat. A PEG-származékok citotoxicitására vonatkozó eredmények előzetesek, de alapvetőek a jövőbeli orvosbiológiai alkalmazásuk szempontjából, további információkat kell vizsgálni a sejtek más PEG-származékokra adott válaszáról és viselkedéséről.
Köszönet
Ezt a kutatást a Kínai Nemzeti Tudományos Alapítvány támogatta (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein és G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan és J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper és M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang és D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun és H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris és R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese és G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley és J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill és W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner és W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann és A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li és Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao és Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng és Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad és S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan és D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li és Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao és Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo és H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka és H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya és C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander és P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang és K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao és K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh és E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu és W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter és C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter és C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice és S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki és M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei és X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li és Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang és J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller és C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode és S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown és A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta és S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han és W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel és H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake és L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang és P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones és J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79. CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim és I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka és M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213. CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu és H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li és J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim és M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate és H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch és W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser és P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer és D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
