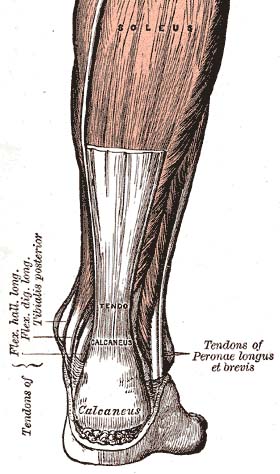

tendo
D013710
H3.03.00.0.00020
Anatómiai terminológia
Az ín vagy inak az izmot a csonthoz kötő rostos kötőszövet szívós sávja, amely az izmot köti össze, és képes ellenállni a feszültségnek.
Az inak a szalagokhoz hasonlóak; mindkettő kollagénből áll. A szalagok az egyik csontot a másikhoz kötik, míg az inak az izmot a csonthoz.
Szerkezet
Hisztológiailag az inak sűrű, szabályos kötőszövetből állnak. Az inak fő sejtes alkotóelemei a tenocitáknak nevezett specializált fibroblasztok. A tenociták szintetizálják az inak extracelluláris mátrixát, amely sűrűn tömött kollagénrostokban gazdag. A kollagénrostok egymással párhuzamosak és fascikulákba szerveződnek. Az egyes fasiculusokat az endotendineum köti össze, amely vékony kollagénfibrillákat és rugalmas rostokat tartalmazó, finom, laza kötőszövet. A fasiculák csoportjait az epitenon határolja, amely egy sűrű, szabálytalan kötőszövetből álló köpeny. Az egész inat egy fascia veszi körül. A fascia és az ínszövet közötti teret a paratenon, egy zsíros areoláris szövet tölti ki. A normális egészséges inakat a Sharpey-féle rostok rögzítik a csonthoz.
Extracelluláris mátrix
A normális inak száraz tömege, amely a teljes tömegük 30-45%-át teszi ki, a következőkből áll:
- 60-85% kollagén
- 60-80% kollagén I
- 0-10% kollagén III
- 2% kollagén IV
- kis mennyiségű V, VI és egyéb kollagénből
- 15-40% nem kollagén extracelluláris mátrix komponensek, beleértve:
- 3% porc oligomer mátrix fehérje,
- 1-2% elasztin,
- 1-5% proteoglikánok,
- 0.2% szervetlen komponensek, mint például réz, mangán és kalcium.
Míg az ínban lévő kollagén legnagyobb részét a kollagén I alkotja, számos kisebb kollagén van jelen, amelyek létfontosságú szerepet játszanak az ín megfelelő fejlődésében és működésében. Ezek közé tartozik a II. típusú kollagén a porcos zónákban, a III. típusú kollagén az érfalak retikulinrostjaiban, a IX. típusú kollagén, a IV. típusú kollagén a kapillárisok alapmembránjában, az V. típusú kollagén az érfalakban és az X. típusú kollagén a csonttal való határfelület közelében lévő mineralizált rostos porcban.
Ultrastruktúra és kollagénszintézis
A kollagénrostok makroaggregátumokká állnak össze. A sejtből történő szekréció után, a prokollagén N- és C-proteázok által hasítva, a tropokollagén molekulák spontán összeállnak oldhatatlan fibrillákká. Egy kollagénmolekula körülbelül 300 nm hosszú és 1-2 nm széles, a kialakuló fibrillák átmérője pedig 50-500 nm között lehet. Az inakban a fibrillák ezután tovább gyűlnek össze fascikulákká, amelyek körülbelül 10 mm hosszúak és 50-300 μm átmérőjűek, végül pedig 100-500 μm átmérőjű ínrostt alkotnak.
A kollagént az inakban proteoglikán (glikozaminoglikán csoportokhoz kötött fehérjéből álló vegyület, amely különösen a kötőszövetben van jelen) összetevők tartják össze, beleértve a decorint és – az ín összenyomott területein – az aggrecant, amelyek képesek meghatározott helyeken a kollagénfibrillumokhoz kötődni. A proteoglikánok összefonódnak a kollagénfibrillumokkal – glikozaminoglikán (GAG) oldalláncaik többszörös kölcsönhatásban vannak a fibrillumok felszínével -, ami azt mutatja, hogy a proteoglikánok szerkezetileg fontos szerepet játszanak a fibrillumok összekapcsolódásában. Az ín fő GAG komponensei a dermatán-szulfát és a kondroitin-szulfát, amelyek a kollagénnel társulva részt vesznek a fibrillumok összeállásának folyamatában az ín fejlődése során. A dermatán-szulfát feltehetően a fibrillumok közötti társulások kialakításáért felelős, míg a kondroitin-szulfát feltehetően inkább a fibrillumok közötti térfogat elfoglalásában vesz részt, hogy elkülönítve tartsa őket és segítsen ellenállni a deformációnak. A dekorin dermatán-szulfát oldalláncai oldatban aggregálódnak, és ez a viselkedés segítheti a kollagénfibrillumok összeállását. Amikor a dekorin molekulák kollagénfibrillumokhoz kötődnek, dermatán-szulfát láncaik meghosszabbodhatnak és társulhatnak a különálló fibrillumokhoz kötött dekorin más dermatán-szulfát láncaival, így interfibrilláris hidak jönnek létre, és végül a fibrillumok párhuzamos igazodását okozzák.
Tenociták
A tenociták termelik a kollagénmolekulákat, amelyek végtől végig és oldaltól oldalig aggregálódva kollagénfibrillumokat hoznak létre. A fibrillakötegek rostokba rendeződnek, amelyek közé szorosan beékelődnek a megnyúlt tenociták. Az ínban a kollagénhez kapcsolódó sejtfolyamatok háromdimenziós hálózata van. A sejtek réskapcsolatokon keresztül kommunikálnak egymással, és ez a jelátvitel biztosítja számukra azt a képességet, hogy érzékeljék a mechanikai terhelést és reagáljanak rá.
A kollagénrostokkal párhuzamosan futó vérerek láthatóak az endotendonban, esetenként elágazó keresztirányú anasztomózisokkal.
A belső íntömegről úgy gondolják, hogy nem tartalmaz idegrostokat, de az epitenon és a paratenon idegvégződéseket tartalmaz, míg az ín és az izom találkozásánál Golgi ínszervek vannak jelen.
Az ín hossza minden nagyobb csoportban és személyenként változik. Az ínhossz a gyakorlatban döntő tényező a tényleges és a potenciális izomméret tekintetében. Például, ha minden más releváns biológiai tényező egyenlő, egy rövidebb inakkal és hosszabb bicepszizommal rendelkező embernek nagyobb lesz a potenciális izomtömege, mint egy hosszabb inakkal és rövidebb izommal rendelkező embernek. A sikeres testépítők általában rövidebb inakkal rendelkeznek. Ezzel szemben az olyan sportokban, amelyekben a sportolóknak olyan cselekvésekben kell kiemelkedő teljesítményt nyújtaniuk, mint a futás vagy az ugrás, előnyös, ha az átlagosnál hosszabb az Achilles-ín és rövidebb a vádliizom.
Az inak hosszát genetikai hajlam határozza meg, és nem bizonyított, hogy a környezet hatására sem nő, sem csökken, ellentétben az izmokkal, amelyek trauma, használati egyensúlyhiány, valamint a regeneráció és nyújtás hiánya miatt rövidülhetnek. RÁT
Funkciók

Tradicionálisan az inakat olyan mechanizmusnak tekintették, amellyel az izmok a csontokhoz kapcsolódnak, valamint magának az izomzatnak, amely az erők továbbítására működik. Ez a kapcsolat teszi lehetővé, hogy az inak a mozgás során passzívan modulálják az erőket, és aktív munka nélkül további stabilitást biztosítanak. Az elmúlt két évtizedben azonban sok kutatás összpontosított egyes inak rugalmas tulajdonságaira és rugóként való működésükre. Nem minden ínnak kell ugyanazt a funkcionális szerepet betöltenie: egyesek elsősorban a végtagok pozicionálására szolgálnak, mint például az ujjak írás közben (pozicionáló inak), míg mások rugóként működnek, hogy hatékonyabbá tegyék a mozgást (energiatároló inak). Az energiatároló inak nagy hatékonysággal képesek energiát tárolni és visszanyerni. Például az emberi lépés során az Achilles-ín megnyúlik, miközben a bokaízület dorsalflexiót végez. A lépés utolsó szakaszában, amikor a lábfej plantárisan hajlít (a lábujjakat lefelé irányítja), a tárolt rugalmas energia felszabadul. Továbbá, mivel az ín megnyúlik, az izom kevesebb vagy akár semmilyen hosszváltozással sem képes működni, így az izom nagyobb erőt tud kifejteni.
Az ín mechanikai tulajdonságai a kollagénrostok átmérőjétől és orientációjától függenek. A kollagénfibrillák egymással párhuzamosak és szorosan egymás mellett helyezkednek el, de hullámszerű megjelenést mutatnak a néhány mikrométeres nagyságrendű síkbeli hullámzások, vagy krimpek miatt. Az inakban a kollagénrostok némi rugalmassággal rendelkeznek, mivel az aminosav-szekvencia bizonyos helyein nincsenek hidroxiprolin és prolin maradékok, ami lehetővé teszi más konformációk kialakulását, mint például a hármas spirálban lévő kanyarulatok vagy belső hurkok, és a krimpek kialakulását eredményezi. A kollagénfibrillumok krimpjei lehetővé teszik az inak bizonyos fokú rugalmasságát, valamint alacsony nyomómerevségét. Ezenkívül, mivel az ín többszálú, sok, egymástól részben független fibrillumokból és fascikulákból álló szerkezet, nem viselkedik egyetlen rúdként, és ez a tulajdonsága szintén hozzájárul a rugalmasságához.
Az inak proteoglikán komponensei szintén fontosak a mechanikai tulajdonságok szempontjából. Míg a kollagénfibrillumok lehetővé teszik, hogy az inak ellenálljanak a húzófeszültségnek, addig a proteoglikánok lehetővé teszik, hogy ellenálljanak a nyomófeszültségnek. Ezek a molekulák nagyon hidrofilek, ami azt jelenti, hogy nagy mennyiségű vizet képesek felvenni, és ezért nagy a duzzadási arányuk. Mivel nem kovalens módon kötődnek a fibrillumokhoz, reverzibilisen asszociálódhatnak és disszociálhatnak, így a fibrillumok közötti hidak megszakíthatók és újraalakíthatók. Ez a folyamat részt vehet abban, hogy a fibrillumok megnyúljanak és átmérőjük feszültség alatt csökkenjen. A proteoglikánok azonban az ín húzó tulajdonságaiban is szerepet játszhatnak. Az ín szerkezete gyakorlatilag egy szálkompozit anyag, amely hierarchikus szintek sorozatából épül fel. A hierarchia minden egyes szintjén a kollagénegységeket vagy kollagén keresztkötések, vagy proteoglikánok kötik össze, hogy a húzóterheléssel szemben rendkívül ellenálló szerkezetet hozzanak létre. Kimutatták, hogy a kollagénfibrillumok nyúlása és alakváltozása önmagában sokkal kisebb, mint a teljes ín teljes nyúlása és alakváltozása ugyanolyan mértékű terhelés alatt, ami azt bizonyítja, hogy a proteoglikánokban gazdag mátrixnak is deformáción kell átesnie, és a mátrix merevedése nagy igénybevétel esetén következik be. A nem kollagén tartalmú mátrix ezen deformációja az ínhierarchia minden szintjén bekövetkezik, és e mátrix szerveződésének és szerkezetének modulálásával elérhetők a különböző inak által megkövetelt különböző mechanikai tulajdonságok. Kimutatták, hogy az energiatároló inak jelentős mennyiségű csúszást használnak a rostok között az általuk igényelt magas alakváltozási jellemzők eléréséhez, míg a pozicionális inak nagyobb mértékben támaszkodnak a kollagénrostok és fibrillák közötti csúszásra. A legújabb adatok azonban arra utalnak, hogy az energiatároló inak olyan fasciculákat is tartalmazhatnak, amelyek csavart vagy spirális természetűek – ez az elrendezés rendkívül előnyös lenne az ilyen inakban szükséges rugószerű viselkedés biztosításához.
Mechanika
Az inak viszkoelasztikus szerkezetek, ami azt jelenti, hogy egyszerre mutatnak rugalmas és viszkózus viselkedést. Nyújtáskor az inak tipikus “lágyszöveti” viselkedést mutatnak. Az erő-nyújtás, vagy feszültség-nyúlás görbe egy nagyon alacsony merevségű régióval kezdődik, mivel a gyűrődéses szerkezet kiegyenesedik és a kollagénrostok összehangolódnak, ami negatív Poisson-számot sugall az ín rostjaiban. A közelmúltban in vivo (MRI segítségével) és ex vivo (különböző holttestek ínszövetének mechanikai vizsgálatával) végzett vizsgálatok kimutatták, hogy az egészséges inak erősen anizotrópok, és negatív Poisson-arányt (auxetikus) mutatnak bizonyos síkokban, amikor hosszuk mentén, azaz a normál mozgástartományon belül 2%-ig nyújtják őket. E “lábujj” régió után a szerkezet jelentősen merevebbé válik, és lineáris feszültség-nyúlás görbével rendelkezik, amíg el nem kezd tönkremenni. Az inak mechanikai tulajdonságai széles skálán mozognak, mivel az inak funkcionális követelményeihez igazodnak. Az energiatároló inak általában rugalmasabbak, illetve kevésbé merevek, így könnyebben tudnak energiát tárolni, míg a merevebb pozicionáló inak általában kicsit viszkoelasztikusabbak, illetve kevésbé rugalmasak, így finomabb mozgásszabályozást tudnak biztosítani. Egy tipikus energiatároló ín 12-15% körüli nyúlásnál és 100-150 MPa körüli feszültségnél tönkremegy, bár néhány ín ennél jelentősen jobban nyújtható, például a ló felszíni digitális hajlítóizma, amely galoppozáskor 20%-ot meghaladó mértékben nyúlik. A pozicionális inak már 6-8%-os nyúlásnál is tönkremehetnek, de a modulusuk 700-1000 MPa közötti tartományban lehet.
Más vizsgálatok kimutatták, hogy az inak a csontokhoz hasonlóan növekedési és átalakulási folyamatokkal reagálnak a mechanikai terhelés változásaira. Különösen egy vizsgálat mutatta ki, hogy patkányok Achilles-ínjának használaton kívül helyezése az inat alkotó kollagén rostkötegek átlagos vastagságának csökkenését eredményezte. Embereknél egy kísérlet, amelyben az embereket szimulált mikrogravitációs környezetnek tették ki, azt találta, hogy az ín merevsége jelentősen csökkent, még akkor is, amikor az alanyoknak pihentető gyakorlatokat kellett végezniük. Ezek a hatások az ágyhoz kötött betegek kezelésétől kezdve az űrhajósok számára hatékonyabb gyakorlatok tervezéséig terjedő területeket érinthetnek.
Gyógyulás
A láb inai rendkívül összetettek és bonyolultak. Ezért egy ínszakadás gyógyulási folyamata hosszú és fájdalmas. A legtöbb ember, aki a sérülést követő első 48 órán belül nem kap orvosi ellátást, súlyos duzzanattól, fájdalomtól és égő érzéstől szenved a sérülés helyén.
Azt hitték, hogy az inak nem képesek mátrix turnoverre, és a tenociták nem képesek a javításra. Azóta azonban kimutatták, hogy az ember élete során a tenociták az ínban aktívan szintetizálnak mátrixkomponenseket, valamint olyan enzimek, mint a mátrix metalloproteinázok (MMP-k) képesek lebontani a mátrixot. Az inak képesek gyógyulni és felépülni a sérülésekből egy olyan folyamat során, amelyet a tenociták és az őket körülvevő extracelluláris mátrix irányít.
Az íngyógyulás három fő szakasza a gyulladás, a javulás vagy proliferáció és a remodelling, amely tovább osztható konszolidációra és érésre. Ezek a szakaszok átfedhetik egymást. Az első szakaszban gyulladásos sejtek, például neutrofilek toborzódnak a sérülés helyére, az eritrocitákkal együtt. A monociták és makrofágok az első 24 órában toborzódnak, és a sérülés helyén a nekrotikus anyagok fagocitózisa következik be. A vazoaktív és kemotaktikus faktorok felszabadulása után megindul az angiogenezis és a tenociták proliferációja. A tenociták ezután beköltöznek a sérülés helyére, és elkezdik a kollagén III szintézisét. Néhány nap múlva megkezdődik a javítási vagy proliferációs szakasz. Ebben a szakaszban a tenociták nagy mennyiségű kollagén és proteoglikánok szintézisében vesznek részt a sérülés helyén, a GAG és a víz szintje pedig magas. Körülbelül hat hét elteltével kezdődik a remodelling szakasz. Ennek a szakasznak az első része a konszolidáció, amely a sérülést követő hat-tíz hétig tart. Ez alatt az idő alatt csökken a kollagén és a GAG-ok szintézise, és a sejtszerkezet is csökken, mivel a szövet a kollagén I fokozott termelődése következtében rostosabbá válik, és a fibrillák a mechanikai terhelés irányába igazodnak. A végső érési szakasz tíz hét után következik be, és ez idő alatt megnő a kollagénfibrillumok keresztkötése, ami miatt a szövet merevebbé válik. Fokozatosan, körülbelül egy év alatt a szövet rostosból hegszerűvé válik.
A mátrix metalloproteinázoknak (MMP-k) nagyon fontos szerepük van az ECM lebontásában és átalakításában az ínsérülést követő gyógyulási folyamat során. Bizonyos MMP-k, köztük az MMP-1, MMP-2, MMP-8, MMP-13 és MMP-14 kollagenáz aktivitással rendelkeznek, ami azt jelenti, hogy sok más enzimtől eltérően képesek a kollagén I fibrillumok lebontására. A kollagénfibrillumok MMP-1 általi lebontása és a denaturált kollagén jelenléte olyan tényezők, amelyek feltehetően az ín ECM gyengülését és egy újabb szakadás bekövetkezésének lehetőségének növekedését okozzák. Ismételt mechanikai terhelésre vagy sérülésre válaszul a tenocitákból citokinek szabadulhatnak fel, amelyek az MMP-k felszabadulását indukálhatják, ami az ECM degradációját okozza, és ismétlődő sérüléshez és krónikus tendinopátiához vezet.
Az inak javításában és regenerációjában számos más molekula is részt vesz. Öt olyan növekedési faktor van, amelyről kimutatták, hogy jelentősen felszabályozott és aktív az íngyógyulás során: az inzulinszerű növekedési faktor 1 (IGF-I), a vérlemezke-eredetű növekedési faktor (PDGF), a vaszkuláris endotél növekedési faktor (VEGF), a bázikus fibroblaszt növekedési faktor (bFGF) és a transzformáló növekedési faktor béta (TGF-β). Ezek a növekedési faktorok mind különböző szerepet játszanak a gyógyulási folyamat során. Az IGF-1 a gyulladás első szakaszában növeli a kollagén- és proteoglikántermelést, a PDGF pedig szintén jelen van a sérülést követő korai szakaszokban, és a DNS-szintézissel és az ínsejtek proliferációjával együtt elősegíti más növekedési faktorok szintézisét. A TGF-β három izoformája (TGF-β1, TGF-β2, TGF-β3) ismert, hogy szerepet játszik a sebgyógyulásban és a hegképződésben. A VEGF jól ismert arról, hogy elősegíti az angiogenezist és indukálja az endotélsejtek proliferációját és migrációját, és kimutatták, hogy a VEGF mRNS kifejeződik az ínsérülések helyén a kollagén I mRNS-sel együtt. A csontmorfogenetikus fehérjék (BMP-k) a TGF-β szupercsalád egyik alcsoportja, amelyek képesek csont- és porcképződést, valamint szöveti differenciálódást indukálni, és kifejezetten a BMP-12-ről kimutatták, hogy befolyásolja az ínszövet képződését és differenciálódását, valamint elősegíti a fibrogenezist.
Az aktivitás hatása a gyógyulásra
Az állatmodellekben kiterjedt vizsgálatokat végeztek az aktivitásszint formájában jelentkező mechanikai terhelés ínsérülésre és gyógyulásra gyakorolt hatásának vizsgálatára. Míg a kezdeti gyulladásos fázisban a nyújtás megzavarhatja a gyógyulást, kimutatták, hogy az inak kontrollált mozgása körülbelül egy héttel az akut sérülést követően elősegítheti a kollagén szintézisét a tenociták által, ami a gyógyult inak nagyobb szakítószilárdságához és átmérőjéhez, valamint kevesebb összenövéshez vezet, mint a mozdulatlanul tartott inak esetében. Krónikus ínsérülések esetén a mechanikai terhelésről szintén kimutatták, hogy serkenti a fibroblasztok proliferációját és a kollagénszintézist, valamint a kollagén újrarendeződését, amelyek mind elősegítik a javulást és a remodellinget. Annak az elméletnek a további alátámasztására, hogy a mozgás és az aktivitás segíti az inak gyógyulását, kimutatták, hogy az inak sérülés utáni immobilizálása gyakran negatív hatással van a gyógyulásra. Nyulakban az immobilizált kollagénfaszikulumok csökkent szakítószilárdságot mutattak, és az immobilizáció az inakban lévő víz, proteoglikánok és kollagén keresztkötések kisebb mennyiségét is eredményezi.
A tenociták mechanikai erőre adott válaszának okaként több mechanotranszdukciós mechanizmust javasoltak, amelyek lehetővé teszik, hogy megváltoztassák génexpressziójukat, fehérjeszintézisüket és sejtfenotípusukat, és végül az ín szerkezetében változásokat okozzanak. Az egyik fő tényező az extracelluláris mátrix mechanikai deformációja, amely hatással lehet az aktin citoszkeletonra, és ezáltal a sejtek alakjára, mozgékonyságára és működésére. A mechanikai erőket a fókuszos adhéziós helyek, az integrinek és a sejt-sejt csomópontok közvetíthetik. Az aktin citoszkeleton változásai aktiválhatják az integrineket, amelyek a sejt és a mátrix közötti “kívülről befelé” és “belülről kifelé” irányuló jelátvitelt közvetítik. A G-fehérjék, amelyek intracelluláris jelkaszkádokat indukálnak, szintén fontosak lehetnek, és az ioncsatornák a nyújtás hatására aktiválódnak, hogy ionokat, például kalciumot, nátriumot vagy káliumot engedjenek be a sejtbe.
Társadalom és kultúra
A zsineget az iparosodás előtti korszakokban széles körben használták, mint szívós, tartós rostot. Néhány konkrét felhasználási mód közé tartozik az inak használata fonalként a varráshoz, tollak rögzítése nyilakhoz (lásd fletch), szerszámok pengéinek rögzítése a szárakhoz stb. A túlélési útmutatók is ajánlják, mint olyan anyagot, amelyből erős zsinórt lehet készíteni olyan tárgyakhoz, mint a csapdák vagy élő szerkezetek. Az ínt különleges módon kell kezelni ahhoz, hogy ezekre a célokra használható legyen. Az inuitok és más cirkumpoláris népek az inakat használták egyedüli zsinegként minden háztartási célra, mivel ökológiai élőhelyükön nem állt rendelkezésre más megfelelő rostforrás. Az egyes inak rugalmas tulajdonságait az eurázsiai sztyeppei nomádok és az amerikai őslakosok által kedvelt összetett, visszahajló íjakban is felhasználták. Az első kőhajító tüzérség szintén az inak rugalmas tulajdonságait használta.
Az inak három okból is kiváló zsinóranyag: Rendkívül erős, természetes ragasztót tartalmaz, és száradás közben zsugorodik, így nincs szükség csomókra.
Kulináris felhasználás
Az inat (különösen a marhahús inát) egyes ázsiai konyhákban ételként használják (gyakran a yum cha vagy dim sum éttermekben szolgálják fel). Az egyik népszerű étel a suan bao niu jin, amelyben az inat fokhagymával pácolják. Néha a vietnami tésztaételben is megtalálható phở.
Klinikai jelentősége
Sérülés
Az inak sokféle sérülésnek vannak kitéve. A tendinopátiáknak vagy a túlterhelés miatti ínsérüléseknek különböző formái vannak. Az ilyen típusú sérülések általában az inak gyulladásához és degenerációjához vagy gyengüléséhez vezetnek, ami végül ínszakadáshoz vezethet. A tendinopátiákat számos, az inak extracelluláris mátrixával (ECM) kapcsolatos tényező okozhatja, és osztályozásuk nehézkes volt, mivel tüneteik és szövettani jellemzőik gyakran hasonlóak.
A tendinopátia első kategóriája a paratenonitis, amely az ín és az ínhüvely között elhelyezkedő paratenon vagy paratendinus lemez gyulladását jelenti. A tendinózis az ín nem gyulladásos, sejtszintű sérülésére utal. A károsodást az ín kollagénjének, sejtjeinek és érrendszeri összetevőinek károsodása okozza, és ismert, hogy szakadáshoz vezet. A spontán szakadáson átesett inak megfigyelései olyan kollagénfibrillumok jelenlétét mutatták, amelyek nem a megfelelő párhuzamos orientációban vannak, vagy nem egyenletes hosszúságúak vagy átmérőjűek, valamint lekerekített tenociták, egyéb sejtanomáliák és erek benövése figyelhető meg. A tendinózis más, szakadáshoz nem vezető formái szintén a kollagénfibrillumok degenerációját, dezorientáltságát és elvékonyodását mutatták, valamint a fibrillumok közötti glikozaminoglikánok mennyiségének növekedését. A harmadik a tendinózissal járó paratenonitis, amelyben a paratenon gyulladás és az ín degeneráció kombinációja egyaránt jelen van. Az utolsó az íngyulladás, amely az ín gyulladásával járó degenerációra utal, valamint az érszakadásra.
A tendinopátiákat számos belső tényező okozhatja, beleértve az életkort, a testsúlyt és a táplálkozást. Az extrinsic tényezők gyakran a sporttal kapcsolatosak, és magukban foglalják a túlzott erőket vagy terhelést, a rossz edzési technikákat és a környezeti körülményeket.
Egyéb állatok

Egyes élőlényekben, nevezetesen a madarak és az ornithischia dinoszauruszok esetében az ín egyes részei megcsontosodhatnak. E folyamat során az oszteociták beszivárognak az ínba, és csontot raknak le, mint a szezámcsontban, például a térdkalácsban. A madaraknál az íncsontosodás elsősorban a hátsó végtagban történik, míg az ornithischian dinoszauruszoknál a megcsontosodott axiális izom inak a farok ideg- és vértüskéi mentén rácshálót alkotnak, feltehetően támaszként.
Lásd még
| A Wikimédia Commons az inak témakörhöz kapcsolódó médiaállományokat tartalmaz. |
- Aponeurosis
- Az ínhüvely
- Chordae tendineae
- Az emberi test izmainak listája
- Az ínhüvely
- ^ Dorlands orvosi szótár, 602. oldal
- ^ Caldini, E. G.; Caldini, N.; De-Pasquale, V.; Strocchi, R.; Guizzardi, S.; Ruggeri, A.; Montes, G. S. (1990). “A rugalmas rendszer rostjainak eloszlása a patkány farokínban és a hozzá tartozó hüvelyekben”. Cells Tissues Organs. 139 (4): 341-348. doi:10.1159/000147022. PMID 1706129.
- ^ Grant, T. M.; Thompson, M. S.; Urban, J.; Yu, J. (2013). “A rugalmas rostok széles körben eloszlanak az ínban és erősen lokalizálódnak a tenociták körül”. Journal of Anatomy. 222 (6): 573-579. doi:10.1111/joa.12048. PMC 3666236. PMID 23587025.
- ^ Dorlands Medical Dictionary 2012. 1382. oldal
- ^ a b c Jozsa, L., and Kannus, P., Human Tendons: Anatomy, Physiology, and Pathology. Human Kinetics: Champaign, IL, 1997.
- ^ Lin, T. W.; Cardenas, L.; Soslowsky, L. J. (2004). “Az inak sérülésének és javításának biomechanikája”. Journal of Biomechanics. 37 (6): 865-877. doi:10.1016/j.jbiomech.2003.11.005. PMID 15111074.
- ^ Kjær, Michael (2004. április). “Az extracelluláris mátrix szerepe az ín és a vázizomzat mechanikai terheléshez való alkalmazkodásában”. Physiological Reviews. 84 (2): 649-698. doi:10.1152/physrev.00031.2003. ISSN 0031-9333. PMID 15044685.
- ^ Taye, Nandaraj; Karoulias, Stylianos Z.; Hubmacher, Dirk (2020. január). “A “másik” 15-40%: A nem kollagénes extracelluláris mátrix fehérjék és a minor kollagének szerepe az ínban”. Journal of Orthopaedic Research. 38 (1): 23-35. doi:10.1002/jor.24440. ISSN 0736-0266. PMC 6917864. PMID 31410892.
- ^ Fukuta, S.; Oyama, M.; Kavalkovich, K.; Fu, F. H.; Niyibizi, C. (1998). “A II, IX és X típusú kollagének azonosítása a szarvasmarha achilles ín behelyeződési helyén”. Matrix Biology. 17 (1): 65-73. doi:10.1016/S0945-053X(98)90125-1. PMID 9628253.
- ^ Fratzl, P. (2009). “Cellulóz és kollagén: a rostoktól a szövetekig”. Current Opinion in Colloid & Interface Science. 8 (1): 32-39. doi:10.1016/S1359-0294(03)00011-6.
- ^ Zhang, G. E., Y.; Chervoneva, I.; Robinson, P. S.; Beason, D. P.; Carine, E. T.; Soslowsky, L. J.; Iozzo, R. V.; Birk, D. E. (2006). “Decorin regulates assembly of collagen fibrils and acquisition of biomechanical properties during tendon development”. Journal of Cellular Biochemistry. 98 (6): 1436-1449. doi:10.1002/jcb.20776. PMID 16518859. S2CID 39384363.CS1 maint: multiple names: authors list (link)
- ^ Raspanti, M.; Congiu, T.; Guizzardi, S. (2002). “Structural Aspects of the Extracellular Matrix of the Tendon : An Atomic Force and Scanning Electron Microscopy Study”. Archives of Histology and Cytology. 65 (1): 37-43. doi:10.1679/aohc.65.37. PMID 12002609.
- ^ Scott, J. E. O., C. R.; Hughes, E. W. (1981). “Proteoglikán-kollagén elrendeződések a fejlődő patkány farokínban. Egy elektronmikroszkópos és biokémiai vizsgálat”. Biochemical Journal. 195 (3): 573-581. doi:10.1042/bj1950573. PMC 1162928. PMID 6459082.CS1 maint: multiple names: authors list (link)
- ^ Scott, J. E. (2003). “Az inak, porcok stb. extracelluláris mátrix ‘alakmoduljainak’ rugalmassága. Egy csúszó proteoglikán-filamentum modell”. Journal of Physiology. 553 (2): 335-343. doi:10.1113/jphysiol.2003.050179. PMC 2343561. PMID 12923209.
- ^ McNeilly, C. M.; Banes, A. J.; Benjamin, M.; Ralphs, J. R. (1996). “Az in vivo ínsejtek réskapcsolatokkal összekapcsolt sejtfolyamatok háromdimenziós hálózatát alkotják”. Journal of Anatomy. 189 (Pt 3): 593-600. PMC 1167702. PMID 8982835.
- ^ “A rövid Achilles-ín lehet a sportolók Achilles-sarka”. Retrieved 2007-10-26.
- ^ Young, Michael. “A Review on Postural Realignment and its Muscular and Neural Components” (PDF).
- ^ Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013). A nem-kollagén mátrix szerepe az inak működésében. Int J ExpPathol. 94;4: 248-59.
- ^ Hulmes, D. J. S. S. (2002). “Kollagénmolekulák, fibrillumok és szuprafibrilláris struktúrák felépítése”. Journal of Structural Biology. 137 (1-2): 2-10. doi:10.1006/jsbi.2002.4450. PMID 12064927.
- ^ Silver, F. H.; Freeman, J. W.; Seehra, G. P. (2003). “Kollagén önszerveződés és az inak mechanikai tulajdonságainak alakulása”. Journal of Biomechanics. 36 (10): 1529-1553. doi:10.1016/S0021-9290(03)00135-0. PMID 14499302.
- ^ Ker, R. F. F. (2002). “Az inak alkalmazkodó fáradási minőségének következményei az inak felépítésére, javítására és működésére”. Comparative Biochemistry and Physiology A. 133 (4): 987-1000. doi:10.1016/S1095-6433(02)00171-X. PMID 12485688.
- ^ Cribb, A. M.; Scott, J.E. (1995). In Tendon response to tensile-stress – an ultrastructural investigation of collagen – proteoglycan interactions in stressed tendon,1995; Cambridge Univ Press.pp 423-428.
- ^ Screen H.R., Lee D.A., Bader D.L., Shelton J.C. (2004). “Az ínfaszikulumok hierarchikus szerkezetének mikromechanikai tulajdonságokra gyakorolt hatásának vizsgálata”. Proc Inst Mech Eng H. 218 (2): 109-119. doi:10.1243/095441104322984004. doi:10.1243/095441104322984004. PMID 15116898. S2CID 46256718.CS1 maint: multiple names: authors list (link)
- ^ Puxkandl, R.; Zizak, I.; Paris, O.; Keckes, J.; Tesch, W.; Bernstorff, S.; Purslow, P.; Fratzl, P. (2002). “A kollagén viszkoelasztikus tulajdonságai: szinkrotron sugárzási vizsgálatok és szerkezeti modell”. Philosophical Transactions of the Royal Society B. 357 (1418): 191-197. doi:10.1098/rstb.2001.1033. doi:10.1098/rstb.2001.1033. PMC 1692933. PMID 11911776.
- ^ Gupta H.S., Seto J., Krauss S., Boesecke P.& Screen H.R.C. (2010). Az ínkollagén viszkoelasztikus deformációs mechanizmusainak in situ többszintű elemzése. J. Struct. Biol. 169(2):183-191.
- ^ Thorpe C.T; Udeze C.P; Birch H.L.; Clegg P.D.; Screen H.R.C. (2012). “Az inak mechanikai tulajdonságainak specializálódása az ínszövetek közötti különbségekből ered”. Journal of the Royal Society Interface. 9 (76): 3108-3117. doi:10.1098/rsif.2012.0362. PMC 3479922. PMID 22764132.
- ^ Thorpe C.T.; Klemt C; Riley G.P.; Birch H.L.; Clegg P.D.; Screen H.R.C. (2013). “Az energiatároló inak spirális alszerkezetei a hatékony energiatárolás és -visszatáplálás lehetséges mechanizmusát biztosítják”. Acta Biomater. 9 (8): 7948-56. doi:10.1016/j.actbio.2013.05.004. PMID 23669621.
- ^ Gatt R, Vella Wood M, Gatt A, Zarb F, Formosa C, Azzopardi KM, Casha A, Agius TP, Schembri-Wismayer P, Attard L, Chockalingam N, Grima JN (2015). “Negatív Poisson-számok az inakban: Egy váratlan mechanikai válasz”. Acta Biomater. 24: 201-208. doi:10.1016/j.actbio.2015.06.018. PMID 26102335.
- ^ Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003). Equine Vet J. |volume=35 |issue=3 |pages=314-8. Are the material properties and matrix composition of equine flexor and extensor tendons determined by their functions?
- ^ ScreenH.R.C., Tanner, K.E. (2012). Szerkezet & Biológiai kompozitok biomechanikája. In: Encyclopaedia of Composites 2nd Ed. Nicolais & Borzacchiello.Pub. John Wiley & Sons, Inc. ISBN 978-0-470-12828-2 (2928-39. oldal)
- ^ Nakagawa, Y. (1989). “A használaton kívüliség hatása az Achilles-ín ultrastruktúrájára patkányokban”. European Journal of Applied Physiology. 59 (3): 239-242. doi:10.1007/bf02386194. PMID 2583169. S2CID 20626078.
- ^ Reeves, N. D. (2005). “A 90 napos szimulált mikrogravitáció hatása az emberi inak mechanikai tulajdonságaira és a nyugalmi ellenintézkedések hatása”. Journal of Applied Physiology. 98 (6): 2278-2286. doi:10.1152/japplphysiol.01266.2004. hdl:11379/25397. PMID 15705722.
- ^ a b Riley, G. (2004). “A tendinopátia patogenezise. A molecular perspective” (PDF). Rheumatology. 43 (2): 131-142. doi:10.1093/rheumatology/keg448. PMID 12867575.
- ^ a b c d Sharma, P. M., N. (2006). “Az ínsérülés biológiája: gyógyulás, modellezés és átalakulás”. Journal of Musculoskeletal and Neuronal Interactions. 6 (2): 181-190. PMID 16849830.CS1 maint: multiple names: authors list (link)
- ^ a b c d Sharma, P.; Maffulli, N. (2005). “Íneksérülés és tendinopátia: Gyógyulás és javítás”. Journal of Bone and Joint Surgery. Amerikai kötet. 87A (1): 187-202. doi:10.2106/JBJS.D.01850. PMID 15634833. S2CID 1111422.
- ^ a b c c d e f Wang, J. H. C. C. (2006). “Az ín mechanobiológiája”. Journal of Biomechanics. 39 (9): 1563-1582. doi:10.1016/j.jbiomech.2005.05.011. PMID 16000201.
- ^ Riley, G. P.; Curry, V.; DeGroot, J.; van El, B.; Verzijl, N.; Hazleman, B. L.; Bank, R. A. (2002). “Mátrix metalloproteináz aktivitások és kapcsolatuk a kollagén remodellinggel az ín patológiájában”. Matrix Biology. 21 (2): 185-195. doi:10.1016/S0945-053X(01)00196-2. PMID 11852234.
- ^ Moulin, V.; Tam, B. Y. Y.; Castilloux, G.; Auger, F. A.; O’Connor-McCourt, M. D.; Philip, A.; Germain, L. (2001). “A magzati és felnőtt emberi bőr fibroblasztok sajátos különbségeket mutatnak a kontraktilis kapacitásban”. Journal of Cellular Physiology. 188 (2): 211-222. doi:10.1002/jcp.1110. PMID 11424088. S2CID 22026692.
- ^ Boyer, M. I. W., J. T.; Lou, J.; Manske, P. R.; Gelberman, R. H.; Cai, S. R. (2001). “A vaszkuláris endoteliális növekedési faktor mRNS expressziójának mennyiségi változása a korai hajlító ín gyógyulása során: vizsgálat egy kutyamodellben”. Journal of Orthopaedic Research. 19 (5): 869-872. doi:10.1016/S0736-0266(01)00017-1. PMID 11562135. S2CID 20903366.CS1 maint: multiple names: authors list (link)
- ^ Astrom, M.; Rausing, A. (1995). “Chronic Achilles Tendinopathia – A sebészeti és szövettani leletek áttekintése”. Klinikai ortopédia és kapcsolódó kutatások. 316 (316): 151-164. doi:10.1097/00003086-199507000-00021. PMID 7634699. S2CID 25486134.
- ^ Berge, James C. Vanden; Storer, Robert W. (1995). “Intratendinus csontosodás madaraknál: A review”. Journal of Morphology. 226 (1): 47-77. doi:10.1002/jmor.1052260105. PMID 29865323. S2CID 46926646.
- ^ Organ, Chris L. (2006). “Az ornithopoda dinoszauruszok csontosodott inainak biomechanikája”. Paleobiology. 32 (4): 652-665. doi:10.1666/05039.1. S2CID 86568665.
