La forma lunga comunemente usata della tavola periodica è progettata per enfatizzare le configurazioni degli elettroni. Poiché sono gli elettroni più esterni (di valenza) che sono principalmente coinvolti nelle interazioni chimiche tra gli atomi, l’ultimo elettrone aggiunto ad un atomo nel processo di costruzione è di gran lunga più interessante per un chimico che il primo. Quest’ultimo elettrone è chiamato l’elettrone distintivo perché distingue un atomo da quello immediatamente precedente nella tavola periodica. Il tipo di sottoguscio (s, p, d, f) in cui è collocato l’elettrone distintivo è molto legato al comportamento chimico di un elemento e dà origine alla classificazione mostrata dal codice colore sulla tavola periodica che vediamo qui. Gli elementi rappresentativi sono quelli in cui l’elettrone distintivo entrare ans o p subshell. La maggior parte degli elementi la cui chimica e valenza abbiamo discusso finora rientrano in questa categoria. Molte delle proprietà chimiche degli elementi rappresentativi possono essere spiegate sulla base dei diagrammi di Lewis. Cioè, le valenze degli elementi rappresentativi possono essere previste sulla base del numero di elettroni di valenza che hanno, o dal numero di elettroni che dovrebbero essere aggiunti per raggiungere la stessa configurazione elettronica di un atomo di un gas nobile. Per gli elementi rappresentativi il numero di elettroni di valenza è uguale al numero del gruppo periodico, e il numero necessario per corrispondere alla configurazione del gas nobile successivo è 8 meno il numero del gruppo. Questo concorda con le regole di valenza derivate dalla tavola periodica, e risulta in formule per i cloruri della prima dozzina di elementi che mostrano la variazione periodica di valenza.
| Elemento | Peso atomico | Composti di idrogeno | Composti di ossigeno | Composti di cloro |
|---|---|---|---|---|
| Idrogeno | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nessuno formato | Nessuno formato | Nessuno formato |
| Litio | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbonio | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogeno | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Ossigeno | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluoro | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nessuno formato | Nessuno formato | Nessuno formato |
| Sodio | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesio | 24.31 | MgH2 | MgO | MgCl2 |
Le prime tre righe orizzontali o periodi nella tavola periodica moderna consistono interamente di elementi rappresentativi. Nel primo periodo gli elettroni distintivi per H e He sono nel sottoguscio 1s. Nel secondo periodo Li e Be hanno elettroni distintivi nel sottoguscio 2s, e gli elettroni vengono aggiunti al sottoguscio 2p negli atomi da B a Ne. Nel terzo periodo il sottoguscio 3s si sta riempiendo per Na e Mg, e quindi Al, Si, P, S, Cl e Ar. Come regola generale, nel caso degli elementi rappresentativi, l’elettrone distintivo sarà in un sottoguscio ns o np. Il valore di n, il numero quantico principale per l’elettrone distintivo, può essere rapidamente determinato contando dall’alto della tavola periodica. Per esempio, lo iodio è un elemento rappresentativo del quinto periodo. Quindi l’elettrone distintivo deve occupare o il sottoguscio 5s o 5p. Dato che I si trova sul lato destro della tavola, 5p è la scelta corretta.
Quando il numero quantico principale è tre o più, sono possibili anche sottogusci di tipo d. Gli elementi di transizione o metalli di transizione sono quegli elementi il cui elettrone distintivo si trova in un orbitale d. I primi esempi di metalli di transizione (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) si trovano nel quarto periodo anche se l’elettrone distintivo in ogni caso è un elettrone 3d e appartiene al terzo guscio. Questo iato risulta, come abbiamo già visto, perché il 4s è di energia inferiore al 3d. L’orbitale 4s inizia così a riempirsi, iniziando il quarto periodo prima che uno qualsiasi degli orbitali 3d possa essere occupato.
La figura \(\PageIndex{1}) confronta le distribuzioni di probabilità di un elettrone 4s e un elettrone 3d in un atomo V. Sebbene la nuvola di elettroni 4s sia in media più lontana dal nucleo rispetto alla nuvola 3d, una piccola porzione della densità di elettroni 4s si trova molto vicina al nucleo dove è appena schermata dalla carica nucleare totale di +23. È la forza attrattiva molto forte di questa piccola frazione della densità totale di elettroni 4s che abbassa l’energia dell’elettrone 4s sotto quella del 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Il fatto che la nuvola di elettroni 4s sia più estesa di quella 3d ha un’importante influenza sulla chimica degli elementi di transizione. Quando un atomo come V (Figura \PageIndex{1}}) interagisce con un altro atomo, sono gli elettroni 4s che si estendono più lontano dal nucleo a contattare per primi l’altro atomo. Così gli elettroni 4s sono spesso più significativi dei 3d nel determinare la valenza e le formule dei composti. Gli elettroni 3d sono “sepolti” sotto le superfici degli atomi dei metalli di transizione. Aggiungere un elettrone 3d in più ha molto meno effetto sulle loro proprietà chimiche rispetto all’aggiunta di un elettrone 3s o 3p nel caso degli elementi rappresentativi. Quindi c’è una transizione lenta ma costante nelle proprietà da un elemento di transizione all’altro. Si noti, per esempio, che tranne Sc, tutti i metalli di transizione formano cloruri, MCl2, dove il metallo ha una valenza di 2; esempi sono TiCl2, VCl2, CrCl2, e così via. Questo può essere visto nella tabella che si trova all’inizio di questa pagina. La valenza di 2 corrisponde ai due elettroni di valenza 4s.
Ognuno dei metalli di transizione esibisce anche altre valenze in cui sono coinvolti anche uno o più degli elettroni 3d. Per esempio, in alcuni composti V (vanadio) ha una valenza di 2 (VO, VCl2) in altri ha una valenza di 3 (V2O3, VCl3), in altri ancora ha una valenza di 4 (VO2, VCl4), e in almeno un caso (V2O5) ha una valenza di 5. La chimica dei metalli di transizione è più complicata e una più ampia varietà di formule per i composti dei metalli di transizione è possibile a causa di questa valenza variabile. In alcuni casi gli elettroni nei sottogusci d agiscono come elettroni di valenza, mentre in altri casi no. Anche se le nuvole di elettroni 3d non si estendono più lontano dal nucleo di 3s e 3p (e quindi non costituiscono un altro guscio come gli elettroni 4s), sono completamente schermati dalla carica nucleare e quindi spesso agiscono come elettroni di valenza. Questo comportamento Jekyll e Hyde degli elettroni 3d rende la vita più complicata (e spesso molto più interessante) per i chimici che studiano gli elementi di transizione.
| Z | Elemento | Configurazione | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | He | 1s 2 | |
| 3 | Li | 2s 1 | |
| 4 | Be | 2s 2 | |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2p4 | |
| 9 | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | |
| 21 | Sc | 3d 1 4s 2 | |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | 3d 5 4s 1 | |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | |
| 30 | Zn | 3d 10 4s 2 | |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | |
| 35 | Br | 3d 10 4s 2 4p 5 | |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | La | 5d 1 6s 2 | |
| 58 | Ce | 4f 1 5d 1 6s 2 | |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | |
| 65 | Tb | 4f 9 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | |
| 72 | Hf | 4f 14 5d 2 6s 2 | |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | |
| 77 | Ir | 4f 14 5d 7 6s 2 | |
| 78 | Pt | 4f 14 5d 9 6s 1 | |
| 79 | Au | 4f 14 5d 10 6s 1 | |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | |
| 98 | Cf | 5f 10 s 2 | |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | No | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
La terza grande categoria di elementi si presenta quando l’elettrone distintivo occupa un sottoguscio f. Il primo esempio si verifica nel caso dei lantanoidi (elementi con numero atomico tra 57 e 71), che hanno la configurazione elettronica generale
4d104f i5s25p65d0 o 16s2
dove i è un numero tra 0 e 14. Così, nel processo di costruzione dei lantanoidi, si aggiungono elettroni a un sottoguscio (4f) il cui numero quantico principale è due meno di quello dell’orbitale più esterno (6s). L’aggiunta di un altro elettrone a un guscio interno sepolto così profondamente come il 4f ha poco o nessun effetto sulle proprietà chimiche di questi elementi. Tutti sono abbastanza simili al lantanio (La) e potrebbero stare esattamente nello stesso spazio nella tavola periodica del La. Gli elementi lantanoidi sono così simili tra loro che sono necessarie tecniche speciali per separarli. Di conseguenza, anche campioni approssimativamente puri della maggior parte di loro non furono preparati fino agli anni 1870. Dopo l’elemento attinio (Ac) c’è una serie di atomi in cui il sottoguscio 5f è di riempimento. Gli attinoidi sono un po’ meno simili all’Ac di quanto i lantanoidi lo siano al La, perché alcune eccezioni all’ordine usuale degli orbitali di riempimento si verificano nel caso di Th, Pa, e U (Tabella \PageIndex{1}}).
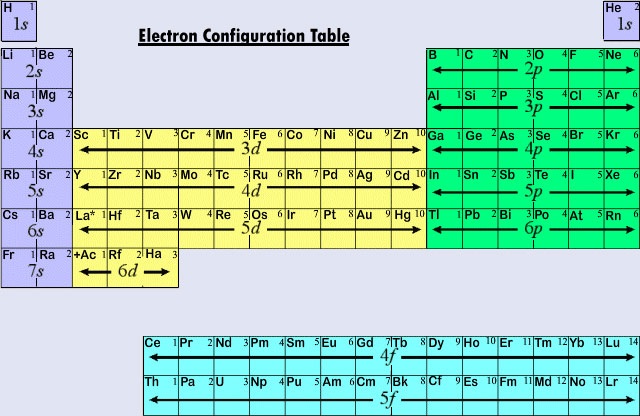
Perché i lantanoidi e la maggior parte degli attinoidi si comportano chimicamente come se dovessero stare nel gruppo IIIB della tavola periodica (dove si trovano Lu e Lr), entrambi i gruppi sono separati dal resto della tavola e messi insieme in un blocco sottostante. Presi insieme, i lantanoidi e gli attinoidi sono chiamati elementi di transizione interna perché i sottogusci f che vengono riempiti si trovano così in profondità nella restante struttura elettronica dei loro atomi.
La figura \(\PageIndex{2}) riassume il tipo di sottoguscio in cui si trova l’elettrone distintivo per atomi di elementi in varie regioni della tavola periodica. Questa informazione riassuntiva rende relativamente semplice usare la tavola periodica per ottenere le configurazioni degli elettroni, come mostra il seguente esempio.
Esempio \(\PageIndex{1}\): Configurazione degli elettroni
Ottieni la configurazione degli elettroni per (a) Nb; (b) Pr.
Soluzione
a) Nb, elemento numero 41, si trova nel quinto periodo e in una regione della tavola periodica dove un sottoguscio d sta riempiendo (la seconda serie di transizione). Andando indietro (verso numeri atomici più bassi) attraverso la tavola periodica, il gas nobile più vicino è Kr, e quindi usiamo il kernel Kr:
Nb _____
L’elemento successivo al 36K è il 37Rb in cui il sottoguscio 5s si riempie. Spostandoci a destra di un altro spazio, arriviamo a 38Sr che ha una coppia 5s2. Finora abbiamo Nb _____ 5s2 per la configurazione Nb. Ora ci spostiamo più a destra nella regione del sottoguscio 4d della tavola periodica e contiamo su tre spazi (Y, Zr, Nb) per raggiungere Nb. La configurazione totale degli elettroni è quindi Nb 4d35s2 (Nota che il numero quantico principale del sottoguscio d è 4 – uno in meno del numero del periodo. Inoltre, se si guarda la tabella delle configurazioni elettroniche, si dovrebbe notare che Nb è un’eccezione alle tipiche regole di riempimento degli orbitali) b) Una procedura simile è seguita per Pr, elemento numero 59. Andando indietro nella tabella, il gas nobile più vicino è Xe, e quindi usiamo il kernel Xe. Contando ancora in avanti, Cs e Ba corrispondono a 6s2. Poi La, Ce e Pr corrispondono ad altri tre elettroni nel sottoguscio 4f. La configurazione è quindi Pr…4f36s2
Un altro punto deve essere sottolineato sulla relazione tra la configurazione degli elettroni e la tavola periodica. Gli atomi degli elementi nella stessa colonna verticale della tavola hanno configurazioni elettroniche simili. Per esempio, consideriamo gli elementi alcalino-terrosi (gruppo IIA). Usando le nostre regole per derivare le configurazioni elettroniche (Esempio 1) abbiamo
| Elemento | Configurazione degli elettroni | Diagramma di Lewis |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Quindi le somiglianze di comportamento chimico e di valenza notate prima per questi elementi sono correlate alle somiglianze delle loro nuvole di elettroni più esterne. Tali somiglianze spiegano il successo delle previsioni di Mendeleev sulle proprietà degli elementi sconosciuti.
Contribuenti e attribuzioni
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.
