Obiettivi di apprendimento
- Descrivere i componenti coinvolti in una contrazione muscolare
- Spiegare come i muscoli si contraggono e si rilassano
- Descrivere il modello del filamento scorrevole della contrazione muscolare
La sequenza di eventi che portano alla contrazione di una singola fibra muscolare inizia con un segnale – il neurotrasmettitore, ACh- dal neurone motore che innerva quella fibra. La membrana locale della fibra si depolarizza quando entrano ioni di sodio caricati positivamente (Na+), innescando un potenziale d’azione che si diffonde al resto della membrana si depolarizza, compresi i tubuli T. Questo innesca il rilascio di ioni calcio (Ca++) dal deposito nel reticolo sarcoplasmatico (SR). Il Ca++ inizia la contrazione, che è sostenuta dall’ATP (Figura 1). Finché gli ioni Ca++ rimangono nel sarcoplasma per legarsi alla troponina, che mantiene i siti di legame all’actina “non schermati”, e finché l’ATP è disponibile per guidare il ciclo dei ponti incrociati e la trazione dei filamenti di actina da parte della miosina, la fibra muscolare continuerà ad accorciarsi fino a un limite anatomico.

Figura 1. Contrazione di una fibra muscolare. Un ponte incrociato si forma tra l’actina e le teste di miosina innescando la contrazione. Finché gli ioni Ca++ rimangono nel sarcoplasma per legarsi alla troponina, e finché l’ATP è disponibile, la fibra muscolare continuerà ad accorciarsi.
La contrazione muscolare di solito si ferma quando termina la segnalazione dal motoneurone, che ripolarizza il sarcolemma e i tubuli T, e chiude i canali del calcio voltaggio-gated nel SR. Gli ioni Ca++ vengono quindi pompati di nuovo nel SR, il che fa sì che la tropomiosina si risigilli (o ricopra) i siti di legame sui filamenti di actina. Un muscolo può anche smettere di contrarsi quando finisce l’ATP e si affatica (Figura 2).

Figura 2. Rilassamento di una fibra muscolare. Gli ioni Ca++ vengono pompati di nuovo nel SR, il che fa sì che la tropomiosina riserbi i siti di legame sui filamenti di actina. Un muscolo può anche smettere di contrarsi quando esaurisce l’ATP e si affatica.
Gli eventi molecolari dell’accorciamento delle fibre muscolari avvengono all’interno dei sarcomeri della fibra (vedi Figura 3). La contrazione di una fibra muscolare striata avviene quando i sarcomeri, disposti linearmente all’interno delle miofibrille, si accorciano quando le teste di miosina tirano i filamenti di actina.
La regione dove i filamenti spessi e sottili si sovrappongono ha un aspetto denso, poiché c’è poco spazio tra i filamenti. Questa zona di sovrapposizione dei filamenti sottili e spessi è molto importante per la contrazione muscolare, poiché è il luogo in cui inizia il movimento dei filamenti. I filamenti sottili, ancorati alle loro estremità dai dischi Z, non si estendono completamente nella regione centrale che contiene solo filamenti spessi, ancorati alle loro basi in un punto chiamato linea M. Una miofibrilla è composta da molti sarcomeri che corrono per tutta la sua lunghezza; così, le miofibrille e le cellule muscolari si contraggono quando i sarcomeri si contraggono.
Il modello del filamento scorrevole della contrazione
Quando viene segnalato da un motoneurone, una fibra muscolare scheletrica si contrae quando i filamenti sottili vengono tirati e poi scivolano oltre i filamenti spessi all’interno dei sarcomeri della fibra. Questo processo è noto come il modello del filamento scorrevole della contrazione muscolare (Figura 3). Lo scorrimento può avvenire solo quando i siti di legame della miosina sui filamenti di actina sono esposti attraverso una serie di passaggi che iniziano con l’ingresso di Ca++ nel sarcoplasma.

Figura 3. Il modello del filamento scorrevole della contrazione muscolare. Quando un sarcomero si contrae, le linee Z si avvicinano e la banda I diventa più piccola. La banda A rimane della stessa larghezza. In piena contrazione, i filamenti sottili e spessi si sovrappongono.
La tropomiosina è una proteina che si avvolge intorno alle catene del filamento di actina e copre i siti di legame della miosina per impedire all’actina di legarsi alla miosina. La tromiosina si lega alla troponina per formare un complesso troponina-tropomiosina. Il complesso troponina-tropomiosina impedisce alle “teste” della miosina di legarsi ai siti attivi sui microfilamenti di actina. La troponina ha anche un sito di legame per gli ioni Ca++.
Per iniziare la contrazione muscolare, la tropomiosina deve esporre il sito di legame della miosina su un filamento di actina per permettere la formazione del ponte incrociato tra i microfilamenti di actina e miosina. Il primo passo nel processo di contrazione è che il Ca++ si leghi alla troponina in modo che la tropomiosina possa scivolare via dai siti di legame sui filamenti di actina. Questo permette alle teste della miosina di legarsi a questi siti di legame esposti e formare ponti incrociati. I filamenti sottili sono quindi tirati dalle teste di miosina per scivolare oltre i filamenti spessi verso il centro del sarcomero. Ma ogni testa può tirare solo una distanza molto breve prima di raggiungere il suo limite e deve essere “riagganciata” prima di poter tirare di nuovo, un passo che richiede ATP.
ATP e contrazione muscolare
Perché i filamenti sottili continuino a scivolare oltre i filamenti spessi durante la contrazione muscolare, le teste di miosina devono tirare l’actina nei siti di legame, staccarsi, riagganciarsi, attaccarsi a più siti di legame, tirare, staccarsi, riagganciarsi, ecc. Questo movimento ripetuto è conosciuto come il ciclo del ponte incrociato. Questo movimento delle teste di miosina è simile ai remi quando un individuo rema su una barca: La pagaia dei remi (le teste di miosina) tirano, vengono sollevate dall’acqua (staccate), riposizionate (riarmate) e poi immerse di nuovo per tirare (Figura 4). Ogni ciclo richiede energia, e l’azione delle teste di miosina nei sarcomeri che tirano ripetutamente i filamenti sottili richiede anche energia, che è fornita dall’ATP.
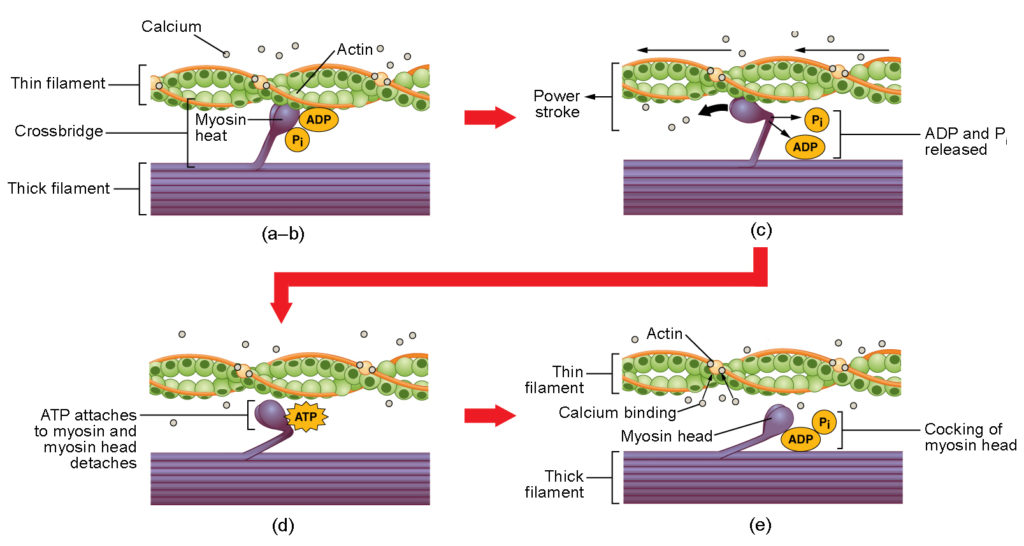
Figura 4. Contrazione dei muscoli scheletrici. (a) Il sito attivo sull’actina è esposto quando il calcio si lega alla troponina. (b) La testa della miosina è attratta dall’actina, e la miosina lega l’actina al suo sito di legame con l’actina, formando il ponte incrociato. (c) Durante il colpo di potenza, il fosfato generato nel precedente ciclo di contrazione viene rilasciato. Questo ha come risultato che la testa della miosina ruota verso il centro del sarcomero, dopo di che l’ADP e il gruppo fosfato vengono rilasciati. (d) Una nuova molecola di ATP si attacca alla testa della miosina, causando il distacco del cross-bridge. (e) La testa della miosina idrolizza l’ATP in ADP e fosfato, che riporta la miosina in posizione armata.
La formazione del ponte incrociato avviene quando la testa della miosina si attacca all’actina mentre l’adenosina difosfato (ADP) e il fosfato inorganico (Pi) sono ancora legati alla miosina (Figura 4a,b). Il Pi viene poi rilasciato, inducendo la miosina a formare un attacco più forte all’actina, dopo di che la testa della miosina si muove verso la linea M, trascinando l’actina con sé. Mentre l’actina viene tirata, i filamenti si muovono di circa 10 nm verso la linea M. Questo movimento è chiamato colpo di potenza, poiché il movimento del filamento sottile avviene in questa fase (Figura 4c). In assenza di ATP, la testa della miosina non si stacca dall’actina.
Una parte della testa della miosina si attacca al sito di legame sull’actina, ma la testa ha un altro sito di legame per l’ATP. Il legame con l’ATP causa il distacco della testa della miosina dall’actina (Figura 4d). Dopo che questo avviene, l’ATP viene convertito in ADP e Pi dall’attività ATPasi intrinseca della miosina. L’energia rilasciata durante l’idrolisi dell’ATP cambia l’angolo della testa della miosina in una posizione inclinata (Figura 4e). La testa della miosina è ora in posizione per ulteriori movimenti.
Quando la testa della miosina è armata, la miosina è in una configurazione ad alta energia. Questa energia viene consumata mentre la testa della miosina si muove attraverso la corsa di potenza, e alla fine della corsa di potenza, la testa della miosina è in una posizione a bassa energia. Dopo il colpo di potenza, l’ADP viene rilasciato; tuttavia, il ponte incrociato formato è ancora in posizione, e actina e miosina sono legate insieme. Finché l’ATP è disponibile, si attacca facilmente alla miosina, il ciclo del ponte incrociato può ripetersi e la contrazione muscolare può continuare.
Nota che ogni filamento spesso di circa 300 molecole di miosina ha più teste di miosina, e molti ponti incrociati si formano e si rompono continuamente durante la contrazione muscolare. Moltiplicate questo per tutti i sarcomeri di una miofibrilla, per tutte le miofibrille di una fibra muscolare e per tutte le fibre muscolari di un muscolo scheletrico, e potrete capire perché è necessaria così tanta energia (ATP) per far funzionare i muscoli scheletrici. Infatti, è la perdita di ATP che provoca il rigor mortis osservato subito dopo la morte di qualcuno. Senza ulteriore produzione di ATP possibile, non c’è ATP disponibile per le teste di miosina per staccarsi dai siti di legame dell’actina, così i ponti incrociati rimangono in posizione, causando la rigidità nei muscoli scheletrici.
Fonti di ATP
L’ATP fornisce l’energia per far avvenire la contrazione muscolare. Oltre al suo ruolo diretto nel ciclo dei ponti incrociati, l’ATP fornisce anche l’energia per le pompe di trasporto attivo del Ca++ nel SR. La contrazione muscolare non avviene senza una quantità sufficiente di ATP. La quantità di ATP immagazzinata nel muscolo è molto bassa, sufficiente solo per alimentare qualche secondo di contrazioni. Poiché viene scisso, l’ATP deve quindi essere rigenerato e sostituito rapidamente per consentire una contrazione sostenuta. Ci sono tre meccanismi con cui l’ATP può essere rigenerato: il metabolismo del fosfato di creatina, la glicolisi anaerobica, la fermentazione e la respirazione aerobica.
Il fosfato di creatina è una molecola che può immagazzinare energia nei suoi legami fosfatici. In un muscolo a riposo, l’eccesso di ATP trasferisce la sua energia alla creatina, producendo ADP e creatina fosfato. Questo agisce come una riserva di energia che può essere utilizzata per creare rapidamente più ATP. Quando il muscolo inizia a contrarsi e ha bisogno di energia, la creatina fosfato trasferisce il suo fosfato di nuovo all’ADP per formare ATP e creatina. Questa reazione è catalizzata dall’enzima creatina chinasi e avviene molto rapidamente; così, l’ATP derivato dal fosfato di creatina alimenta i primi secondi di contrazione muscolare. Tuttavia, la creatina fosfato può fornire solo circa 15 secondi di energia, a quel punto deve essere utilizzata un’altra fonte di energia (Figura 5).

Figura 5. Metabolismo muscolare. Una parte dell’ATP è immagazzinata in un muscolo a riposo. Quando inizia la contrazione, si consuma in pochi secondi. Altro ATP è generato dalla creatina fosfato per circa 15 secondi.
Quando l’ATP prodotto dalla creatina fosfato è esaurito, i muscoli si rivolgono alla glicolisi come fonte di ATP. La glicolisi è un processo anaerobico (non dipendente dall’ossigeno) che scompone il glucosio (zucchero) per produrre ATP; tuttavia, la glicolisi non può generare ATP così rapidamente come la creatina fosfato. Quindi, il passaggio alla glicolisi si traduce in un tasso più lento di disponibilità di ATP per il muscolo. Lo zucchero utilizzato nella glicolisi può essere fornito dal glucosio nel sangue o dalla metabolizzazione del glicogeno immagazzinato nel muscolo. La scomposizione di una molecola di glucosio produce due ATP e due molecole di acido piruvico, che può essere usato nella respirazione aerobica o, quando i livelli di ossigeno sono bassi, convertito in acido lattico (Figura 6).

Figura 6. Glicolisi e respirazione aerobica. Ogni molecola di glucosio produce due ATP e due molecole di acido piruvico, che può essere usato nella respirazione aerobica o convertito in acido lattico. Se l’ossigeno non è disponibile, l’acido piruvico viene convertito in acido lattico, che può contribuire all’affaticamento muscolare. Questo si verifica durante l’esercizio faticoso quando sono necessarie elevate quantità di energia ma l’ossigeno non può essere sufficientemente consegnato al muscolo.
Se l’ossigeno è disponibile, l’acido piruvico viene utilizzato nella respirazione aerobica. Tuttavia, se l’ossigeno non è disponibile, l’acido piruvico viene convertito in acido lattico, che può contribuire alla fatica muscolare. Questa conversione permette il riciclaggio dell’enzima NAD+ da NADH, che è necessario per continuare la glicolisi. Ciò si verifica durante l’esercizio fisico intenso, quando sono necessarie elevate quantità di energia ma l’ossigeno non può essere sufficientemente fornito al muscolo. La glicolisi stessa non può essere sostenuta per molto tempo (circa 1 minuto di attività muscolare), ma è utile per facilitare brevi raffiche di output ad alta intensità. Questo perché la glicolisi non utilizza il glucosio in modo molto efficiente, producendo un guadagno netto di due ATP per molecola di glucosio, e il prodotto finale di acido lattico, che può contribuire alla fatica muscolare quando si accumula.
La respirazione aerobica è la scomposizione del glucosio o di altri nutrienti in presenza di ossigeno (O2) per produrre anidride carbonica, acqua e ATP. Circa il 95% dell’ATP richiesto dai muscoli a riposo o moderatamente attivi è fornito dalla respirazione aerobica, che ha luogo nei mitocondri. Gli input per la respirazione aerobica includono il glucosio che circola nel sangue, l’acido piruvico e gli acidi grassi. La respirazione aerobica è molto più efficiente della glicolisi anaerobica, producendo circa 36 ATP per molecola di glucosio contro i quattro della glicolisi. Tuttavia, la respirazione aerobica non può essere sostenuta senza una fornitura costante di O2 al muscolo scheletrico ed è molto più lenta (Figura 7). Per compensare, i muscoli immagazzinano piccole quantità di ossigeno in eccesso in proteine chiamate mioglobina, permettendo contrazioni muscolari più efficienti e meno fatica. L’allenamento aerobico aumenta anche l’efficienza del sistema circolatorio in modo che l’O2 possa essere fornito ai muscoli per periodi di tempo più lunghi.

Figura 7. Respirazione cellulare. La respirazione aerobica è la scomposizione del glucosio in presenza di ossigeno (O2) per produrre anidride carbonica, acqua e ATP. Circa il 95% dell’ATP necessario per i muscoli a riposo o moderatamente attivi è fornito dalla respirazione aerobica, che ha luogo nei mitocondri.
L’affaticamento muscolare si verifica quando un muscolo non può più contrarsi in risposta ai segnali del sistema nervoso. Le cause esatte dell’affaticamento muscolare non sono del tutto note, anche se alcuni fattori sono stati correlati alla diminuzione della contrazione muscolare che si verifica durante l’affaticamento. L’ATP è necessario per la normale contrazione muscolare, e quando le riserve di ATP si riducono, la funzione muscolare può diminuire. Questo può essere un fattore più importante in una breve e intensa produzione muscolare piuttosto che in sforzi sostenuti e di bassa intensità. L’accumulo di acido lattico può abbassare il pH intracellulare, influenzando l’attività degli enzimi e delle proteine. Gli squilibri nei livelli di Na+ e K+ come risultato della depolarizzazione della membrana possono interrompere il flusso di Ca++ dal SR. Lunghi periodi di esercizio prolungato possono danneggiare il SR e il sarcolemma, con conseguente compromissione della regolazione del Ca++.
L’intensa attività muscolare provoca un debito di ossigeno, che è la quantità di ossigeno necessaria per compensare l’ATP prodotto senza ossigeno durante la contrazione muscolare. L’ossigeno è necessario per ripristinare i livelli di ATP e creatina fosfato, convertire l’acido lattico in acido piruvico e, nel fegato, convertire l’acido lattico in glucosio o glicogeno. Anche altri sistemi utilizzati durante l’esercizio richiedono ossigeno, e tutti questi processi combinati determinano l’aumento della frequenza respiratoria che si verifica dopo l’esercizio. Finché il debito di ossigeno non è stato soddisfatto, l’assunzione di ossigeno è elevata, anche dopo che l’esercizio è cessato.
Relaxation of a Skeletal Muscle
Relaxing skeletal muscle fibers, and ultimately, the skeletal muscle, begins with the motor neuron, which stops releasing its chemical signal, ACh, into the synapse at the NMJ. La fibra muscolare si ripolarizza, il che chiude i cancelli nel SR dove il Ca++ veniva rilasciato. Le pompe azionate dall’ATP spostano il Ca++ dal sarcoplasma al SR. Questo si traduce in una “risistemazione” dei siti di legame con l’actina sui filamenti sottili. Senza la capacità di formare ponti incrociati tra i filamenti sottili e spessi, la fibra muscolare perde la sua tensione e si rilassa.
Forza muscolare
Il numero di fibre muscolari scheletriche in un dato muscolo è determinato geneticamente e non cambia. La forza muscolare è direttamente collegata alla quantità di miofibrille e sarcomeri all’interno di ogni fibra. Fattori come gli ormoni e lo stress (e gli steroidi anabolizzanti artificiali), agendo sul muscolo possono aumentare la produzione di sarcomeri e miofibrille all’interno delle fibre muscolari, un cambiamento chiamato ipertrofia, che si traduce in un aumento della massa e della mole in un muscolo scheletrico. Allo stesso modo, la diminuzione dell’uso di un muscolo scheletrico provoca l’atrofia, dove il numero di sarcomeri e di miofibrille scompare (ma non il numero di fibre muscolari). È comune che un arto ingessato mostri muscoli atrofizzati quando il gesso viene rimosso, e alcune malattie, come la polio, mostrano muscoli atrofizzati.
Disordini del sistema muscolare
La distrofia muscolare di Duchenne (DMD) è un progressivo indebolimento dei muscoli scheletrici. È una delle diverse malattie indicate collettivamente come “distrofia muscolare”. La DMD è causata dalla mancanza della proteina distrofina, che aiuta i sottili filamenti delle miofibrille a legarsi al sarcolemma. Senza sufficiente distrofina, le contrazioni muscolari causano la rottura del sarcolemma, causando un afflusso di Ca++, con conseguente danno cellulare e degradazione delle fibre muscolari. Nel tempo, quando il danno muscolare si accumula, la massa muscolare si perde e si sviluppano maggiori problemi funzionali.
La DMD è un disordine ereditario causato da un cromosoma X anomalo. Colpisce principalmente i maschi e di solito viene diagnosticata nella prima infanzia. La DMD di solito appare prima come difficoltà di equilibrio e di movimento, e poi progredisce fino all’incapacità di camminare. Continua a progredire verso l’alto nel corpo dalle estremità inferiori alla parte superiore del corpo, dove colpisce i muscoli responsabili della respirazione e della circolazione. Alla fine provoca la morte per insufficienza respiratoria, e chi ne è affetto di solito non vive oltre i 20 anni.
Perché la DMD è causata da una mutazione nel gene che codifica per la distrofina, si è pensato che l’introduzione di mioblasti sani nei pazienti potesse essere un trattamento efficace. I mioblasti sono le cellule embrionali responsabili dello sviluppo del muscolo, e idealmente, porterebbero geni sani che potrebbero produrre la distrofina necessaria per la normale contrazione muscolare. Questo approccio è stato in gran parte senza successo negli esseri umani. Un approccio recente ha coinvolto il tentativo di aumentare la produzione del muscolo di utrofina, una proteina simile alla distrofina che potrebbe essere in grado di assumere il ruolo della distrofina e prevenire il verificarsi di danni cellulari.
Domande di autoverifica
Fai il quiz qui sotto per verificare la tua comprensione di Contrazione e rilassamento delle fibre muscolari:
