A: AMINOACIDI
BIOCHIMICA – DR. JAKUBOWSKI
Ultimo aggiornamento: 27/02/16
Obiettivi di apprendimento per il capitolo 2A: Dopo la lezione e questa lettura, gli studenti saranno in grado di
- dichiarare la carica sulle catene laterali degli aminoacidi usando l’equazione di Henderson Hasselbach e la carica approssimativa per ispezione a qualsiasi dato pH
- disegnare meccanismi e identificare prodotti per la reazione delle catene laterali nucleofile Lys e Cys con comuni agenti chimici di modifica ed estendere questa comprensione alle reazioni di His.
- disegnare i meccanismi per le reazioni di scambio di disolfuro per i solfidrilici usandoli e i numeri di ossidazione per spiegare le reazioni redox di cisteina/cistina.
A7. Chimica della cistina
Due catene laterali di cisteina possono interagire covalentemente in una proteina per produrre un disolfuro. Proprio come HOOH (perossido di idrogeno) è più ossidato di HOH (O in H2O2 ha un numero di ossidazione di 1- mentre l’O in H2O ha un numero di ossidazione di 2-), RSSR è la forma ossidata (S numero di ossidazione 1-) e RSH è la forma ridotta (S numero di ossidazione 2-) dei tioli. I numeri di ossidazione sono analoghi poiché O e S sono entrambi nel gruppo 6 della tavola periodica ed entrambi sono più elettronegativi del C.
Un rapido ripasso delle reazioni redox e dei numeri di ossidazione.
Figura: DISULFIDE – CISTINA – REAZIONI
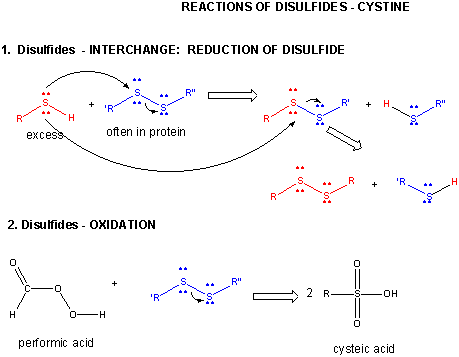
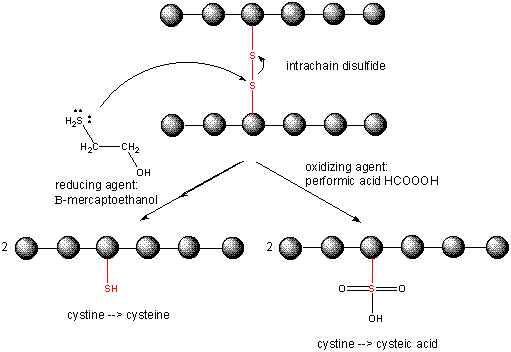
Quando una proteina si ripiega, due catene laterali Cys potrebbero avvicinarsi l’una all’altra e formare un legame disolfuro intra-catena. Allo stesso modo, due catene laterali Cys su proteine separate possono avvicinarsi e formare un disolfuro intercatena. Tali disolfuri devono essere scissi e le catene separate prima di analizzare la sequenza della proteina. Il disolfuro nella proteina può essere scisso da agenti riducenti come beta-mercaptoetanolo, ditiotreitolo, tris (2-carbossietil) fosfina (TCEP) o agenti ossidanti che ossidano ulteriormente il disolfuro per separare gli acidi cisteici.
Figura: Agenti ossidanti del disolfuro – b-mercaptoetanolo, ditiotreitolo, e fosfine
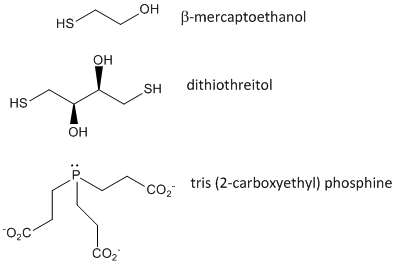
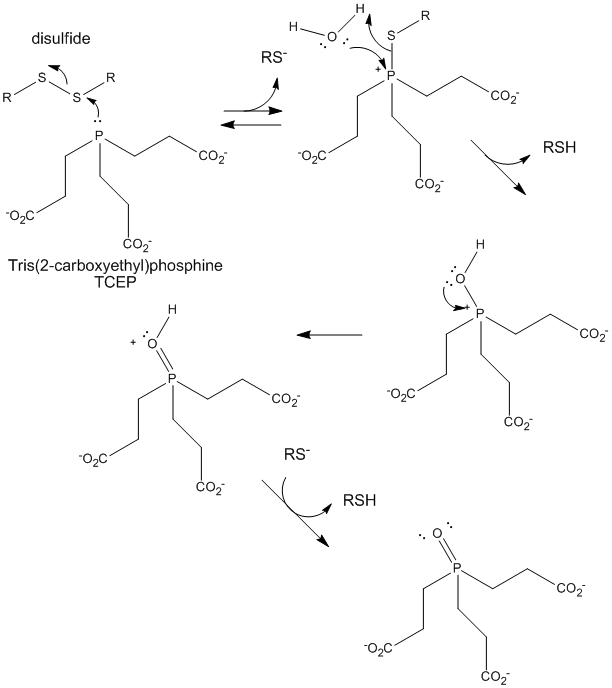
Figura: Riduzione TCEP dei disolfuri
L’interno delle cellule è mantenuto in un ambiente ridotto dalla presenza di molti agenti “riducenti”, come il tripeptide g-glu-cys-gly (glutatione). Quindi le proteine intracellulari di solito non contengono disolfuri, che invece sono abbondanti nelle proteine extracellulari (come quelle che si trovano nel sangue) o in certi organelli come il reticolo endoplasmatico e lo spazio intermembrana mitocondriale dove possono essere introdotti disolfuri.
Figura:
Cleaving Disulfide Bonds in Proteins
Cysteine Redox Chemistry
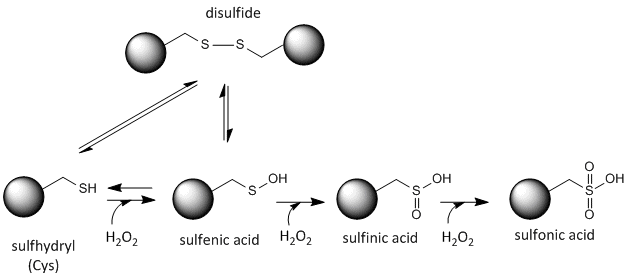
Lo zolfo nella cisteina è redox-attivo e quindi può esistere in una grande varietà di stati, a seconda dell’ambiente redox locale e la presenza di agenti ossidanti e riducenti. Un potente agente ossidante che può essere prodotto nelle cellule è il perossido di idrogeno, che può portare a modifiche chimiche più drastiche e irreversibili alle catene laterali della Cys. Se una Cys reattiva è importante per la funzione della proteina, allora la funzione della proteina può essere modulata (a volte reversibilmente, a volte irreversibilmente) con vari agenti ossidanti, come mostrato nella figura sottostante.
Figura:Stato Redox della Cisteina
Navigazione
Torna alCapitolo 2A: Sezioni di Aminoacidi
Torna all’Indice di Biochimica Online
Versione archiviata del Capitolo 2A completo: Aminoacidi
