OBIETTIVI DI APPRENDIMENTO
- Descrivere l’energia di formazione e rottura dei legami covalenti e ionici formazione e rottura
- Utilizzare le energie medie dei legami covalenti per stimare le entalpie di reazione
La forza di un legame descrive quanto fortemente ogni atomo è unito ad un altro atomo, e quindi quanta energia è richiesta per rompere il legame tra i due atomi.
È essenziale ricordare che è necessario aggiungere energia per rompere i legami chimici (un processo endotermico), mentre formare legami chimici rilascia energia (un processo esotermico). Nel caso di ![]() , il legame covalente è molto forte; una grande quantità di energia, 436 kJ, deve essere aggiunta per rompere i legami in una mole di molecole di idrogeno e causare la separazione degli atomi:
, il legame covalente è molto forte; una grande quantità di energia, 436 kJ, deve essere aggiunta per rompere i legami in una mole di molecole di idrogeno e causare la separazione degli atomi:
![]()
Inversamente, la stessa quantità di energia viene rilasciata quando una mole di ![]() molecole si forma da due moli di atomi H:
molecole si forma da due moli di atomi H:
![]()
Forza di legame: Legami Covalenti
Le molecole stabili esistono perché i legami covalenti tengono insieme gli atomi. Misuriamo la forza di un legame covalente dall’energia richiesta per romperlo, cioè l’energia necessaria per separare gli atomi legati. Separare qualsiasi coppia di atomi legati richiede energia. Più forte è un legame, maggiore è l’energia richiesta per romperlo.
L’energia richiesta per rompere uno specifico legame covalente in una mole di molecole gassose è chiamata energia di legame o energia di dissociazione del legame. L’energia di legame per una molecola biatomica, ![]() , è definita come la variazione di entalpia standard per la reazione endotermica:
, è definita come la variazione di entalpia standard per la reazione endotermica:
![]()
Per esempio, l’energia di legame del puro legame covalente H-H, ![]() , è 436 kJ per mole di legami H-H rotti:
, è 436 kJ per mole di legami H-H rotti:
![]()
Le molecole con tre o più atomi hanno due o più legami. La somma di tutte le energie di legame in una tale molecola è uguale alla variazione entalpica standard per la reazione endotermica che rompe tutti i legami nella molecola. Per esempio, la somma delle quattro energie di legame C-H in ![]() , 1660 kJ, è uguale alla variazione entalpica standard della reazione:
, 1660 kJ, è uguale alla variazione entalpica standard della reazione:

L’energia media del legame C-H, ![]() , è 1660/4 = 415 kJ/mol perché ci sono quattro moli di legami C-H rotti per mole della reazione. Anche se i quattro legami C-H sono equivalenti nella molecola originale, non richiedono tutti la stessa energia per rompersi; una volta che il primo legame è rotto (che richiede 439 kJ/mol), i legami rimanenti sono più facili da rompere. Il valore di 415 kJ/mol è la media, non il valore esatto richiesto per rompere un qualsiasi legame.
, è 1660/4 = 415 kJ/mol perché ci sono quattro moli di legami C-H rotti per mole della reazione. Anche se i quattro legami C-H sono equivalenti nella molecola originale, non richiedono tutti la stessa energia per rompersi; una volta che il primo legame è rotto (che richiede 439 kJ/mol), i legami rimanenti sono più facili da rompere. Il valore di 415 kJ/mol è la media, non il valore esatto richiesto per rompere un qualsiasi legame.
La forza di un legame tra due atomi aumenta all’aumentare del numero di coppie di elettroni nel legame. Generalmente, all’aumentare della forza del legame, la lunghezza del legame diminuisce. Così, troviamo che i legami tripli sono più forti e più corti dei legami doppi tra gli stessi due atomi; allo stesso modo, i legami doppi sono più forti e più corti dei legami singoli tra gli stessi due atomi. Le energie medie di legame per alcuni legami comuni appaiono nella tabella qui sotto, e un confronto delle lunghezze di legame e delle forze di legame per alcuni legami comuni appare nella tabella seguente. Quando un atomo si lega a vari atomi di un gruppo, la forza di legame tipicamente diminuisce man mano che si scende nel gruppo. Per esempio, ![]() è 439 kJ/mol,
è 439 kJ/mol, ![]() è 330 kJ/mol, e
è 330 kJ/mol, e ![]() è 275 kJ/mol.
è 275 kJ/mol.
| Energie di legame (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Bond | Energia di legame | Bond | Energia di legame | Bond | Energia di legame | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Lunghezze medie e energie di legame per alcuni Legami comuni | ||
|---|---|---|
| Bond | Lunghezza di legame (Å) | Energia di legame (kJ/mol) |
| 1.54 | 345 | |
| 1.34 | 611 | |
| 1.20 | 837 | |
| 1.43 | 290 | |
| 1.38 | 615 | |
| 1.16 | 891 | |
| 1.43 | 350 | |
| 1.23 | 741 | |
| 1.13 | 1080 | |
L’energia di legame è la differenza tra l’energia minima (che avviene alla distanza di legame) e l’energia dei due atomi separati. Questa è la quantità di energia rilasciata quando si forma il legame. Al contrario, la stessa quantità di energia è richiesta per rompere il legame. Per la molecola ![]() mostrata nella tabella sopra, alla distanza di legame di 74 pm il sistema è 7,24 × 10-19 J più basso in energia dei due atomi di idrogeno separati. Questo può sembrare un piccolo numero. Tuttavia, come impareremo più dettagliatamente in seguito, le energie di legame sono spesso discusse su base per-mole. Per esempio, ci vogliono 7,24 × 10-19 J per rompere un legame H-H, ma ci vogliono 4,36 × 105 J per rompere 1 mole di legami H-H. Un confronto di alcune lunghezze ed energie di legame è mostrato nelle tabelle qui sopra. Possiamo trovare molti di questi legami in una varietà di molecole, e questa tabella fornisce valori medi. Per esempio, rompere il primo legame C-H in
mostrata nella tabella sopra, alla distanza di legame di 74 pm il sistema è 7,24 × 10-19 J più basso in energia dei due atomi di idrogeno separati. Questo può sembrare un piccolo numero. Tuttavia, come impareremo più dettagliatamente in seguito, le energie di legame sono spesso discusse su base per-mole. Per esempio, ci vogliono 7,24 × 10-19 J per rompere un legame H-H, ma ci vogliono 4,36 × 105 J per rompere 1 mole di legami H-H. Un confronto di alcune lunghezze ed energie di legame è mostrato nelle tabelle qui sopra. Possiamo trovare molti di questi legami in una varietà di molecole, e questa tabella fornisce valori medi. Per esempio, rompere il primo legame C-H in ![]() richiede 439,3 kJ/mol, mentre rompere il primo legame C-H in
richiede 439,3 kJ/mol, mentre rompere il primo legame C-H in ![]() (un comune diluente per vernici) richiede 375.5 kJ/mol.
(un comune diluente per vernici) richiede 375.5 kJ/mol.
Come si vede nelle tabelle precedenti, un legame singolo carbonio-carbonio medio è di 347 kJ/mol, mentre in un doppio legame carbonio-carbonio, il legame ![]() aumenta la forza del legame di 267 kJ/mol. L’aggiunta di un ulteriore legame
aumenta la forza del legame di 267 kJ/mol. L’aggiunta di un ulteriore legame ![]() causa un ulteriore aumento di 225 kJ/mol. Possiamo vedere un modello simile quando confrontiamo altri legami
causa un ulteriore aumento di 225 kJ/mol. Possiamo vedere un modello simile quando confrontiamo altri legami ![]() e
e ![]() . Così, ogni singolo legame
. Così, ogni singolo legame ![]() è generalmente più debole di un corrispondente legame
è generalmente più debole di un corrispondente legame ![]() tra gli stessi due atomi. In un legame
tra gli stessi due atomi. In un legame ![]() , c’è un maggior grado di sovrapposizione orbitale che in un legame
, c’è un maggior grado di sovrapposizione orbitale che in un legame ![]() .
.
Possiamo usare le energie di legame per calcolare cambiamenti entalpici approssimativi per reazioni dove le entalpie di formazione non sono disponibili. Calcoli di questo tipo ci diranno anche se una reazione è esotermica o endotermica. Una reazione esotermica (ΔH negativo, calore prodotto) risulta quando i legami nei prodotti sono più forti dei legami nei reagenti. Una reazione endotermica (ΔH positivo, calore assorbito) risulta quando i legami nei prodotti sono più deboli di quelli nei reagenti.
La variazione di entalpia, ΔH, per una reazione chimica è approssimativamente uguale alla somma dell’energia richiesta per rompere tutti i legami nei reagenti (energia “in”, segno positivo) più l’energia rilasciata quando tutti i legami sono formati nei prodotti (energia “out”, segno negativo). Questo può essere espresso matematicamente nel modo seguente:
![]()
In questa espressione, il simbolo ![]() significa “la somma di” e D rappresenta l’energia di legame in kilojoule per mole, che è sempre un numero positivo. L’energia di legame si ottiene da una tabella e dipenderà dal fatto che il particolare legame è un legame singolo, doppio o triplo. Quindi, nel calcolare le entalpie in questo modo, è importante considerare il legame in tutti i reagenti e prodotti. Poiché i valori di D sono tipicamente medie per un tipo di legame in molte molecole diverse, questo calcolo fornisce una stima approssimativa, non un valore esatto, per l’entalpia di reazione.
significa “la somma di” e D rappresenta l’energia di legame in kilojoule per mole, che è sempre un numero positivo. L’energia di legame si ottiene da una tabella e dipenderà dal fatto che il particolare legame è un legame singolo, doppio o triplo. Quindi, nel calcolare le entalpie in questo modo, è importante considerare il legame in tutti i reagenti e prodotti. Poiché i valori di D sono tipicamente medie per un tipo di legame in molte molecole diverse, questo calcolo fornisce una stima approssimativa, non un valore esatto, per l’entalpia di reazione.
Considera la seguente reazione:
![]()
o
![]()
Per formare due moli di ![]() , una mole di legami H-H e una mole di legami Cl-Cl devono essere rotti. L’energia richiesta per rompere questi legami è la somma dell’energia del legame H-H (436 kJ/mol) e del legame Cl-Cl (243 kJ/mol). Durante la reazione, si formano due moli di legami H-Cl (energia di legame = 432 kJ/mol), rilasciando 2 × 432 kJ; o 864 kJ. Poiché i legami nei prodotti sono più forti di quelli nei reagenti, la reazione rilascia più energia di quella che consuma:
, una mole di legami H-H e una mole di legami Cl-Cl devono essere rotti. L’energia richiesta per rompere questi legami è la somma dell’energia del legame H-H (436 kJ/mol) e del legame Cl-Cl (243 kJ/mol). Durante la reazione, si formano due moli di legami H-Cl (energia di legame = 432 kJ/mol), rilasciando 2 × 432 kJ; o 864 kJ. Poiché i legami nei prodotti sono più forti di quelli nei reagenti, la reazione rilascia più energia di quella che consuma:
Questa energia in eccesso viene rilasciata come calore, quindi la reazione è esotermica. L’appendice G dà un valore per l’entalpia molare standard di formazione di ![]() ,
, ![]() , di -92,307 kJ/mol. Il doppio di questo valore è -184.6 kJ, che concorda bene con la risposta ottenuta in precedenza per la formazione di due moli di HCl.
, di -92,307 kJ/mol. Il doppio di questo valore è -184.6 kJ, che concorda bene con la risposta ottenuta in precedenza per la formazione di due moli di HCl.
ESEMPIO
Using Bond Energies to Calculate Approximate Enthalpy Changes
Metanolo, ![]() , può essere un eccellente carburante alternativo. La reazione ad alta temperatura di vapore e carbonio produce una miscela di gas monossido di carbonio,
, può essere un eccellente carburante alternativo. La reazione ad alta temperatura di vapore e carbonio produce una miscela di gas monossido di carbonio, ![]() , e idrogeno,
, e idrogeno, ![]() , da cui può essere prodotto il metanolo. Usando le energie di legame nelle tabelle precedenti, calcola la variazione entalpica approssimativa, ΔH, per la reazione qui descritta:
, da cui può essere prodotto il metanolo. Usando le energie di legame nelle tabelle precedenti, calcola la variazione entalpica approssimativa, ΔH, per la reazione qui descritta:
![]()
Soluzione
Prima, dobbiamo scrivere le strutture di Lewis dei reagenti e dei prodotti:

Da questo, vediamo che ΔH per questa reazione coinvolge l’energia richiesta per rompere un triplo legame C-O e due legami singoli H-H, così come l’energia prodotta dalla formazione di tre legami singoli C-H, un legame singolo C-O, e un legame singolo O-H. Possiamo esprimere questo come segue:
Utilizzando i valori di energia di legame nella tabella, otteniamo:
Possiamo confrontare questo valore con quello calcolato in base ai dati ![]() dell’Appendice G:
dell’Appendice G:
Nota che c’è un divario abbastanza significativo tra i valori calcolati con i due diversi metodi. Questo accade perché i valori D sono la media di diverse forze di legame; quindi, spesso danno solo un accordo approssimativo con altri dati.
Check Your Learning
L’alcool etilico, ![]() , è stato uno dei primi prodotti chimici organici sintetizzati deliberatamente dall’uomo. Ha molti usi nell’industria, ed è l’alcol contenuto nelle bevande alcoliche. Può essere ottenuto dalla fermentazione dello zucchero o sintetizzato dall’idratazione dell’etilene nella seguente reazione:
, è stato uno dei primi prodotti chimici organici sintetizzati deliberatamente dall’uomo. Ha molti usi nell’industria, ed è l’alcol contenuto nelle bevande alcoliche. Può essere ottenuto dalla fermentazione dello zucchero o sintetizzato dall’idratazione dell’etilene nella seguente reazione:

Utilizzando le energie di legame nella tabella, calcola una variazione entalpica approssimativa, ΔH, per questa reazione.
-35 kJ
Forza del legame ionico ed energia del reticolo
Un composto ionico è stabile a causa dell’attrazione elettrostatica tra gli ioni positivi e negativi. L’energia di reticolo di un composto è una misura della forza di questa attrazione. L’energia di reticolo (ΔHlattice) di un composto ionico è definita come l’energia richiesta per separare una mole del solido nei suoi ioni gassosi componenti. Per il solido ionico MX, l’energia di reticolo è la variazione entalpica del processo:
![]()
Nota che stiamo usando la convenzione in cui il solido ionico è separato in ioni, quindi le nostre energie di reticolo saranno endotermiche (valori positivi). Alcuni testi usano la convenzione equivalente ma opposta, definendo l’energia di reticolo come l’energia rilasciata quando gli ioni separati si combinano per formare un reticolo e dando valori negativi (esotermici). Quindi, se state cercando le energie di reticolo in un altro riferimento, assicuratevi di controllare quale definizione viene utilizzata. In entrambi i casi, una grandezza maggiore per l’energia di reticolo indica un composto ionico più stabile. Per il cloruro di sodio, ![]() . Così, ci vogliono 769 kJ per separare una mole di solido
. Così, ci vogliono 769 kJ per separare una mole di solido ![]() in ioni gassosi
in ioni gassosi ![]() e
e ![]() . Quando una mole ciascuno di
. Quando una mole ciascuno di ![]() gassoso e
gassoso e ![]() ioni forma
ioni forma ![]() , vengono rilasciati 769 kJ di calore.
, vengono rilasciati 769 kJ di calore.
L’energia del reticolo ![]() di un cristallo ionico può essere espressa dalla seguente equazione (derivata dalla legge di Coulomb, che regola le forze tra cariche elettriche):
di un cristallo ionico può essere espressa dalla seguente equazione (derivata dalla legge di Coulomb, che regola le forze tra cariche elettriche):
![]()
in cui C è una costante che dipende dal tipo di struttura del cristallo; Z+ e Z- sono le cariche sugli ioni; e Ro è la distanza interionica (la somma dei raggi degli ioni positivi e negativi). Così, l’energia del reticolo di un cristallo ionico aumenta rapidamente quando le cariche degli ioni aumentano e le dimensioni degli ioni diminuiscono. Quando tutti gli altri parametri sono mantenuti costanti, raddoppiando la carica sia del catione che dell’anione si quadruplica l’energia di reticolo. Per esempio, l’energia del reticolo di ![]() (Z+ e Z- = 1) è 1023 kJ/mol, mentre quella di
(Z+ e Z- = 1) è 1023 kJ/mol, mentre quella di ![]() (Z+ e Z- = 2) è 3900 kJ/mol (Ro è quasi lo stesso – circa 200 pm per entrambi i composti).
(Z+ e Z- = 2) è 3900 kJ/mol (Ro è quasi lo stesso – circa 200 pm per entrambi i composti).
Distanze interatomiche diverse producono energie di reticolo diverse. Per esempio, possiamo confrontare l’energia di reticolo di ![]() (2957 kJ/mol) con quella di
(2957 kJ/mol) con quella di ![]() (2327 kJ/mol) per osservare l’effetto sull’energia di reticolo della minore dimensione ionica di F- rispetto a I-.
(2327 kJ/mol) per osservare l’effetto sull’energia di reticolo della minore dimensione ionica di F- rispetto a I-.
ESEMPIO
Confronti sull’energia del reticolo
La gemma preziosa rubino è ossido di alluminio, ![]() , contenente tracce di
, contenente tracce di ![]() . Il composto
. Il composto ![]() è usato nella fabbricazione di alcuni dispositivi semiconduttori. Quale ha l’energia di reticolo più grande,
è usato nella fabbricazione di alcuni dispositivi semiconduttori. Quale ha l’energia di reticolo più grande, ![]() o
o ![]() ?
?
Soluzione
In questi due composti ionici, le cariche Z+ e Z- sono le stesse, quindi la differenza di energia di reticolo dipende da Ro. Il ![]() è più piccolo dello ione
è più piccolo dello ione ![]() . Così,
. Così, ![]() avrebbe una distanza interionica più corta di
avrebbe una distanza interionica più corta di ![]() , e
, e ![]() avrebbe l’energia di reticolo maggiore.
avrebbe l’energia di reticolo maggiore.
Controlla il tuo apprendimento
L’ossido di zinco, \text{ZnO} , è una protezione solare molto efficace. Come sarebbe l’energia reticolare di \testo{ZnO} rispetto a quella di ![]() ?
?
\testo{ZnO} avrebbe un’energia reticolare più grande. avrebbe l’energia di reticolo più grande perché i valori Z sia del catione che dell’anione in \testo{ZnO} sono maggiori, e la distanza interionica di \testo{ZnO} è minore di quella di
PASSI CHIAVE
La forza di un legame covalente è misurata dalla sua energia di dissociazione del legame, cioè la quantità di energia richiesta per rompere quel particolare legame in una mole di molecole. I legami multipli sono più forti dei legami singoli tra gli stessi atomi. L’entalpia di una reazione può essere stimata sulla base dell’energia richiesta per rompere i legami e l’energia rilasciata quando si formano nuovi legami. Per i legami ionici, l’energia di reticolo è l’energia richiesta per separare una mole di un composto nei suoi ioni in fase gassosa. L’energia di reticolo aumenta per gli ioni con cariche più alte e distanze più corte tra gli ioni.
- Energia di legame per una molecola biatomica:
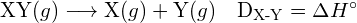
- Cambio di entalpia:

- Energia del lattice per un solido MX:
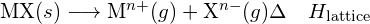
- Energia del reticolo per un cristallo ionico:
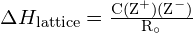
FINE CAPITOLO ESERCIZI
- Quale legame in ciascuna delle seguenti coppie di legami è il più forte? (a)
 o
o 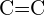 b)
b) 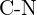 o
o 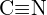 c)
c) 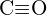 o
o 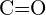 d)
d) 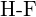 o
o 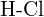 e)
e) 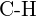 o
o 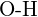 f)
f) 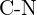 o
o 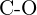
- Utilizzando le energie di legame nella tabella, determinare la variazione entalpica approssimativa per ciascuna delle seguenti reazioni: (a)
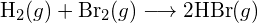 (b)
(b) 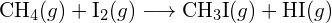 (c)
(c) 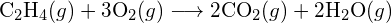 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Utilizzando le energie di legame nella tabella, determina la variazione entalpica approssimativa per ciascuna delle seguenti reazioni: (a)
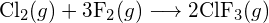 (b)
(b) 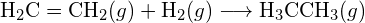 (c)
(c) 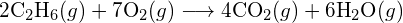
- Disegna una curva che descriva l’energia di un sistema con atomi di H e Cl a distanze variabili. Poi, trova l’energia minima di questa curva in due modi.(a) Usa l’energia di legame trovata nelle tabelle per calcolare l’energia per un singolo
 (Suggerimento: quanti legami ci sono in una mole?)(b) Usa l’entalpia di reazione e le energie di legame per H2 e Cl2 per risolvere l’energia di una mole di
(Suggerimento: quanti legami ci sono in una mole?)(b) Usa l’entalpia di reazione e le energie di legame per H2 e Cl2 per risolvere l’energia di una mole di 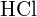 legami.
legami.
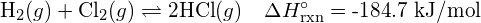
Spiega perché i legami avvengono a distanze di legame medie specifiche invece di avvicinare infinitamente gli atomi tra loro.
La distanza di legame media specifica è la distanza con l’energia più bassa. A distanze inferiori alla distanza di legame, le cariche positive sui due nuclei si respingono a vicenda, e l’energia complessiva aumenta. - Quando una molecola può formare due strutture diverse, la struttura con i legami più forti è solitamente la forma più stabile. Usa le energie di legame per prevedere la struttura corretta della molecola di idrossilammina:
 L’energia di legame maggiore è nella figura a sinistra. È la forma più stabile.
L’energia di legame maggiore è nella figura a sinistra. È la forma più stabile. - Come fa l’energia di legame di
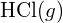 differisce dall’entalpia standard di formazione di
differisce dall’entalpia standard di formazione di 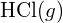 ?
? - Utilizzando i dati dell’entalpia standard di formazione nell’appendice G, mostra come l’entalpia standard di formazione di
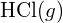 possa essere usata per determinare l’energia di legame.
possa essere usata per determinare l’energia di legame.
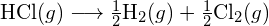
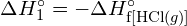
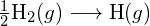
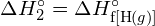
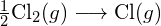
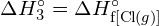
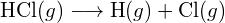
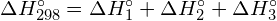
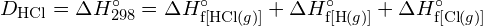
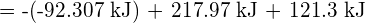
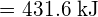
- Utilizzando i dati dell’entalpia standard di formazione in Appendice G, calcola l’energia di legame del doppio legame carbonio-zolfo in
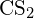 .
. - Utilizzando i dati dell’entalpia standard di formazione in Appendice G, determina quale legame è più forte: il legame S-F in
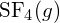 o in
o in 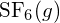 ?
Il legame S-F in
?
Il legame S-F in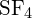 è più forte.
è più forte. - Utilizzando i dati dell’entalpia standard di formazione in Appendice G, determinare quale legame è più forte: il legame P-Cl in
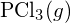 o in
o in 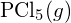 ?
? - Completa la seguente struttura di Lewis aggiungendo legami (non atomi), e poi indica il legame più lungo:

 I legami singoli C-C sono più lunghi.
I legami singoli C-C sono più lunghi. - Utilizza l’energia di legame per calcolare un valore approssimativo di ΔH per la seguente reazione. Qual è la forma più stabile di
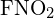 ?
? 
- Usa i principi della struttura atomica per rispondere a ciascuna delle seguenti domande:1 (a) Il raggio dell’atomo di Ca è 197 pm; il raggio dello ione
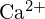 è 99 pm. Dai conto della differenza. (b) L’energia di reticolo di
è 99 pm. Dai conto della differenza. (b) L’energia di reticolo di 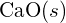 è -3460 kJ/mol; l’energia di reticolo di
è -3460 kJ/mol; l’energia di reticolo di 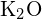 è -2240 kJ/mol. Rendete conto della differenza. (c) Dati questi valori di ionizzazione, spiega la differenza tra Ca e K riguardo alle loro energie di prima e seconda ionizzazione.
è -2240 kJ/mol. Rendete conto della differenza. (c) Dati questi valori di ionizzazione, spiega la differenza tra Ca e K riguardo alle loro energie di prima e seconda ionizzazione.
Elemento Prima energia di ionizzazione (kJ/mol) Seconda energia di ionizzazione (kJ/mol) K 419 3050 Ca 590 1140 (d) L’energia di prima ionizzazione di Mg è 738 kJ/mol e quella di Al è 578 kJ/mol. Spiega questa differenza.
(a) Quando due elettroni vengono rimossi dal guscio di valenza, il raggio di Ca perde il livello energetico più esterno e ritorna al livello inferiore n = 3, che è molto più piccolo in raggio.(b) La carica +2 sul calcio tira l’ossigeno molto più vicino rispetto a K, aumentando così l’energia del reticolo rispetto a uno ione meno carico.
(c) La rimozione dell’elettrone 4s in Ca richiede più energia della rimozione dell’elettrone 4s in K a causa della più forte attrazione del nucleo e dell’energia extra richiesta per rompere l’accoppiamento degli elettroni. La seconda energia di ionizzazione per K richiede che un elettrone sia rimosso da un livello energetico più basso, dove l’attrazione è molto più forte dal nucleo per l’elettrone. Inoltre, è necessaria energia per disaccoppiare due elettroni in un orbitale completo. Per Ca, il secondo potenziale di ionizzazione richiede la rimozione solo di un elettrone solitario nel livello energetico esterno esposto.
(d) In Al, l’elettrone rimosso è relativamente non protetto e non accoppiato in un orbitale p. L’energia più alta per il Mg riflette principalmente il disaccoppiamento dell’elettrone 2s.
- Per quale delle seguenti sostanze è richiesta la minore energia per convertire una mole del solido in ioni separati? (a)
 b)
b) 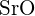 c)
c) 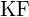 d)
d) 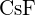 (e)
(e) 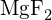 (d)
(d) - La reazione di un metallo,
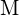 , con un alogeno,
, con un alogeno, 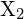 , procede con una reazione esotermica come indicato da questa equazione:
, procede con una reazione esotermica come indicato da questa equazione: 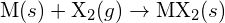 . Per ciascuna delle seguenti, indica quale opzione renderà la reazione più esotermica. Spiega le tue risposte. (a) un raggio grande contro un raggio piccolo per
. Per ciascuna delle seguenti, indica quale opzione renderà la reazione più esotermica. Spiega le tue risposte. (a) un raggio grande contro un raggio piccolo per 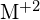 (b) un’alta energia di ionizzazione contro una bassa energia di ionizzazione per
(b) un’alta energia di ionizzazione contro una bassa energia di ionizzazione per 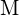 (c) un’energia di legame crescente per l’alogeno (d) un’affinità elettronica decrescente per l’alogeno (e) una dimensione crescente dell’anione formato dall’alogeno
(c) un’energia di legame crescente per l’alogeno (d) un’affinità elettronica decrescente per l’alogeno (e) una dimensione crescente dell’anione formato dall’alogeno - L’energia reticolare di
 è di 1023 kJ/mol, e la distanza Li-F è di 201 pm.
è di 1023 kJ/mol, e la distanza Li-F è di 201 pm.  cristallizza nella stessa struttura di
cristallizza nella stessa struttura di  ma con una distanza Mg-O di 205 pm. Quale dei seguenti valori approssima maggiormente l’energia di reticolo di
ma con una distanza Mg-O di 205 pm. Quale dei seguenti valori approssima maggiormente l’energia di reticolo di  : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, o 4008 kJ/mol? Spiega la tua scelta.
4008 kJ/mol; entrambi gli ioni in
: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, o 4008 kJ/mol? Spiega la tua scelta.
4008 kJ/mol; entrambi gli ioni in hanno il doppio della carica degli ioni in
hanno il doppio della carica degli ioni in  ; la lunghezza del legame è molto simile ed entrambi hanno la stessa struttura; ci si aspetta una quadruplicazione dell’energia in base all’equazione per l’energia di reticolo
; la lunghezza del legame è molto simile ed entrambi hanno la stessa struttura; ci si aspetta una quadruplicazione dell’energia in base all’equazione per l’energia di reticolo - Quale composto in ciascuna delle seguenti coppie ha l’energia di reticolo maggiore? Nota:
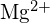 e
e 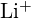 hanno raggi simili;
hanno raggi simili; 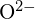 e
e 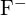 hanno raggi simili. Spiega le tue scelte. (a)
hanno raggi simili. Spiega le tue scelte. (a)  o
o 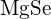 (b)
(b)  o
o  (c)
(c) 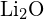 o
o 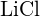 d)
d) 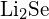 o
o 
- Quale composto in ciascuna delle seguenti coppie ha l’energia di reticolo maggiore? Nota:
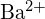 e
e 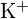 hanno raggi simili;
hanno raggi simili; 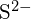 e
e 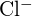 hanno raggi simili. Spiega le tue scelte. (a)
hanno raggi simili. Spiega le tue scelte. (a) 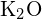 o
o 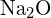 b)
b) 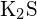 o
o  c)
c) 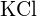 o
o  d)
d)  o
o 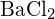 (a)
(a)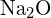 ;
; 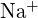 ha un raggio minore di
ha un raggio minore di 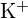 ; (b)
; (b)  ;
; 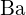 ha una carica maggiore di
ha una carica maggiore di 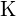 ; (c)
; (c)  ;
; 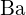 e
e 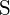 hanno cariche maggiori; (d)
hanno cariche maggiori; (d)  ;
; 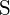 ha una carica maggiore
ha una carica maggiore - Quale dei seguenti composti richiede più energia per convertire una mole del solido in ioni separati? (a)
 (b)
(b) 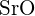 c)
c) 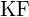 d)
d) 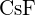 (e)
(e) 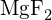
- Quale dei seguenti composti richiede più energia per convertire una mole del solido in ioni separati? (a)
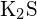 b)
b) 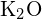 (c)
(c) 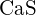 (d)
(d) 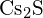 (e)
(e) 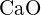 (e)
(e)
Note
- 1 Questa domanda è tratta dal Chemistry Advanced Placement Examination ed è usata con il permesso dell’Educational Testing Service.
Glossario
energia di legame (anche, energia di dissociazione del legame) energia richiesta per rompere un legame covalente in una sostanza gassosa energia del reticolo (ΔHlattice) energia richiesta per separare una mole di un solido ionico nei suoi componenti ioni gassosi
energia richiesta per separare una mole di un solido ionico nei suoi componenti ioni gassosi
