Quando un gas in flusso costante passa attraverso una costrizione, ad esempio, in un orifizio o una valvola, normalmente sperimenta un cambiamento di temperatura. Questo è in parte dovuto ai cambiamenti di energia cinetica, ma c’è un’altra parte che contribuisce alla non idealità del gas. Se i condotti a monte e a valle sono sufficientemente grandi perché l’energia cinetica sia trascurabile in queste stazioni, le temperature a monte e a valle sono misurate abbastanza lontano dal disturbo creato dalla costrizione e il sistema è adiabatico; l’effetto misurato è dovuto solo alla nonidealità. Dalla prima legge della termodinamica, un tale processo è isenthalpico e si può utilmente definire un coefficiente Joule-Thomson come:
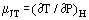
come una misura del cambiamento di temperatura che risulta da una caduta di pressione attraverso la costrizione.
Per la maggior parte dei gas reali alle condizioni ambientali circa, μ è positivo-cioè, la temperatura scende mentre passa attraverso la costrizione. Per l’idrogeno e l’elio, è negativo e la temperatura aumenta. A temperature più alte, per la maggior parte dei gas, μ scende e può anche diventare negativo, μ può anche diventare negativo attraverso l’applicazione della pressione, anche a temperatura ambiente, ma sono normalmente necessarie pressioni superiori a 200 bar per ottenere questo risultato.
.
