La circolazione uterina è squisitamente sensibile alla stimolazione estrogenica, rispondendo con un grado di vasodilatazione ineguagliato da qualsiasi altro organo del corpo a qualsiasi altro stimolo.2 Durante il ciclo ovarico, modelli ripetitivi di UBF si verificano riflettendo l’effetto della secrezione di estrogeni e gli effetti modulanti del progesterone. Questi modelli ciclici sono dimostrati più drammaticamente in animali con brevi fasi del ciclo preovulatorio, come la mucca, la scrofa e la pecora, e sono illustrati nella Figura 1 con i livelli periferici di estrogeni e progesterone.3, 4, 5 Dopo il concepimento in queste specie, i modelli UBF sono simili a quelli in animali non gravidi fino alla interdigitazione dei tessuti materni e fetali si verifica 17 a 28 giorni dopo, poi, c’è un aumento definitivo e progressivo in UBF che continua fino alla gravidanza termine. Poiché l’erosione dell’endometrio da parte del trofoblasto fetale si verifica molto prima dopo il concepimento nel primate, è ragionevole presumere che l’UBF aumenta prima in queste specie, anche se tali risposte non sono mai state osservate. I modelli generali di UBF totale, UBF per unità di peso dell’utero e del suo contenuto, la frazione di UBF che fornisce la placenta e il peso fetale durante la gravidanza ovina sono illustrati nella Figura 2. Il periodo tra 17 e 70 giorni di gestazione è associato con i cambiamenti più rapidi in UBF e PBF e corrisponde al momento della placentazione definitiva in questa specie. Con meccanismi non ancora compresi, i vasi sanguigni che riforniscono la placenta si dilatano progressivamente in questo periodo, causando contemporaneamente un aumento assoluto di UBF totale e lo smistamento di questo sangue dai tessuti non placentari a quelli placentari.* Con la successiva maturazione placentare, la frazione di UBF che fornisce la placenta e la quantità assoluta di PBF aumentano, ma a tassi più simili a quelli della crescita fetale; così, durante l’ultima metà della gravidanza, UBF per unità di peso di utero e il suo contenuto è sostanzialmente costante. Durante questo stesso periodo, la quantità di ossigeno estratta da ogni millilitro di sangue è costante e quindi anche la quantità di ossigeno erogata per un dato peso di utero gravidico è costante.6 Studi correlati nelle donne indicano modelli omeostatici simili da 10 a 40 settimane di gestazione e un consumo di ossigeno simile (circa 10 ml/kg).7 Poiché le donne erogano la stessa quantità di ossigeno a tassi UBF inferiori rispetto alla pecora (~150 contro ~270 ml/kg), ne consegue che la placenta umana è più efficiente in questo senso. Così, per i feti di peso simile, meno UBF assoluto è richiesto e il carico della gravidanza sul cuore è diminuito.
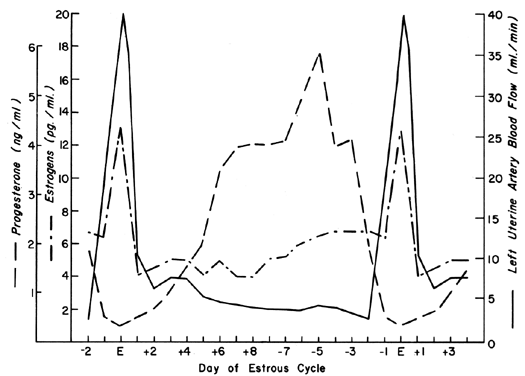 Fig. 1. Figura 1. Schema del flusso sanguigno uterino unilaterale durante il ciclo estrale ovino mostrato con i livelli sierici riportati di estrogeni e progesterone.(Adattato da Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
Fig. 1. Figura 1. Schema del flusso sanguigno uterino unilaterale durante il ciclo estrale ovino mostrato con i livelli sierici riportati di estrogeni e progesterone.(Adattato da Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
 Fig. 2. Modelli longitudinali del flusso sanguigno uterino e la sua distribuzione durante la gravidanza ovina.
Fig. 2. Modelli longitudinali del flusso sanguigno uterino e la sua distribuzione durante la gravidanza ovina.
I cambiamenti nel PBF sono realizzati da una vasodilatazione sempre maggiore dei vasi sanguigni che forniscono la placenta durante il corso della gestazione. Tuttavia, in qualsiasi momento durante il secondo e terzo trimestre, essenzialmente nessun ulteriore vasodilatazione acuta di questi vasi può verificarsi. Pertanto, per mantenere costante l’erogazione di ossigeno durante gli episodi di PBF ridotto, una maggiore estrazione di ossigeno deve verificarsi (Fig. 3). Sulla base dei dati riportati, sembrerebbe che il limite dell’aumento dell’estrazione sia doppio. Quindi, il PBF deve essere ridotto più del 50% prima che l’erogazione di ossigeno diminuisca. Queste considerazioni presuppongono che il tasso di PBF omeostatico fosse ottimale prima della riduzione del flusso. Sappiamo, tuttavia, che i livelli omeostatici possono essere subottimali sia sub-acutamente, come nella tossiemia, sia cronicamente, come nelle nefropatie. In questi casi, il fattore di sicurezza, cioè la percentuale che PBF può essere ridotto prima che l’erogazione di ossigeno è compromessa, è abbassato. Questo deve essere sempre considerato quando si valuta l’effetto di uno stimolo acuto sul feto.
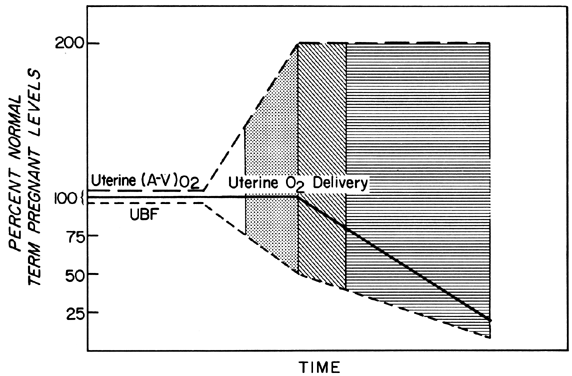 Fig. 3. Cambiamenti nell’estrazione di ossigeno arterovenosa uterina – (A-V)02 – in risposta alle riduzioni del flusso sanguigno uterino durante la seconda metà della gestazione ovina. Poiché (A-V)02 può essere raddoppiato, l’erogazione di 02 uterino sarà mantenuto a livelli omeostatici fino a quando il flusso sanguigno uterino è ridotto più del 50%. Le aree chiare, punteggiate e foderate indicano gradi ipotetici di riserva fetale quando definiti in funzione del flusso sanguigno placentare ottimale e sono usati per indicare livelli simili di riserva fetale nelle illustrazioni successive. (Adattato da Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
Fig. 3. Cambiamenti nell’estrazione di ossigeno arterovenosa uterina – (A-V)02 – in risposta alle riduzioni del flusso sanguigno uterino durante la seconda metà della gestazione ovina. Poiché (A-V)02 può essere raddoppiato, l’erogazione di 02 uterino sarà mantenuto a livelli omeostatici fino a quando il flusso sanguigno uterino è ridotto più del 50%. Le aree chiare, punteggiate e foderate indicano gradi ipotetici di riserva fetale quando definiti in funzione del flusso sanguigno placentare ottimale e sono usati per indicare livelli simili di riserva fetale nelle illustrazioni successive. (Adattato da Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
*Nell’uomo e nei primati subumani, le arteriole a spirale che riforniranno lo spazio intervilloso (circa una per cotiledone placentare) perdono le loro connessioni capillari e si dilatano di circa dieci volte come risultato della sostituzione delle pareti dei vasi con il trofoblasto. Questo processo può estendersi a o sotto la giunzione mioendometriale, trasformando letteralmente le arteriole a spirale in arterie a spirale. Il sangue che scorre attraverso questi vasi sanguigni modificati nello spazio intervilloso comprende il PBF.
Nella specie ovina, nello stato non gravidico sono presenti più aree discrete di endometrio chiamate caruncole. Durante la gravidanza, l’interdigitazione dei tessuti fetali e materni si verifica in questi caruncoli, che si allargano per diventare cotiledoni placentari individuali. Il sangue che scorre in queste aree comprende collettivamente il PBF. Anche se i vasi sanguigni arteriosi cotiledonari si dilatano notevolmente, non contengono elementi trofoblastici, il trasferimento materno-fetale avviene tramite un’interfaccia capillare-capillare, e non è presente alcuno spazio intervilloso.
Risposte dinamiche della circolazione uterina
I vasi sanguigni dell’utero non gravido rispondono in modo simile a quelli di qualsiasi altro organo muscolare con l’eccezione della loro reattività unica alla stimolazione estrogenica, la loro risposta agli agenti anestetici locali e, eventualmente, la loro risposta alle prostaglandine (Tabella 1). Durante la gravidanza, i vasi sanguigni che riforniscono la placenta si dilatano progressivamente, raggiungendo uno stato in cui la dilatazione acuta è minima o nulla.24 Pertanto, gli stimoli che evocano la vasodilatazione nell’utero non gravido sono inefficaci dopo la placentazione definitiva. Tuttavia, i vasi placentari mantengono la loro capacità di vasocostrizione come nello stato non gravidico. Dal momento che PBF si avvicina 80% al 90% del totale UBF a termine gravidanza, risposte vascolari uterine totali apparirà come quelli dei vasi placentari. Questo punto è spesso mal interpretato, e si deve ricordare che le risposte dei vasi non placentari sono le stesse se la gravidanza è presente o no.
TABELLA 1. Risposte dei vasi uterini non gravidi*
|
Vasocostrizione |
Vasodilatazione |
|
α-Stimolazione adrenergica |
Stimolazioneβ-adrenergica |
|
(dopamina, epinefrina, |
(isoproterenolo, epinefrina)8,9,16 |
|
norepinefrina)8,9,10 |
Acetilcolina e agenti parasimpaticomimetici23 |
|
Simpaticomimetici agenti11 |
Adenosine17 |
|
(farmaci vasopressori) |
Bradichinina17,18 |
|
Ipossiemia (grave)12 |
Cianuro19 |
|
Anestetici locali |
Sostanze estrogeniche |
|
(somministrazione intra-arteriosa)13,14 |
(effetto ritardato ma prolungato)2 |
|
Nicotina |
Glucosamina |
|
(mediazione α-adrenergica)15 |
(? effetto osmotico)21 |
|
Ipossiemia (lieve)12 |
|
|
Ischemia19 |
|
|
Nitroglicerina19 |
|
|
Prostaglandine E1, E2 e I18,22 |
|
|
Polipeptide intestinale vasoattivo20 |
* La marcata dilatazione dei vasi sanguigni che alimentano la placenta e la preponderante distribuzione del flusso sanguigno uterino alla placenta obliterano le risposte gravidiche; quindi gli effetti degli stimoli vasodilatatori durante la gravidanza sono controversi. Quando testate, le risposte vascolari non placentari sono simili alle risposte non gravide.
La struttura emocoriale della placenta umana aggiunge un fattore unico a quelli che normalmente controllano il flusso sanguigno in altri letti vascolari. Cioè, il sangue attraversa le arterie a spirale per entrare nello spazio intervilloso simile a una palude, perfonde i villi fetali e poi ritorna alla circolazione generale attraverso molte vene di raccolta nella placca basale. In effetti, il sangue lascia i normali canali vascolari per circolare in un nuovo spazio extravascolare innestato nell’utero per la durata della gravidanza. Poiché lo spazio intervilloso si trova all’interno della cavità uterina e poiché la placenta è una struttura flessibile, la pressione generata dalla contrazione del miometrio sarà trasmessa in egual misura alla cavità amniotica e allo spazio intervilloso. Quindi, un fattore estraneo al normale controllo vascolare, l’attività miometriale, può cambiare la pressione dello spazio intervilloso e influenzare la PBF attraverso i suoi effetti sulla pressione di perfusione. Una rappresentazione schematica del flusso sanguigno ai tessuti non placentari e a un singolo cotiledone è mostrata nella Figura 4, insieme alle formule pertinenti al controllo di ciascuno. Va notato che queste formule sono solo applicazioni della legge di Ohm a queste singole situazioni cardiovascolari.
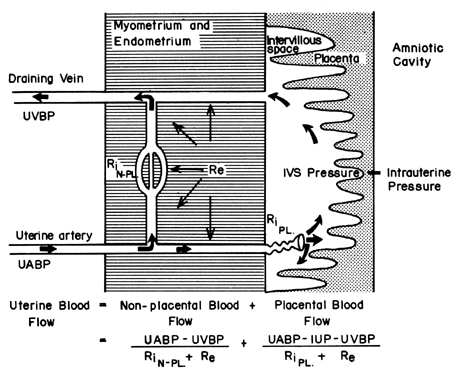 Fig. 4. Circolazione non placentare e placentare e i fattori che influenzano ciascuno dell’utero dei primati. La relazione tra questi fattori e il flusso sanguigno distributivo è definita nell’equazione di accompagnamento. UABP, pressione sanguigna arteriosa uterina; UVBP, pressione sanguigna venosa uterina; Re, resistenza vascolare estrinseca; RiN-PL e RiPL, resistenza vascolare intrinseca causata dalla reattività delle arteriole non placentari e placentari, rispettivamente.(Da Greiss FC, Jr: MCV/Q, 8:52, 1972.)
Fig. 4. Circolazione non placentare e placentare e i fattori che influenzano ciascuno dell’utero dei primati. La relazione tra questi fattori e il flusso sanguigno distributivo è definita nell’equazione di accompagnamento. UABP, pressione sanguigna arteriosa uterina; UVBP, pressione sanguigna venosa uterina; Re, resistenza vascolare estrinseca; RiN-PL e RiPL, resistenza vascolare intrinseca causata dalla reattività delle arteriole non placentari e placentari, rispettivamente.(Da Greiss FC, Jr: MCV/Q, 8:52, 1972.)
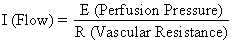
La pressione di perfusione che porta il sangue ai tessuti non placentari è la differenza tra la pressione arteriosa e venosa uterina. Tuttavia, la pressione di perfusione che porta il sangue allo spazio intervilloso è la differenza tra la pressione del sangue arterioso uterino e la pressione dello spazio intervilloso. Quest’ultima è meglio approssimata dalla pressione del liquido amniotico (IUP). In un organo muscolare, i fattori di resistenza includono la resistenza derivante dalla reattività della muscolatura liscia vascolare, o resistenza intrinseca (Ri), e la compressione impartita ai vasi sanguigni mentre attraversano il miometrio in contrazione, o resistenza estrinseca (Re). Dovrebbe essere evidente quindi che le contrazioni uterine possono influenzare il PBF con due meccanismi: aumentando Re e riducendo la pressione di perfusione placentare.
Nella pratica clinica, tre caratteristiche principali del controllo vascolare placentare sono importanti. Queste includono la relazione tra pressione di perfusione e flusso, le risposte delle arterie spirali agli stimoli vasoattivi e gli effetti delle contrazioni miometriali. Inoltre, gli effetti unici degli agenti anestetici locali devono essere apprezzati.
Rapporto pressione-flusso
Quando si osservano i cambiamenti in UBF secondari alle riduzioni della pressione di perfusione durante la quiescenza del mioma-triale, si può sviluppare un rapporto a linea retta con una pendenza di uno (Fig. 5). Questo riflette la natura ampiamente dilatata della vascolarizzazione placentare e indica che PBF diminuirà quasi in proporzione identica alla diminuzione della pressione di perfusione. Poiché la pressione venosa uterina è abbastanza costante nella maggior parte delle circostanze, i cambiamenti nella pressione sanguigna sistemica (MBP) possono essere utilizzati per approssimare i cambiamenti PBF. Cioè, una diminuzione del 25% della pressione arteriosa media dovrebbe causare una diminuzione del 25% della PBF. Tali misurazioni dovrebbero essere effettuate in posizione di decubito laterale, tuttavia, poiché la pressione dell’utero gravidico sull’aorta da solo ha dimostrato di diminuire la pressione sanguigna nella zona pelvica al di sotto di quella osservata nell’arteria brachiale.
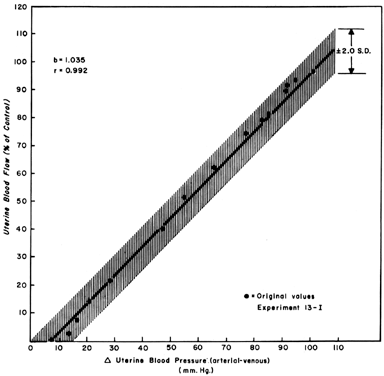 Fig. 5. Linea di regressione pressione-flusso determinata dai dati proporzionali raggruppati in pecore gravide a termine. Poiché la relazione è lineare, il flusso sanguigno uterino varierà con e in proporzione a qualsiasi cambiamento nella pressione di perfusione.(Da Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Fig. 5. Linea di regressione pressione-flusso determinata dai dati proporzionali raggruppati in pecore gravide a termine. Poiché la relazione è lineare, il flusso sanguigno uterino varierà con e in proporzione a qualsiasi cambiamento nella pressione di perfusione.(Da Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Risposte agli stimoli vasodilatatori
Siccome le arterie spirali raggiungono la massima dilatazione nello stato di riposo, gli agenti o stimoli vasodilatatori hanno poco o nessun effetto anche se i recettori per tali agenti sono presenti. Tuttavia, i muscoli lisci di questi vasi sono squisitamente sensibili agli agenti o agli stimoli vasocostrittori, più della maggior parte degli altri letti vascolari periferici (Fig. 6). Questo significa che anche se MPB può aumentare in risposta alla stimolazione di un farmaco vasopressore ad azione periferica come la fenilefrina, l’aumento proporzionale della resistenza vascolare placentare (Ri) è così tanto maggiore che l’effetto netto è una marcata diminuzione del PBF. Queste differenze nella sensibilità dei vasocostrittori devono essere considerate ogni volta che viene indicato un farmaco vasopressore. L’uso di un farmaco ad azione più centrale come l’efedrina, pur causando una piccola quantità di vasocostrizione placentare, si tradurrà in un miglioramento proporzionalmente maggiore in MBP con un aumento assoluto in PBF.
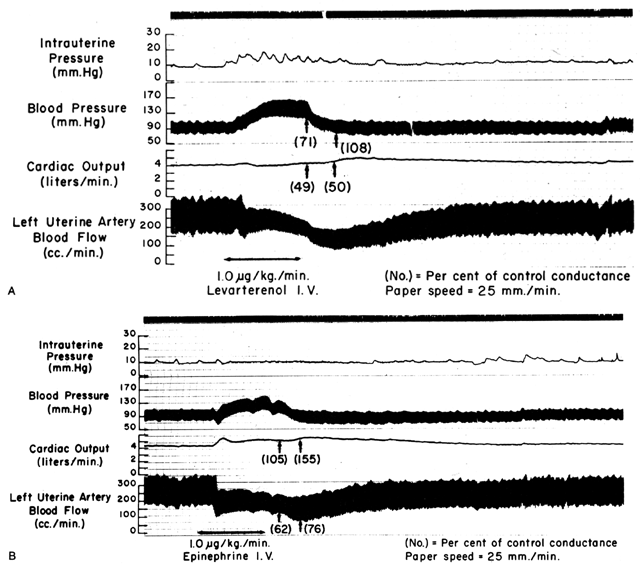 Fig. 6. Registrazioni originali che mostrano gli effetti del levarterenolo (norepinefrina) e dell’epinefrina per via endovenosa (A) sulla pressione sanguigna materna, sulla gittata cardiaca e sul flusso sanguigno uterino nella gravidanza ovina a termine. I cambiamenti proporzionali dai livelli di controllo della conduttanza sistemica e uterina (il reciproco della resistenza) sono stati inseriti tra parentesi. Si noti che la diminuzione della conduttanza uterina (aumento della resistenza) supera quella della conduttanza sistemica con altri agenti. (Da Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Per gentile concessione di Harper & Row, Publishers.)
Fig. 6. Registrazioni originali che mostrano gli effetti del levarterenolo (norepinefrina) e dell’epinefrina per via endovenosa (A) sulla pressione sanguigna materna, sulla gittata cardiaca e sul flusso sanguigno uterino nella gravidanza ovina a termine. I cambiamenti proporzionali dai livelli di controllo della conduttanza sistemica e uterina (il reciproco della resistenza) sono stati inseriti tra parentesi. Si noti che la diminuzione della conduttanza uterina (aumento della resistenza) supera quella della conduttanza sistemica con altri agenti. (Da Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Per gentile concessione di Harper & Row, Publishers.)
Contrazioni miometriali
Agendo attraverso i due meccanismi discussi sopra, aumentando Re e diminuendo la pressione di perfusione, le contrazioni miometriali diminuiscono PBF in proporzione diretta all’intensità e alla durata di ogni contrazione. La relazione è così precisa che un tracciato della pressione intrauterina è quasi un’immagine inversa esatta del PBF (Fig. 7). L’aumento della frequenza delle contrazioni diminuisce la PBF durante una data unità di tempo, diminuendo la durata della diastole miometriale, il tempo in cui la PBF è a livelli omeostatici. Inoltre, se il tono di intercontrazione è elevato, come in un distacco della placenta, il PBF di intercontrazione sarà proporzionalmente ridotto. Studi radioangiografici nei primati subumani e nelle donne mostrano che durante l’acme delle contrazioni miometriali di media intensità, il PBF cessa.25 È evidente quindi che il travaglio è intrinsecamente stressante per il feto, poiché la quantità media di PBF che perfonde i villi fetali per un dato periodo di tempo diminuisce progressivamente all’aumentare della frequenza e dell’intensità delle contrazioni uterine.
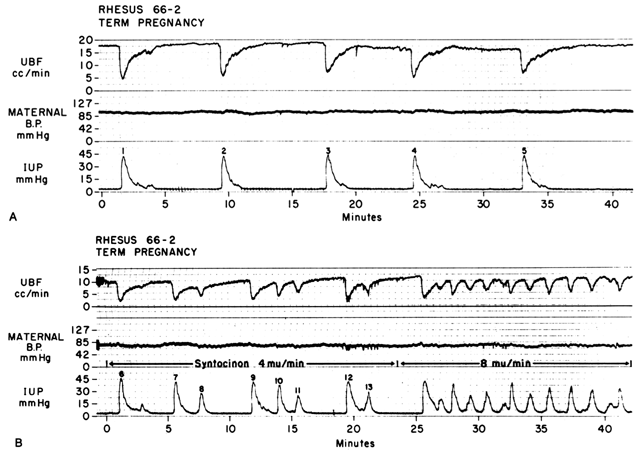 Fig. 7. A. Relazione tra il flusso di sangue uterino (UBF) e contrazioni uterine durante il travaglio spontaneo in una scimmia rhesus. Si noti la relazione immagine inversa, forti diminuzioni in UBF all’inizio delle contrazioni, e più lento recupero di UBF di livelli basali. UBF riguadagnato livelli basali solo durante il tono “normale”. B. Effetto di una maggiore frequenza delle contrazioni su UBF prodotto dalla stimolazione ossitocina del travaglio spontaneo mostrato in A. Si noti che la durata delle fasi di tono normale è diminuita. UBF tasso raggiunto tra le contrazioni dipende dall’intensità della contrazione precedente e la durata della fase di tono normale. Dopo le contrazioni 7 e 12, il recupero del flusso era incompleto perché la contrazione successiva avveniva senza una fase di tono normale.(Da Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Per gentile concessione di Harper & Row, Publishers.)
Fig. 7. A. Relazione tra il flusso di sangue uterino (UBF) e contrazioni uterine durante il travaglio spontaneo in una scimmia rhesus. Si noti la relazione immagine inversa, forti diminuzioni in UBF all’inizio delle contrazioni, e più lento recupero di UBF di livelli basali. UBF riguadagnato livelli basali solo durante il tono “normale”. B. Effetto di una maggiore frequenza delle contrazioni su UBF prodotto dalla stimolazione ossitocina del travaglio spontaneo mostrato in A. Si noti che la durata delle fasi di tono normale è diminuita. UBF tasso raggiunto tra le contrazioni dipende dall’intensità della contrazione precedente e la durata della fase di tono normale. Dopo le contrazioni 7 e 12, il recupero del flusso era incompleto perché la contrazione successiva avveniva senza una fase di tono normale.(Da Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Per gentile concessione di Harper & Row, Publishers.)
Agenti anestetici locali
Questi farmaci possono esercitare effetti su un letto vascolare direttamente, come dopo un’iniezione intravascolare involontaria, e indirettamente, come risultato della paralisi dei nervi autonomi che mantengono il normale tono vascolare. Nella maggior parte degli organi, le iniezioni intravascolari non hanno effetti significativi sulla resistenza vascolare. Tuttavia, i vasi uterini e placentari rispondono a tali stimoli con una significativa vasocostrizione. Inoltre, il miometrio è variabilmente stimolato da tali farmaci (Fig. 8). Da sole o insieme, queste risposte diminuiscono PBF. In seguito all’anestesia di blocco paracervicale somministrata durante il travaglio, può verificarsi una bradicardia fetale ritardata. L’ipotesi migliore per spiegare la risposta fetale è che gli agenti anestetici locali sono iniettati vicino alle arterie uterine e che a causa della loro eccellente penetrazione, attraversano le pareti arteriose per causare i loro effetti uterini diminuendo il PBF e causando l’ipossia fetale.
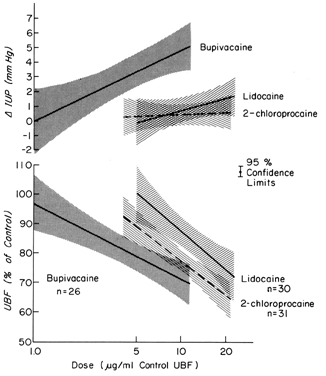 Fig. 8. Relazioni dose-risposta di agenti anestetici locali somministrati direttamente nell’arteria uterina alla conduttanza vascolare uterina e alla pressione intrauterina durante la gestazione ovina. I livelli di dose efficace sono all’interno degli intervalli osservati nei feti durante la bradicardia dopo l’anestesia del blocco paracervicale.(Da Fishburne JI, Jr et al: Risposte della vascolatura uterina gravidica ai livelli arteriosi di agenti anestetici locali. Am J Obstet Gynecol 133:753, 1979. Per gentile concessione di The C. V. Mosby Company.)
Fig. 8. Relazioni dose-risposta di agenti anestetici locali somministrati direttamente nell’arteria uterina alla conduttanza vascolare uterina e alla pressione intrauterina durante la gestazione ovina. I livelli di dose efficace sono all’interno degli intervalli osservati nei feti durante la bradicardia dopo l’anestesia del blocco paracervicale.(Da Fishburne JI, Jr et al: Risposte della vascolatura uterina gravidica ai livelli arteriosi di agenti anestetici locali. Am J Obstet Gynecol 133:753, 1979. Per gentile concessione di The C. V. Mosby Company.)
.
