Descrizione
Corpo fruttifero: 8-30 cm di diametro, carnoso, bianco all’inizio, marrone chiaro o giallastro con l’età, pochi rami principali che nascono dalla base stretta, ogni ramo principale invia numerosi rami più piccoli, su cui pendono dense e affollate spine in file.Spine: cilindriche, appuntite all’apice, lunghe 0.5 – 1.5 cm.
Stampa delle spore: bianche.
Spore: incolori, lisce, da ellissoidi a subglobose, amiloidi, ialine, 5-8 x 4,5-6 µm.
Habitat: solitario o in gruppi, di solito su alberi morti di legno duro; saprobico; fine estate e autunno; comune.
Odore: indistinto.
Edibilità: commestibile.
Composti bioattivi
Un primo studio sui polisaccaridi isolati da questo fungo ha rivelato che si tratta di una molecola lineare contenente solo legami α-1,4 glucosidici. Inoltre, il polisaccaride differisce da quello delle piante superiori in quanto consiste solo di molecole di amilosio a catena corta (lunghe da 32 a 45 unità di glucosio), mentre nelle piante i polisaccaridi possono avere catene lunghe migliaia, a seconda della specie (McCracken e Dodd, 1971).
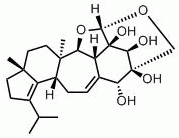
Esperimenti che utilizzano glucosio radiomarcato suggeriscono che il D-xyloside herical, isolato da colture di H. coralloides, si pensa sia un precursore nella sintesi delle molecole di cyathane-skeleton, compresa l’erinacina E, discussa di seguito. Herical è noto per inibire un ampio spettro di funghi e batteri e mostra proprietà citotossiche ed emolitiche (Anke et al., 2002).
Proprietà medicinali
Attività nematicida
Una miscela di acidi grassi nematicida è stata ottenuta da culture di H. coralloides. Questa miscela, che conteneva principalmente acidi linoleico, oleico e palmitico, ha mostrato effetti tossici verso Caenorhabditis elegans (Stadler et al., 1994).
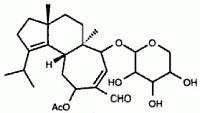
Nel 1998, un gruppo di ricerca Pfizer ha isolato l’erinacina E (vedi struttura sotto) dal brodo di fermentazione di H. coralloides (Saito et al., 1998). L’erinacina E è un agonista altamente selettivo al recettore oppioide κ (IC50 di 0,8 µM rispetto al legame al recettore oppioide µ, IC50 di >200 mM). Questa molecola è stata precedentemente isolata dai corpi fruttiferi di H. erinaceum, dove è stata riportata come un potente stimolatore della sintesi del fattore di crescita nervosa (Kawagishi et al., 1996). Gli stimolatori della sintesi del fattore di crescita nervosa sono studiati come potenziali farmaci per i disturbi neuronali degenerativi come il morbo di Alzheimer e la rigenerazione dei nervi periferici (Yamada et al., 1997). La sintesi totale di erinacina E è stata recentemente riportata (Watanabe e Nakada, 2008).
Links
Esperto di funghi
Funghi della Polonia
Funghi su legno
Anke T, Rabe U, Schu P, Eizenhofer T, Schrage M, Steglich W.
Studies on the biosynthesis of striatal-type diterpenoids and the biological activity of herical.
Z Naturforsch C. 2002 57(3-4):263-71.
Ginns J.
Hericium coralloides N. amer auct (Hericium americanum sp nov) and the European Hericium alpestre and Hericium coralloides.
Mycotaxon. 1984 20(1):39-43.
Hallenberg N.
Hericium coralloides e Hericium coralloides (basidiomiceti) in Europa.
Mycotaxon. 1983 18(1):181-9.
Kawagishi H, Shimada A, Hosokawa S, Mori H, Sakamoto H, Ishiguro Y, Sakemi S, Bordner J, Kojima N, Furukawa S.
Erinacines E, F, and G, stimulators of nerve growth factor (NGF)-synthesis, from the mycelia of Hericium erinaceum.
Tetra Lett. 1996 37(41):7399-402.
McCracken DA, Dodd JL.
Struttura molecolare di polisaccaridi di tipo amido da Hericium ramosum e Hericium coralloides.
Science. 1971 174(7):419.
Pubmed
Saito T, Aoki F, Hirai H, Inagaki T, Matsunaga Y, Sakakibara T, Sakemi S, Suzuki Y, Watanabe S, Suga O, Sujaku T, Smogowicz AA, Truesdell SJ, Wong JW, Nagahisa A, Kojima Y, Kojima N.
Erinacina E come agonista del recettore kappa oppioide e i suoi nuovi analoghi da un basidiomicete, Hericium ramosum.
J Antibiot. 1998 51(11):983-90.
Pubmed
Stadler M, Mayer A, Anke H, Sterner O.
Acidi grassi e altri composti con attività nematicida da culture di Basidiomiceti.
Planta Med. 1994 60(2):128-32.
Pubmed
Watanabe H, Nakada M.
Sintesi totale biomimetica di (-)-Erinacina E
J Am Chem Soc. 2008 130(4):1150-1.
Yamada K, Nitta A, Hasegawa T, Fuji K, Hiramatsu M, Kameyama T, Furukawa Y, Hayashi K, Nabeshima T.
Stimolatori della sintesi di NGF attivi per via orale: potenziali agenti terapeutici nella malattia di Alzheimer.
Behav Brain Res. 1997 83(1-2):117-22.
Pubmed
