INTRODUZIONE
La ricerca di base e clinica condotta negli ultimi anni ha stabilito una relazione diretta e bidirezionale tra malattia renale cronica e malattia cardiovascolare.1,2 Nella pratica clinica quotidiana, le concentrazioni di creatinina nel siero e la velocità di filtrazione glomerulare stimata con la formula Cockcroft-Gault3 o l’equazione Modification of Diet in Renal Disease (MDRD)4 sono comunemente utilizzate per stimare la funzione renale. Tuttavia, le concentrazioni plasmatiche di creatinina possono essere influenzate da una serie di fattori, come l’età del paziente, il sesso, la massa muscolare, l’attività fisica, la dieta e i farmaci.5
La cistatina C è una proteina inibitrice della cisteina proteasi che viene sintetizzata ad un tasso stabile da tutte le cellule nucleate. A causa del suo basso peso molecolare e dell’alto punto isoelettrico, può essere eliminata quasi esclusivamente per filtrazione glomerulare. Le concentrazioni di cistatina C non sono influenzate dall’età, dal sesso o dall’ingestione di proteine e sono sensibili a piccoli cambiamenti nella filtrazione glomerulare. A causa di queste caratteristiche, la concentrazione plasmatica di cistatina C è considerata tra i migliori marcatori dello stato di filtrazione glomerulare.6-9 Recentemente, diversi studi hanno riportato un’associazione tra valori elevati di cistatina C e lo sviluppo di complicazioni cardiovascolari in pazienti con malattia coronarica. Attualmente non è noto se questa relazione sia dovuta al fatto che la cistatina C è un miglior marcatore della funzione renale rispetto alla creatinina sierica o se vi siano fattori diversi dalla filtrazione glomerulare che influenzano la concentrazione di questa proteina e sono ulteriormente correlati al rischio cardiovascolare.10
Lo scopo di questo studio è stato quello di valutare il valore prognostico della concentrazione di cistatina C nel plasma in pazienti ricoverati per sindrome coronarica acuta (ACS) ad alto rischio, e di indagare la relazione tra la cistatina C e altri marcatori della funzione renale e dell’infiammazione.
METODI
Questo è uno studio prospettico e osservazionale eseguito tra maggio 2006 e luglio 2007. Sono stati inclusi 203 pazienti di età superiore ai 18 anni e ricoverati consecutivamente nell’unità di terapia intensiva cardiaca (ICU) del nostro centro con una diagnosi di ACS ad alto rischio.
I criteri diagnostici per l’ACS ad alto rischio includevano almeno 2 dei seguenti fattori: dolore con caratteristiche ischemiche, alterazioni elettrocardiografiche coerenti con l’ischemia e/o marcatori di necrosi miocardica elevati. Il trattamento fornito e i test aggiuntivi eseguiti durante la permanenza in ospedale del paziente si basavano sulle decisioni cliniche del medico curante. Nella maggior parte dei pazienti, è stata utilizzata una strategia invasiva che prevedeva un’angiografia coronarica urgente (per infarto miocardico con sopraslivellamento del segmento ST o blocco di branca sinistra) o un’angiografia coronarica programmata nelle prime 24-72 ore dopo il ricovero.
Caratteristiche cliniche
I seguenti dati sono stati registrati dalle cartelle cliniche dei pazienti: informazioni demografiche, presenza di fattori di rischio cardiovascolare classici (diabete mellito, ipertensione sistemica, dislipidemia e fumo) e storia di malattia vascolare nota (cardiopatia ischemica, malattia cerebrovascolare, malattia arteriosa periferica e precedente trattamento di rivascolarizzazione miocardica). Le altre variabili cliniche analizzate includevano il tipo di ACS, la classe Killip al momento del ricovero, i valori della pressione sistolica e diastolica, la pressione del polso (stimata come differenza tra la pressione arteriosa sistolica e diastolica) e la frequenza cardiaca.
Tutti i pazienti sono stati sottoposti a ecocardiografia, in cui la frazione di eiezione ventricolare sinistra è stata stimata con il metodo Simpson utilizzando un approccio a 4 camere; la media di 3 determinazioni è stata calcolata nei pazienti con ritmo sinusale, e la media di 5 determinazioni in quelli con fibrillazione atriale.
Nel 95% dei pazienti è stata eseguita un’angiografia coronarica e la gravità delle lesioni coronariche è stata valutata con un punteggio basato sul numero di arterie coronarie epicardiche interessate.
Dati analitici
I valori basali di emoglobina, ematocrito, leucociti, glucosio e creatinina sono stati registrati nelle prime analisi di laboratorio effettuate nel nostro centro al momento del ricovero. Le concentrazioni di colesterolo totale, colesterolo lipoproteico ad alta densità (HDL-C), colesterolo lipoproteico a bassa densità (LDL-C), glucosio, proteina C reattiva ad alta sensibilità e cistatina C sono state registrate nelle prime 24 ore, insieme al livello di picco della troponina I (TpI).
La cistatina C è stata misurata con un test immunologico omogeneo automatizzato utilizzando un nefelometro Dade-Behring BN ProSpec. Il reagente per l’analisi consisteva in particelle di polistirene rivestite con anticorpi contro la proteina che si agglutinano quando vengono mescolate con campioni contenenti cistatina C e disperdono la luce con un’intensità proporzionale alla concentrazione dell’analita.
L’intervallo di riferimento per la concentrazione di cistatina C nel siero degli adulti con il metodo nefelometrico utilizzato va da 0,51 a 0,95 mg/L. Le concentrazioni di proteina C-reattiva ad alta sensibilità sono state determinate anche tramite immunodosaggio. La velocità di filtrazione glomerulare è stata stimata con l’equazione MDRD.
Episodi analizzati
Le complicazioni cardiovascolari analizzate includevano la mortalità in ospedale, la mortalità per tutte le cause durante il follow-up, lo sviluppo di un nuovo infarto del miocardio, definito come dolore toracico o dolore anginoso equivalente con cambiamenti ECG, o marcatori di necrosi tumorale elevati durante le prime 24 ore dopo il ricovero (i pazienti con marcatori elevati dopo procedure di intervento coronarico sono stati esclusi), e lo sviluppo di insufficienza cardiaca durante il ricovero o follow-up.
Follow-up clinico
Il follow-up medio era di 186 (SD, 110; mediana, 156) giorni, durante i quali sono stati registrati tutti gli eventi clinici dei pazienti. Il follow-up è stato eseguito tramite contatto telefonico, in ambulatori, e tramite revisione delle cartelle cliniche dei pazienti.
Analisi statistica
Tutte le informazioni sono state registrate prospetticamente in un database creato con Microsoft Office Access 2003 SP2. Le analisi statistiche sono state eseguite con SPSS (Statistical Package for the Social Sciences), versione 12.0. Le variabili categoriche o dicotomiche sono espresse come valori assoluti e percentuali, e sono state confrontate con il test Pearson χ2. Le variabili continue con una distribuzione normale sono descritte come media (SD), e il test t di Student è stato utilizzato per i confronti tra gruppi. Le variabili che non presentavano una distribuzione gaussiana sono state confrontate con il test U di Mann-Whitney.
Il coefficiente di correlazione di Spearman è stato utilizzato per valutare le correlazioni della concentrazione di cistatina C con la proteina C-reattiva ad alta sensibilità e la velocità di filtrazione glomerulare. Un’analisi di regressione logistica è stata utilizzata per valutare il ruolo indipendente dei fattori clinici e di laboratorio rispetto alla cistatina C per prevedere lo sviluppo di complicazioni cardiovascolari durante il ricovero, includendo le variabili significative nell’analisi univariata. Sono stati presentati gli odds ratio aggiustati e gli intervalli di confidenza (CI) al 95%. Le curve di sopravvivenza Kaplan-Meier durante il follow-up sono state costruite e confrontate utilizzando il test di long-rank.
Per effettuare un’analisi descrittiva della popolazione studiata, alcune variabili quantitative sono state classificate in intervalli: la velocità di filtrazione glomerulare (>90, 90-60, 55% e 0,95 e
Un valore P inferiore a .05 è stato considerato statisticamente significativo.
RISULTATI
Dal maggio 2006 al luglio 2007, 203 pazienti ospedalizzati con una diagnosi di ACS ad alto rischio sono stati inclusi nello studio. L’età media era di 66,6 (13,16) anni. Tra il totale, il 62,1% dei pazienti (n=126) ha presentato ACS senza elevazione del segmento ST e il 37,9% (n=77), ACS con elevazione del segmento ST. Le caratteristiche di base della popolazione dello studio sono descritte nella tabella 1.
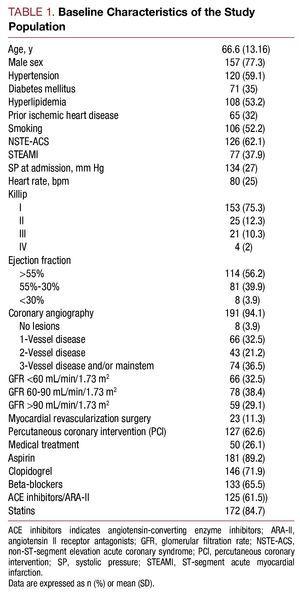
La concentrazione mediana di cistatina C era 1,01 (range, 0,83-1,35) mg/L, la creatinina plasmatica alla prima analisi effettuata era 1 (0.9-1,3) mg/L, la velocità di filtrazione glomerulare era 72,4 (49,12-93,73) mL/min/1,73 m2, e la proteina C reattiva ad alta sensibilità era 1,37 (0,46-5,02) mg/L. La filtrazione glomerulare al momento del ricovero era 2 nel 32,5% dei pazienti e la cistatina C sierica era >0,95 mg/L in 113 (55,7%) pazienti.
I pazienti con valori più alti di cistatina C presentavano un profilo clinico più povero, erano più anziani, avevano un’alta prevalenza di ipertensione, una classe Killip peggiore al momento del ricovero, una malattia coronarica più grave all’angiografia coronarica e valori più alti di creatinina plasmatica e proteina C reattiva (tabella 2).
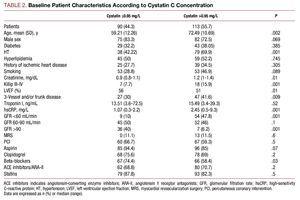
Non ci sono state differenze significative tra i 2 gruppi di cistatina C per quanto riguarda l’intervento coronarico eseguito; il risultato angiografico finale ha dato un tasso di successo simile e nessuna complicazione significativa (3,27% per i pazienti con cistatina C ≤0,95 e 4,09% nell’altro gruppo). L’analisi del trattamento farmacologico ha mostrato un uso sostanzialmente maggiore di beta-bloccanti e aspirina nel gruppo con cistatina C ≤0,95 (tabella 2).
I valori della cistatina C nel siero hanno mostrato una maggiore correlazione con la velocità di filtrazione glomerulare stimata (r=-0.655; P=.001) (Figura 1) rispetto alla microalbuminuria (r=0.302, P=.01) e una minore correlazione con la proteina C reattiva (r=0.29; P=.01).
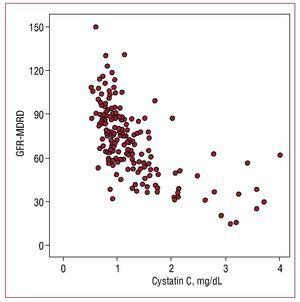
Figura 1. Correlazione tra i valori di cistatina C e la velocità di filtrazione glomerulare stimata con la formula MDRD (GFR-MDRD).
Nel gruppo di pazienti con valori di cistatina C >0,95, il 6,5% presentava velocità di filtrazione glomerulare normale e il 46%, velocità di filtrazione glomerulare tra 60 e 90 mL/min/1,73 m2. Inoltre, il 10% dei pazienti che avevano una disfunzione renale con un tasso di filtrazione di 2 aveva valori di cistatina C
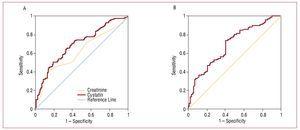
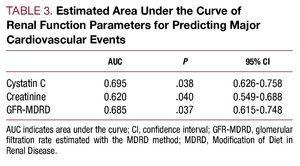
Figura 2. A, ROC di cistatina C e creatinina in relazione allo sviluppo di complicazioni cardiovascolari (insufficienza cardiaca, infarto e morte cardiovascolare). B, curva ROC della velocità di filtrazione glomerulare stimata con la MDRD in relazione allo sviluppo di complicazioni cardiovascolari (insufficienza cardiaca, infarto e morte cardiovascolare).
Il soggiorno in ospedale è durato in media 9 (6-19) giorni. Dal momento dell’ammissione al completamento del follow-up dello studio, 56 (27,58%) pazienti del campione complessivo hanno sviluppato un’insufficienza cardiaca, la maggior parte dei quali nel gruppo con valori elevati di cistatina C (45 pazienti). La mortalità intraospedaliera era significativamente più alta nel gruppo con valori elevati di cistatina C (17,6% vs 3,3%; P=.001), e queste differenze persistevano durante il follow-up (Figura 3, Tabella 4).
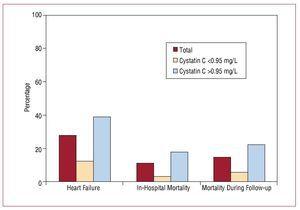
Figura 3. Associazione tra cistatina C 0,95 mg/L e lo sviluppo di eventi cardiovascolari in ospedale.

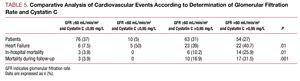
Nell’analisi univariata, non è stata osservata alcuna associazione tra le complicazioni cardiovascolari e il tipo di ACS, l’iperlipidemia o il picco di concentrazione di TpI, ma è stata trovata un’associazione con i restanti fattori di rischio cardiovascolare: numero di vasi colpiti, frazione di eiezione, marker di funzionalità renale, cistatina C e proteina C reattiva ad alta sensibilità. Quando sono stati analizzati i risultati dei pazienti con una velocità di filtrazione glomerulare di >60 mL/min/1,73 m2, abbiamo trovato che i pazienti con cistatina C >0.95 mg/L presentavano un tasso significativamente più alto di complicazioni cardiovascolari rispetto ai pazienti con filtrazione glomerulare >60 e cistatina C 60 e cistatina C
La sopravvivenza libera da eventi stimata (cioè, senza insufficienza cardiaca, infarto del miocardio o morte) dopo un follow-up medio di 186 giorni era significativamente più alta nel gruppo di pazienti con valori di cistatina ≤0.95 mg/L: 75% contro 44% (P=.02) (Figura 4).

Figura 4. Curve di Kaplan-Meier per stimare la probabilità di sopravvivenza libera da eventi cardiovascolari maggiori, secondo il valore della cistatina C.
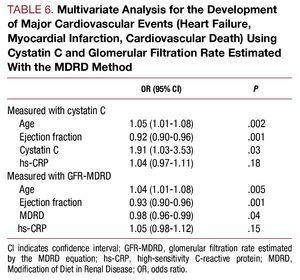
L’analisi multivariata ha identificato l’età, la frazione di eiezione e la concentrazione di cistatina C come fattori predittivi indipendenti di complicazioni cardiovascolari durante il ricovero (Tabella 6).
DISCUSSIONE
I risultati del presente studio indicano che valori elevati di cistatina C predicono lo sviluppo di insufficienza cardiaca in ospedale, infarto miocardico e morte cardiovascolare nei pazienti con ACS ad alto rischio, indipendentemente da altri fattori di rischio classici. Inoltre, il valore della cistatina C nel plasma può avere una maggiore capacità di stratificare i pazienti ad alto rischio di complicazioni cardiovascolari durante l’ospedalizzazione rispetto ad altri metodi di valutazione della funzione renale. Abbiamo trovato che la cistatina C elevata è stata associata a una prognosi cardiovascolare peggiore anche nel gruppo di pazienti con filtrazione glomerulare normale. A nostra conoscenza, questo è il primo rapporto di questa associazione, che crediamo potrebbe avere implicazioni per la stratificazione del rischio in questa popolazione di pazienti.
Negli ultimi anni, diversi articoli hanno descritto una stretta associazione tra disfunzione renale e complicazioni cardiovascolari durante il follow-up di pazienti con cardiopatia ischemica acuta e cronica, così come altre presentazioni cliniche di malattia cardiovascolare, in particolare, l’insufficienza cardiaca.1,10-12 Una riduzione della filtrazione glomerulare inferiore a 60 mL/min è legata a un aumento significativo del rischio di morte, infarto miocardico e ictus, sia in pazienti con o senza precedente malattia cardiovascolare.13 In particolare, questa relazione è stata descritta nei pazienti ACS con sopraslivellamento del segmento ST e in quelli senza.10,13-15 Nello studio VALIANT16 (pazienti con disfunzione ventricolare e insufficienza cardiaca dopo infarto miocardico con sopraslivellamento del segmento ST), il deterioramento della funzione renale (valutato con la velocità di filtrazione glomerulare) è stato associato a un aumento della mortalità e delle complicazioni cardiovascolari durante il follow-up. Risultati simili sono stati riportati per le popolazioni di pazienti inclusi negli studi SAVE (disfunzione ventricolare post-infarto), HOPE (pazienti ad alto rischio cardiovascolare, la maggior parte con cardiopatia ischemica cronica) e PEACE (pazienti con cardiopatia ischemica cronica). In questi studi, la relazione tra la disfunzione renale e la prognosi è stata osservata per la diminuzione della velocità di filtrazione glomerulare e per l’escrezione urinaria di albumina.16-19
Come già detto, è stata descritta una relazione diretta a due vie tra la disfunzione renale e la malattia cardiovascolare. L’insufficienza renale cronica favorisce lo sviluppo di ipertensione e dislipidemia, e promuove l’attivazione del sistema renina-angiotensinaldosterone. Questi fattori, insieme all’aumento dei mediatori infiammatori, sembrano contribuire a una maggiore produzione di radicali liberi, che intervengono nel processo aterosclerotico e nel danno cardiovascolare. Inoltre, le alterazioni del metabolismo minerale (aumento dei promotori e diminuzione degli inibitori della calcificazione) favoriscono i depositi di calcio nei vasi coronarici.20,21 Infine, nei pazienti con disfunzione renale è stato descritto un uso meno intenso di interventi terapeutici di riconosciuto beneficio clinico e prognostico. In particolare, in quelli con ACS, un trattamento meno aggressivo e ritardi più lunghi nell’esecuzione di procedure coronariche interventistiche, così come un uso inferiore di IIb/IIIa, bloccanti dell’asse renina-angiotensina-aldosterone, betabloccanti, statine e agenti antipiastrinici, possono contribuire alla prognosi peggiore descritta in questa popolazione di pazienti.22
Nella pratica clinica quotidiana, la valutazione della funzione renale si basa solitamente sulla determinazione della creatinina sierica e sulla stima della velocità di filtrazione glomerulare mediante le formule Cockcroft-Gault o MDRD. Entrambi questi metodi presentano diverse limitazioni, molte delle quali derivano da fattori che influenzano la produzione di creatinina, come l’età, il sesso femminile, le caratteristiche legate alla razza, la dieta e il decorso delle malattie croniche.
Queste equazioni sono state recentemente valutate in pazienti con insufficienza cardiaca e confrontate con NT-proBNP, un marcatore prognostico. L’informazione prognostica fornita dall’NT-proBNP è risultata superiore a quella della funzione renale stimata dalla formula MDRD.23
La cistatina C possiede caratteristiche molecolari e metaboliche che rendono le concentrazioni plasmatiche di questa proteina un buon marcatore biologico per la stima della funzione renale; piccole alterazioni funzionali vengono rilevate con una sensibilità superiore ai parametri convenzionali utilizzati a questo scopo.24 Ciò può giustificare il fatto che nel gruppo di pazienti con concentrazioni di cistatina C nel siero superiori al limite superiore di normalità, il 15% presentava una normale velocità di filtrazione glomerulare; la determinazione della statina C può essere utile per identificare i pazienti con uno stato preclinico di malattia renale.6
I risultati ottenuti nel presente studio sono, in un certo senso, in linea con i risultati riportati che indicano che la cistatina C è un predittore indipendente di complicazioni cardiovascolari in pazienti con malattia coronarica.25-27 Inoltre, i nostri dati possono estendere questo concetto per includere i pazienti con una normale velocità di filtrazione glomerulare. Jernberg et al26 hanno analizzato la relazione tra i valori plasmatici di cistatina C e la prognosi in un gruppo di pazienti ricoverati per ACS non a segmento ST e hanno riportato un’associazione significativa tra i valori di cistatina C e la mortalità. È stato anche descritto che elevate concentrazioni di cistatina C sono associate a un aumento del rischio di morte, complicazioni cardiovascolari e l’incidenza di insufficienza cardiaca in pazienti ambulatoriali con malattia coronarica cronica.24 Nelle persone anziane senza malattia renale manifesta, la cistatina C è un marcatore di rischio di morte, malattia cardiovascolare e malattia renale cronica.6 Nello studio attuale, abbiamo trovato che i pazienti con elevati livelli di cistatina C avevano un profilo di rischio più povero; tuttavia, il livello relativamente basso di proteina C reattiva era sorprendente. Crediamo che questo possa essere spiegato dalla cinetica della proteina, che ha uno spettro specifico e caratterizzato in cui il suo valore dipende dal momento in cui il campione viene prelevato (il picco si verifica a 49 ore dopo l’inizio dei sintomi, e un picco più ritardato è visto in infarto miocardico acuto di segmento ST); nel nostro studio, i campioni sono stati presi entro le prime 24 ore dopo il ricovero.28 Le complicazioni cardiovascolari che hanno colpito i pazienti nel nostro studio differiscono da quelle pubblicate in registri recenti,29 e questo può essere dovuto al fatto che sono stati inclusi pazienti a rischio molto elevato e con una maggiore incidenza di complicazioni. Nel registro MASCARA, pubblicato di recente, solo il 50% dei pazienti inclusi era stato inizialmente ricoverato in un’unità di terapia intensiva o cardiaca, mentre tutti i nostri pazienti provenivano da un’unità di terapia intensiva cardiaca, un fatto che implica senza dubbio un certo bias di selezione. Ciononostante, il gruppo di pazienti con cistatina C elevata comprendeva una popolazione con un profilo di rischio e un numero di complicazioni cardiovascolari significativamente più elevato rispetto ai restanti pazienti. Il presente studio contribuisce a stabilire una maggiore precisione in queste associazioni fornendo il primo rapporto che i livelli elevati di cistatina C nelle prime ore di ospedalizzazione per ACS ad alto rischio sono un predittore indipendente di complicazioni cardiovascolari in ospedale. Inoltre, l’associazione tra cistatina C e rischio di complicazioni cardiovascolari è superiore a quella di altri parametri ampiamente utilizzati per stimare la funzione renale e si mantiene anche nel gruppo di pazienti con filtrazione glomerulare normale. Attualmente, non si sa con precisione se la capacità di predire un rischio più elevato di complicazioni derivi dal fatto che la cistatina C è un miglior marcatore della funzione renale rispetto ad altri parametri comuni (creatinina sierica e tasso di filtrazione glomerulare), o che ci sono altri fattori oltre alla filtrazione glomerulare che influenzano la concentrazione di cistatina C e potrebbero essere direttamente correlati al rischio cardiovascolare. In questa linea, è stata descritta una correlazione positiva dei valori della proteina C reattiva plasmatica e del fibrinogeno con elevate concentrazioni di cistatina C e la presenza di malattia cardiovascolare.30 Nello studio PRIME (Prospective Epidemiological Study of Myocardial Infarction), l’associazione tra cistatina C e sviluppo di infarto miocardico acuto, morte cardiaca e angina è stata studiata in pazienti senza malattia coronarica. Dopo aver aggiustato per i comuni fattori di rischio cardiovascolare, il livello di cistatina C nel plasma era significativamente associato allo sviluppo della prima complicazione coronarica di origine ischemica. Secondo gli autori, la diminuita velocità di filtrazione glomerulare non giustificherebbe i valori di cistatina C più elevati presentati dai casi rispetto ai controlli, e hanno proposto che l’infiammazione potrebbe essere all’origine della relazione tra cistatina C e rischio di malattia cardiovascolare.31,32 In linea con questi dati, i nostri risultati hanno mostrato una correlazione positiva tra la cistatina C e la proteina C-reattiva ad alta sensibilità (r=0,2), che è anche un predittore indipendente di complicazioni cardiovascolari, e forniscono ulteriori prove per giustificare la presenza di rapporti diretti tra malattia renale, infiammazione e malattia cardiovascolare.
Tra le principali limitazioni dello studio presentato, dobbiamo sottolineare che i risultati si riferiscono solo a pazienti con ACS ad alto rischio ricoverati in un’unità di terapia intensiva cardiaca, la maggior parte aggressivamente trattati con angiografia coronarica precoce. D’altra parte, queste caratteristiche dovrebbero essere evidenziate, perché ci sono poche informazioni su questa popolazione specifica, in cui la cistatina C è stata misurata all’ammissione in ospedale. In quasi tutti gli studi pubblicati, il momento delle determinazioni non è indicato e, almeno nei pazienti con ACS, le concentrazioni plasmatiche di cistatina C possono essere influenzate dalla durata dell’evento e dagli interventi diagnostici e terapeutici eseguiti. La limitazione di un breve follow-up impedisce di estendere le nostre osservazioni al medio o lungo termine. Tuttavia, i nostri risultati offrono la possibilità di migliorare la stratificazione del rischio nei pazienti ricoverati per ACS ad alto rischio, il che sarà utile per decidere la terapia oltre a stabilire la diagnosi.
CONCLUSIONI
La determinazione della cistatina C al momento del ricovero in pazienti con ACS ad alto rischio può essere un buon strumento clinico per la stratificazione del rischio cardiovascolare. La determinazione di questa proteina completerebbe le informazioni fornite da altri metodi di valutazione della funzione renale e, oltre alle implicazioni diagnostiche, potrebbe essere utile per identificare il gruppo a maggior rischio. Potrebbe essere necessario prestare particolare attenzione al rispetto delle raccomandazioni contenute nelle linee guida di pratica clinica in questa popolazione. Inoltre, la cistatina C potrebbe contribuire con informazioni importanti per stratificare i pazienti con ACS ad alto rischio e funzione renale conservata. Ulteriori studi con un follow-up più lungo potrebbero essere necessari per definire il ruolo della cistatina C nell’ACS con maggiore precisione.
ABBRAVIATIONS
ACS: sindrome coronarica acuta
MDRD: modifica della dieta nella malattia renale
TpI: troponina I
