Introduzione
La malattia diverticolare del colon rappresenta la malattia più comune che colpisce il grande intestino nel mondo occidentale. La prevalenza della malattia diverticolare è aumentata nell’ultimo secolo in tutto il mondo, probabilmente a causa dei cambiamenti nello stile di vita, come il fumo, il sovrappeso, l’inattività fisica e la dieta povera di fibre. La prevalenza aumenta con l’età, variando da circa il 5% negli adulti di età inferiore ai 40 anni al 50-70% tra quelli di 80 anni o più; l’80% dei pazienti che presentano una diverticolite hanno 50 anni o più. I diverticoli possono presentarsi in numero da solitari a centinaia, hanno tipicamente un diametro di 5-10 mm, ma possono superare i 2 cm di dimensione. La diverticolosi si verifica principalmente nel sigmoide e nel colon discendente in più del 90% dei pazienti, ma può essere prevalente in vari gradi nel resto del colon.1
Ci sono diversi termini relativi ai diverticoli che saranno utilizzati in questa recensione. La presenza di diverticoli nel colon in assenza di infiammazione manifesta è chiamata diverticolosi o malattia diverticolare non complicata (UDD). Può essere sintomatico o asintomatico. Il termine “diverticolite acuta del colon” (ACD) è usato per descrivere l’infiammazione dei diverticoli, che può progredire o meno in complicazioni (ACD complicata). Esiste anche la diverticolite cronica, a causa di diverticoliti ricorrenti o per lo sviluppo di una colite segmentaria associata ai diverticoli. Riassumendo, lo spettro clinico della malattia diverticolare è ampio.
Gli studi sulla storia naturale della malattia sottolineano che una grande maggioranza dei pazienti con diverticoli (circa l’80%) rimarrà asintomatica per tutta la vita. Del 15-20% che sviluppa sintomi, circa 1/4 avrà alla fine un episodio di malattia diverticolare dolorosa sintomatica senza infiammazione, e fino al 10-25% avrà un episodio di ACD. Circa l’1-2% richiederà un’ospedalizzazione e lo 0,5% un intervento chirurgico. I diverticoli sono responsabili della maggior parte (24-42%) degli episodi di sanguinamento gastrointestinale inferiore.2-4
Fisiopatologia e sviluppo dei sintomi
Un diverticolo del colon è un’erniazione di mucosa e sottomucosa, corrispondente a un punto debole dove i vasa recti penetrano la tunica muscolare. I meccanismi patogenetici della malattia diverticolare sono ancora poco conosciuti, tuttavia è generalmente riconosciuto che questi sono probabilmente legati a complesse interazioni tra dieta, microbiota colonico, fattori genetici, motilità e struttura del colon che portano alla formazione di diverticoli colonici nel tempo.5 Vedi Fig. 1. Nel 1971, Painter e Burkitt pubblicarono la loro famosa ipotesi che la malattia diverticolare fosse causata da un eccesso di pressione nel colon dovuto alla segmentazione basata sull’insufficiente assunzione di fibre alimentari. In risposta all’aumento della pressione intraluminale, i diverticoli possono svilupparsi e sporgere nelle aree di potenziale debolezza.6 La stasi o l’ostruzione nel diverticolo a collo stretto può portare alla crescita eccessiva di batteri e all’ischemia dei tessuti locali, portando infine alla perforazione.7 Da allora, numerosi studi osservazionali hanno cercato di dimostrare il possibile effetto delle fibre sulla prevenzione della malattia diverticolare. La maggior parte di essi ha concluso che il rischio di UDD era inversamente associato all’assunzione di fibre nella dieta.8-10 Sulla base di queste evidenze, una dieta ricca di fibre è raccomandata per prevenire la malattia diverticolare nella maggior parte delle attuali linee guida e documenti di sintesi.11-15 Tuttavia, questa ipotesi è stata recentemente messa in discussione poiché: (1) l’associazione inversa tra assunzione di fibre e diverticolosi è stata messa in discussione in alcuni recenti studi epidemiologici16,17 e (2) stanno emergendo nuove ipotesi patogenetiche come l’ipotesi neuropatica e miopatica.18-22 Altri fattori che sono stati associati ad un aumento del rischio di malattia diverticolare includono l’inattività fisica, la stitichezza, l’obesità e il fumo.23-27
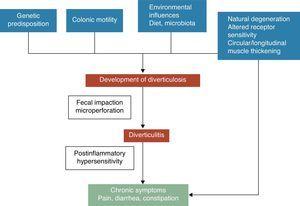
Lo sviluppo dei sintomi nella malattia diverticolare è probabilmente legato alle complesse interazioni tra le caratteristiche genetiche, la struttura del colon, l’infiammazione di basso grado della motilità intestinale e l’ipersensibilità post-infiammatoria.
L’associazione tra malattia diverticolare non complicata (UDD) e sintomi è incerta. Ci sono alcune prove che suggeriscono che la malattia diverticolare dolorosa può essere una condizione legata all’infiammazione e ai suoi effetti sulla funzione neuromuscolare nel colon.22-28 La presenza di un’infiammazione intestinale cronica di basso grado indurrebbe una disfunzione sensomotoria, portando allo sviluppo e/o alla persistenza dei sintomi. I cambiamenti nella microflora intestinale potrebbero essere uno dei meccanismi putativi responsabili dell’infiammazione di basso grado. La crescita eccessiva dei batteri aiutata dalla stasi fecale all’interno dei diverticoli potrebbe contribuire all’infiammazione cronica di basso grado che sensibilizza i neuroni afferenti primari intrinseci ed estrinseci. Queste alterazioni potrebbero portare all’ipertrofia della muscolatura liscia, all’aumento della sensibilità alla distensione addominale e, infine, allo sviluppo dei sintomi.3,22 Vedi Fig. 1.
Come abbiamo detto sopra, la maggior parte delle persone con diverticolosi del colon rimangono asintomatiche, ma alla fine possono sviluppare complicazioni come ACD o sanguinamento dei diverticoli. In questo articolo ci concentriamo sulla ACD. La manifestazione clinica di questo evento dipenderà da una serie di fattori, tra cui la dimensione della perforazione, il livello di contaminazione extracolonica e la capacità del corpo di contenere questa contaminazione.29,30
Gestione della malattia diverticolareGestione della malattia diverticolare non complicata (UDD)
Nei pazienti con UDD asintomatica,2 una dieta ricca di fibre può essere raccomandata per il suo possibile beneficio profilattico nella prevenzione della UDD sintomatica e delle complicazioni. Non ci sono prove che altri farmaci siano utili in questi pazienti.
C’è più evidenza sul beneficio del trattamento nelle UDD sintomatiche. Il sintomo più frequente è il dolore addominale, che può essere esacerbato dal mangiare e alleviato dalla defecazione o dal passaggio del flatus. Altri sintomi sono nausea, diarrea, costipazione e gonfiore. Più del 61% dei pazienti con UDD sintomatica che non prendono alcuna misura terapeutica per prevenire la ricorrenza dei sintomi diventeranno sintomatici entro 1 anno, e circa il 4% svilupperà complicazioni.31
Sono stati proposti cinque agenti per il trattamento (vedi Fig. 2):

Trattamento della malattia diverticolare non complicata. Meccanismi d’azione.
A) Dieta ad alto contenuto di fibre o agenti di carica
Diversi studi randomizzati controllati (RCT) e altri studi interventistici valutano l’effetto delle fibre nella UDD sintomatica, ma con risultati non coerenti.32-37 In ogni caso, le fibre sono raccomandate nella prevenzione e nel trattamento delle UDD sintomatiche, così come nella prevenzione dell’ACD dalla maggior parte delle attuali linee guida e documenti di posizione.11-15
B) Terapia antibiotica
Il razionale per l’uso degli antibiotici nelle UDD sintomatiche non è chiaramente stabilito. Studi recenti suggeriscono che i cambiamenti nel microbiota intestinale (crescita eccessiva dei batteri intestinali) potrebbero contribuire allo sviluppo dei sintomi a causa dell’eccessiva produzione di gas intestinale attraverso la fermentazione dei carboidrati. Per evitare effetti sistematici, gli antimicrobici scarsamente assorbiti che agiscono contro i patogeni enterici ma che hanno un rischio minimo di tossicità sistematica o effetti collaterali sembrano essere gli antibiotici più appropriati. Rifaximin è stato proposto.
Rifaximin
Rifaximin è un analogo non sistematico della rifamicina con un ampio spettro di attività in vitro. Rifaximin può diminuire l’attività metabolica della flora intestinale, aumentando la massa fecale, e può anche sradicare la sovracrescita batterica. Questo antibiotico ha un alto profilo di sicurezza e tollerabilità.33,38 Il livello plasmatico di rifaximina è minimo, quindi i patogeni non enterici non sono esposti alla pressione selettiva e il rischio di resistenza batterica è basso.39 Tre RCT in aperto e due in doppio cieco40-44 hanno esaminato l’efficacia della somministrazione ciclica di rifaximina e fibre nella riduzione dei sintomi rispetto alla sola fibra. Una revisione sistematica e due meta-analisi hanno analizzato questi studi.44-46 Hanno concluso che il trattamento combinato è efficace nell’ottenere sollievo dai sintomi a 1 anno nei pazienti con UDD. Il 35% dei pazienti trattati con le sole fibre era asintomatico rispetto al 64% nei gruppi di trattamento combinato. Il numero necessario per trattare era di tre per la rifaximina rispetto al placebo per alleviare il sintomo e di nove per evitare complicazioni. In sintesi, i migliori risultati sono stati ottenuti utilizzando una combinazione di fibre solubili, come il glucomannano, e rifaximina 1 settimana ogni mese.
C) Probiotici
I probiotici sono microrganismi vivi che possono ripristinare la flora intestinale commensale che può essere stata alterata nella malattia diverticolare a causa della stasi e della riduzione del tempo di transito del colon.47 Purtroppo, ci sono pochi dati disponibili sul suo uso nella UDD sintomatica e la maggior parte degli studi è piccola e non controllata. La maggior parte di essi mostra un miglioramento dei sintomi.48-50
I probiotici sono stati studiati anche in combinazione con il 5-aminosalicilato (5-ASA). Tursi e colleghi hanno condotto tre RCT confrontando il 5-ASA da solo, il probiotico da solo o la terapia combinata.51-53 Sia il 5-ASA che i probiotici sembrano essere efficaci per la prevenzione delle UDD sintomatiche, ma la loro combinazione è migliore. Un recente RCT in doppio cieco pubblicato da questo stesso gruppo scientifico ha concluso che sia la mesalazina ciclica che il Lactobacillus casei subsp DG, in particolare in combinazione, sembrano essere migliori del placebo per il mantenimento della remissione delle UDD sintomatiche.54 Ma, in sintesi, i disegni di studio poveri e le piccole dimensioni di essi non permettono conclusioni definitive.
D) 5-ASA: mesalazina
La mesalazina ha effetti antinfiammatori e antiossidanti. Nel 2010, Gatta et al.,55 hanno pubblicato una revisione sistematica Cochrane che ha valutato il ruolo della 5-ASA in pazienti con malattia diverticolare. Gli autori hanno concluso che il 5-ASA può essere efficace nel trattamento di questa malattia e che la mesalazina quotidiana era migliore della somministrazione ciclica per prevenire le ricadute. Sono necessari RCT di alta qualità e ben disegnati per confermare le loro osservazioni. Infatti, il primo studio in doppio cieco controllato con placebo ha trovato la mesalazina efficace nell’ottenere sollievo dal dolore in pazienti con UDD acuta.56 Inoltre, ci sono due interessanti RCT che hanno mostrato un beneficio per la mesalazina rispetto alla rifaximina in termini di prevenzione delle recidive sintomatiche e un successo simile nel mantenimento della remissione a lungo termine rispetto al probiotico Lactobacillus casei.53,57
E) Agenti anticolinergici/antiespasmodici
L’ipermotilità del colon nella diverticolosi suggerisce che agenti antispasmodici come la diciclomina e l’iosciamina potrebbero migliorare i sintomi diminuendo la contrazione muscolare. Ma, non ci sono RCT che confermano questo beneficio.
F) Evitare il trattamento con FANS
Diversi studi controllati hanno dimostrato che i FANS sono un fattore di rischio per lo sviluppo di sintomi, ACD, perforazione e sanguinamento.7,58-60 I consumatori di FANS hanno più rischio di sviluppare malattie diverticolari sintomatiche rispetto ai non consumatori (RR: 1,5, CI 95%: 1,1-2,1).58 E nei pazienti con malattie diverticolari complicate c’era un uso maggiore di FANS rispetto ai controlli senza malattia. E’ stato postulato che questo aumento del rischio era dovuto al danno della mucosa con conseguente compromissione della funzione di barriera della mucosa colonica che permette la traslocazione dei batteri, che provocano l’infiammazione.
G) Livelli di vitamina D
Sembra che l’incidenza di ACD sia stata associata a variazioni geografiche e stagionali. Per questo motivo, Maguire et al. hanno condotto due interessanti studi osservazionali che hanno dimostrato che livelli più bassi di vitamina D e bassa esposizione alla luce UV (l’esposizione UV determina lo stato della vitamina D) sono associati a un rischio significativamente più alto di ACD. Sono necessari più studi di alta qualità prima di fare una raccomandazione.61,62
Trattamento della diverticolite colonica acuta (ACD)
Anche se la maggior parte delle persone con diverticolosi rimane asintomatica, si stima che circa il 10-25% di loro svilupperà un episodio di ACD sinistra.63 Generalmente, la diagnosi clinica non è sufficientemente accurata e sono indicate tecniche radiologiche. Nei pazienti con sintomi lievi (la maggior parte) e senza segni di ACD complicata, la combinazione di dolore nel basso addome sinistro, l’assenza di vomito e una proteina C reattiva >50mg/l, può essere sufficiente per la diagnosi.64,65 Se l’imaging è indicato, probabilmente, una strategia condizionale con l’ecografia come tecnica di prima linea e seguita dalla tomografia computerizzata (TC), se l’ecografia è inconcludente o dubbia, può rappresentare l’approccio più efficace. Il numero di esami CT può essere ridotto del 50%. Nel 1978, Hinchey et al. hanno proposto una classificazione dell’ACD, modificata in seguito.66,67 Distingue cinque stadi di ACD; stadio 0, diverticolite clinicamente lieve, stadio I (a: infiammazione pericolica e b: ascesso
cm in prossimità dell’infiammazione primaria), stadio II, ascesso intra-addominale, pelvico o retroperitoneale o ascesso lontano dall’infiammazione primaria, stadio III, peritonite purulenta generalizzata e stadio IV, peritonite fecale. Vedi Fig. 3.

Algoritmo per la gestione della diverticolite colonica acuta.
Trattamento dell’ACD non complicata (stadio 0 o Ia di Hinchey)
La maggior parte dell’ACD non complicata può essere trattata in modo sicuro e conservativo con una percentuale di successo tra il 70% e il 100%.14 Il trattamento ambulatoriale può consentire un importante risparmio sui costi per i sistemi sanitari. Nei casi di ACD non complicata, i criteri per la gestione ospedaliera sono un’infiammazione significativa (inclusa la presenza di febbre o peritonite), intolleranza ai fluidi orali, età superiore a 80-85 anni, immunosoppressione o gravi comorbidità. Nella maggior parte dei casi, un breve soggiorno in ospedale sarà sufficiente. Non ci sono prove che le restrizioni dietetiche abbiano influenzato i risultati del trattamento, anche se la maggior parte dei medici di solito raccomanda una dieta liquida chiara.
Uno dei più grandi cambiamenti recenti nella gestione dell’ACD non complicata è la diminuzione dell’uso di antibiotici. Una recente revisione Cochrane, solo un approccio qualitativo (senza meta-analisi), ha trovato che i migliori dati disponibili non supportano il suo uso di routine.68 Gli antibiotici non accelerano il recupero né prevengono le complicazioni o le recidive. Pertanto, l’uso di antibiotici in questo caso è discutibile. Probabilmente, sarebbero appropriati in pazienti con segni di infezione generalizzata, segni di setticemia o batteriemia e in pazienti immunocompromessi. I regimi raccomandati si basano sul consenso clinico. Si possono usare vari antibiotici, dall’ampicilina alle cefalosporine di terza generazione, purché siano efficaci contro i batteri gram positivi, gram negativi e anaerobi. La combinazione di ciprofloxacina e metronidazolo è probabilmente il trattamento orale più prescritto. Se questa combinazione è mal tollerata, l’ampicilina-sulphabactam può essere una buona scelta. D’altra parte, dati recenti hanno dimostrato che non ci sono vantaggi degli antibiotici endovenosi rispetto a quelli orali e del trattamento endovenoso di 4 giorni rispetto a quello di 7 giorni.69-71 Di solito, il miglioramento clinico si osserva entro 3-4 giorni dal trattamento. Infine, il ricovero in ospedale con antibiotico per via endovenosa è raccomandato quando il paziente non è in grado di assumere cibo per via orale, è affetto da gravi comorbidità o non migliora con il trattamento ambulatoriale.
Trattamento dell’ACD complicata (stadio Hinchey da Ib a IV)ACD Hinchey Ib o II: ascesso
Circa il 15% dei pazienti con ACD svilupperà un ascesso.67 Non ci sono prove di alta qualità sulla gestione più ottimale dell’ACD con formazione di ascesso. L’ospedalizzazione è indicata. La dimensione è un fattore importante per il successo del trattamento. Negli ascessi più piccoli (
cm) si raccomanda un trattamento conservativo con antibiotici ad ampio spettro. Avrà successo fino al 70%.72 Quando il trattamento conservativo fallisce o negli ascessi più grandi, dovrebbe essere eseguito il drenaggio percutaneo. Ha successo fino all’80%.73 La chirurgia sarà un trattamento di salvataggio quando i trattamenti precedentemente menzionati falliscono.ACD Hinchey III o IV: peritonite purulenta o fecale
La peritonite è la complicazione più grave, con una mortalità del 14%. Anche se non ci sono prove, la chirurgia precoce è considerata la terapia standard per questi pazienti. La scelta dell’operazione è influenzata dalle condizioni del paziente, dai risultati operativi e dall’esperienza del chirurgo. Nei pazienti critici con instabilità emodinamica, si raccomanda la procedura di Hartmann. Tuttavia, nei pazienti emodinamicamente stabili, l’anastomosi primaria con o senza diversione fecale prossimale deve essere considerata una scelta preferibile.14,74
Tradizionalmente, le linee guida internazionali raccomandano di utilizzare l’endoscopia dopo un episodio di ACD per escludere il cancro colorettale. Questa raccomandazione è basata solo sulle opinioni degli esperti. Recenti studi retrospettivi e una revisione sistematica75-80 mostrano che il tasso di cancro in questi pazienti è piuttosto basso. Sulla base di questa recente evidenza, la strategia più efficace potrebbe essere quella di riferire alla colonscopia solo quei pazienti con sintomi persistenti o quelli con reperti CT sospetti. Ma sono necessari più studi per una raccomandazione definitiva.
Gestione dopo un episodio di ACDPrevenzione di ACD ricorrente
Dopo un episodio di ACD, circa un terzo avrà un secondo ACD, e dopo un secondo episodio, un altro terzo avrà un altro attacco.73,74 Ma le prove per definire il trattamento ottimale dopo un episodio di ACD per prevenire un nuovo episodio sono scarse.
A) Dieta ad alto contenuto di fibre
Una volta che l’episodio acuto si è risolto, una dieta ad alto contenuto di fibre è comunemente raccomandata per ridurre le recidive. Ma, gli RCT sulle diete ad alto contenuto di fibre nei pazienti con ACD hanno avuto risultati incoerenti. Una revisione sistematica recentemente pubblicata sulla dieta ad alto contenuto di fibre non ha potuto includere alcuno studio che indaghi il ruolo delle fibre nella prevenzione delle ACD ricorrenti.26,81 Alcuni alimenti (semi, popcorn e noci) sono classicamente evitati perché teoricamente entrano, bloccano o irritano i diverticoli. Ma Strate et al. nel loro grande studio prospettico non hanno trovato alcuna associazione con un aumento del rischio di ACD. Quindi l’esclusione dalla dieta di questi alimenti non dovrebbe essere raccomandata.82 Inoltre, la riduzione del peso e la cessazione del fumo possono avere un’influenza favorevole sulla prevenzione dell’ACD.9,83
B) Antibiotici
Ci sono tre recenti revisioni sistematiche che hanno valutato il ruolo della rifaximina ciclica nella prevenzione delle recidive di ACD, ma non hanno mostrato un chiaro beneficio.46,84,85 Da un punto di vista fisiopatologico, una spiegazione plausibile dell’inefficacia della rifaximina nella prevenzione delle recidive potrebbe essere che un trattamento ciclico potrebbe non controllare la popolazione batterica del colon per tutto il mese, perché la popolazione batterica del colon si riprende entro 7-14 giorni dalla fine della rifaximina. Tuttavia, un recente RCT aperto spagnolo ha dimostrato che la rifaximina ciclica può migliorare i sintomi e mantenere periodi di remissione dopo l’ACD.86 Le recidive si sono verificate nel 10,4% dei pazienti a cui è stata somministrata rifaximina più fibre rispetto al 19,3% della sola fibra. Inoltre, i pazienti diagnosticati per la prima volta da ≥1 anno avevano un rischio maggiore di riacutizzazione (OR 3,34, 95% CI: 0,01-12,18). Ma sono necessari ulteriori studi poiché, al momento, non è possibile fare raccomandazioni. Non ci sono prove a sostegno dell’uso di altri antibiotici in questo contesto.
C) Probiotici
Alcuni studi in aperto hanno esaminato il ruolo dei probiotici nella prevenzione delle recidive di ACD. Giaccari et al., più di 20 anni fa, hanno valutato il ruolo di Lactobacillus sp. dopo rifaximina in 79 pazienti con stenosi del colon post diverticolite. L’88% dei pazienti rimase asintomatico per un periodo di 12 mesi.87 Questo studio osservazionale fu il primo a suggerire un possibile ruolo dei probiotici in questo contesto. Uno studio più recente ha valutato un trattamento combinato: balsalazide e VSL#3 (una miscela probiotica di otto specie). Dopo 12 mesi, il 73% dei soggetti in terapia combinata era asintomatico rispetto al 53% della monoterapia probiotica (p>0,05).52 In sintesi, i probiotici sembrano essere efficaci nella prevenzione delle recidive di ACD, ma mancano studi ben progettati.
D) 5-ASA
Diversi RCT in doppio cieco e aperti hanno valutato il ruolo della mesalazina nella prevenzione delle recidive di ACD. Sfortunatamente la maggior parte di essi non ha trovato un beneficio della mesalazina rispetto al placebo nella prevenzione delle recidive.88-90 Raskin et al. hanno recentemente pubblicato due interessanti e identici RCT di fase 3 in doppio cieco e con placebo (PREVENT1 e PREVENT2) che mostrano anche che la mesalazina non è superiore al placebo nella prevenzione delle ACD ricorrenti.91 Anche il trattamento combinato, 5-ASA più rifaximina, è stato valutato in diversi studi. Trivedi e Das hanno esaminato i dati di cinque RCT e di uno studio in aperto, che hanno coinvolto collettivamente oltre 600 pazienti, e hanno concluso che la combinazione sembra essere superiore alla rifaximina da sola nella prevenzione dell’ACD ricorrente.92
E) Chirurgia
Fino a pochi anni fa la chirurgia elettiva era raccomandata dopo due attacchi di ACD non complicata o un attacco di ACD complicata per ridurre la morbilità e la mortalità da recidiva. Ma la chirurgia elettiva comporta anche un aumento del rischio di morbi-mortalità.93 Per questo motivo, è importante soppesare la morbilità e la mortalità dovute alla chirurgia rispetto al rischio di recidive complicate e alla gravità dei sintomi.
I dati recenti mostrano che la storia naturale dell’ACD è molto più benigna di quanto si pensasse in passato.73,94 Il rischio a lungo termine di ricaduta è più basso di quanto si credesse in precedenza, e i rischi a lungo termine di successivi interventi chirurgici d’urgenza (3-7%), di morte (95 hanno mostrato che il 16% dei casi con primo ACD è stato operato d’urgenza rispetto a solo un 6% nei casi di recidiva, e che la mortalità a 30 giorni per il primo episodio era anche più alta rispetto agli eventi ricorrenti (3% contro 0%). Di fatto, la maggior parte dei pazienti che si presentano con ACD complicata non hanno un’anamnesi della malattia.96 Si propone anche che l’ACD ricorrente possa proteggere dalla perforazione, probabilmente a causa della formazione di aderenze causate dall’infiammazione.95 Pertanto, una politica di chirurgia elettiva dopo l’ACD non diminuisce la probabilità di un ulteriore intervento (fino al 3%) e non protegge completamente dalla recidiva. D’altra parte, il miglioramento della diagnostica e delle modalità di trattamento hanno ridotto la morbi-mortalità dell’ACD complicata. A causa di questi nuovi dati, l’American Society of Colon and Rectum Surgeons nella sua più recente linea guida raccomanda che la resezione elettiva del sigmoide dopo la guarigione dall’ACD sia fatta caso per caso14 e considera che il numero di episodi precedenti non è un buon indicatore per la selezione dei candidati alla chirurgia elettiva. I medici dovrebbero considerare le condizioni mediche e l’età del paziente, la frequenza e la gravità degli attacchi e la presenza di sintomi persistenti dopo l’episodio acuto.14
È molto difficile prevedere quali casi di ACD avranno una ricaduta. La gravità graduata della TAC del primo episodio di ACD sembra essere un predittore di una storia naturale avversa. L’ACD sul lato sinistro, >5cm di colon coinvolto e un ascesso retroperitoneale sono predittori di recidiva e devono essere presi in considerazione.97 Non c’è consenso riguardo alla giovane età (82 Secondo l’evidenza attuale, l’età non dovrebbe essere considerata un’indicazione per la chirurgia elettiva in quanto non sembra essere correlata ad un decorso grave della malattia dopo un ACD trattato medicalmente. Ma, tenendo conto che c’è una maggiore incidenza di ACD nei pazienti più giovani, sono necessari ulteriori studi per chiarire questa specifica questione.
Casi particolari sono gli individui immunocompromessi. Studi di coorte indicano che questi pazienti hanno un alto rischio di ACD ricorrente complicata (un rischio 5 volte maggiore di perforazione), e un alto rischio di chirurgia d’urgenza.98 Pertanto, una soglia più bassa per la chirurgia elettiva potrebbe essere utile per loro.14 Ma, Biondo et al. nel loro recente studio mostrano che i pazienti immunocompromessi avevano un tasso di mortalità significativamente più alto, ma solo nel primo episodio. Pertanto, la controversia è presente.99
Trattamento delle sequeleA) Fistola
Una fistola si verifica quando un flemmone o un ascesso diverticolare si rompe in un organo adiacente. Una fistola appare in meno del 5% dei pazienti con ACD. Le più frequenti sono le fistole colovescicali e colovaginali. Presumibilmente, nella maggior parte dei pazienti si potrebbe eseguire una resezione operativa in una sola fase con chiusura della fistola e anastomosi primaria. Altre fistole come quelle coloenteriche o coluterine sono rare.100,101
B) Ostruzione
Esodi ricorrenti di ACD, che possono essere subclinici, possono produrre un restringimento cronico del colon senza infiammazione in corso. Può verificarsi un’ostruzione di alto grado o completa. Prima di trattare l’ostruzione, è necessario escludere un’eziologia maligna. Quando la neoplasia è sufficientemente esclusa e non c’è ACD, la dilatazione endoscopica o la decompressione temporanea con stent metallico possono essere opzioni terapeutiche.102 Più tardi, si può realizzare una successiva resezione in un solo stadio senza deviazione.
Gestione della colite segmentale associata a diverticolosi
E’ definita come un’infiammazione cronica della mucosa interdiverticale di un segmento colonico coinvolto. Il retto e il colon destro sono risparmiati. È diventato un disturbo clinico e patologico distinto e si presenta frequentemente con feci sanguinolente. La patogenesi è sconosciuta. Lo spettro delle alterazioni istologiche varia da una lieve infiammazione aspecifica a cambiamenti simili alle malattie infiammatorie intestinali. Per questo motivo, la diagnosi differenziale è spesso difficile. La maggior parte dei pazienti guarisce completamente in poche settimane o mesi. Alcuni di loro vengono inizialmente trattati con 5-ASA per via orale, ma probabilmente questi farmaci non sono necessari perché la maggior parte dei casi si risolve spontaneamente.103
Conclusioni
Nella UDD sintomatica, gli obiettivi del trattamento sono prevenire le complicazioni e ridurre i sintomi. Secondo l’evidenza attuale, fibre più rifaximina ciclica o mesalazina più probiotici sembrano essere le terapie più efficaci. Nell’ACD, gli antibiotici sembrano rimanere il pilastro del trattamento e una gestione ambulatoriale è considerata l’approccio ottimale nella grande maggioranza dei pazienti con ACD non complicata. Tuttavia, la gestione ospedaliera e gli antibiotici per via endovenosa sono necessari nell’ACD complicata. Attualmente, il ruolo della chirurgia d’urgenza sta cambiando. La maggior parte degli ascessi associati a diverticolite possono essere trattati con antibiotici endovenosi e/o drenaggio percutaneo e la chirurgia d’urgenza sarà considerata un trattamento standard solo nei pazienti con peritonite. Infine, la chirurgia elettiva dopo il recupero dall’ACD dovrebbe essere fatta caso per caso.
Contributi degli autori
Gargallo CJ, Sopeña F e Lanas A hanno contribuito in egual misura alla progettazione, redazione e revisione di questo articolo.
Conflitto di interessi
Il dottor Carla J. Gargallo e il dottor Federico Sopeña non segnalano conflitti di interessi. Il Dr. Angel Lanas è stato consulente di AlfaWasserman.
