- Methodology
- Figura1:Imaging pathway
- Approccio diagnostico e work-up iniziale
- Citologia urinaria
- Immagini iniziali nei pazienti a basso rischio
- Figura2:Carcinoma a cellule transizionali della vescica (US)
- Figura3:Carcinoma a cellule transizionali renale (US e RPUG)
- Immagini iniziali in pazienti ad alto rischio
- Figura4:TCC vescicale e renale (CTU)
- Figura5:TCC della vescica (MRI)
- Figura6:TCC ureterico (CTU)
- Figura7:Tumore della vescica (cistoscopia)
- Altri studi di imaging
- Follow-up clinico
- Tabella2: Indicazioni per il rinvio
Methodology
Una ricerca elettronica da agosto-settembre 2015 di MEDLINE attraverso PubMed, e il Cochrane Database of Systematic reviews ha identificato articoli originali rilevanti, revisioni sistematiche e linee guida basate sull’evidenza dal periodo 2008-settembre 2015, che sono stati inclusi. I seguenti termini sono stati utilizzati in combinazione durante la revisione della letteratura per produrre l’elenco degli articoli esaminati: “indolore”, “macroscopico”, “visibile” E “ematuria”, “reni”, “ureteri”, “vescica urinaria”, “cancro della vescica”, “tratto urinario”, “citologia”, “diagnostica per immagini”, “radiografia”, “ultrasonografia”, “ecografia”, “pielografia”, “tomografia, radiografia computerizzata” E “urografia”, “risonanza magnetica” E “urografia”, “endovena” O “escretore” E “urografia”, “urologia” O “nefrologia” E “rinvio” O “consultazione”, “cistoscopia”, “linee guida”.
Per la revisione è stata effettuata anche una ricerca manuale per identificare altre pubblicazioni rilevanti dagli studi recuperati. Un totale di 84 articoli a testo completo sono stati selezionati e valutati per l’ammissibilità. Sono stati inclusi i documenti che descrivono studi originali, linee guida basate sull’evidenza o revisioni sistematiche, mentre sono stati esclusi gli studi pediatrici e sugli animali. Sono stati esclusi anche gli articoli che non erano in inglese o che avevano un testo limitato, dopo di che sono stati inclusi 59 articoli finali e classificati secondo l’Oxford Centre for Evidence-Based Medicine Levels of Evidence. I percorsi basati sull’evidenza sono stati prodotti e rivisti dai membri del pannello editoriale di esperti di Diagnostic Imaging Pathways (DIP) secondo i consueti processi DIP (http://www.imagingpathways.health.wa.gov.au/index.php/production/processes-for-creating-and-managing-content), in consultazione con l’editore, un urologo e un nefrologo. L’algoritmo finale (Figura 1) che è anche disponibile su Imaging Pathways (Strumento decisionale clinico online: Dulku G. Painless Macroscopic Haematuria. Diagnostic Imaging Pathways; settembre 2015), fornisce indicazioni e raccomandazioni di imaging per i pazienti adulti con ematuria inspiegabile, indolore e visibile.
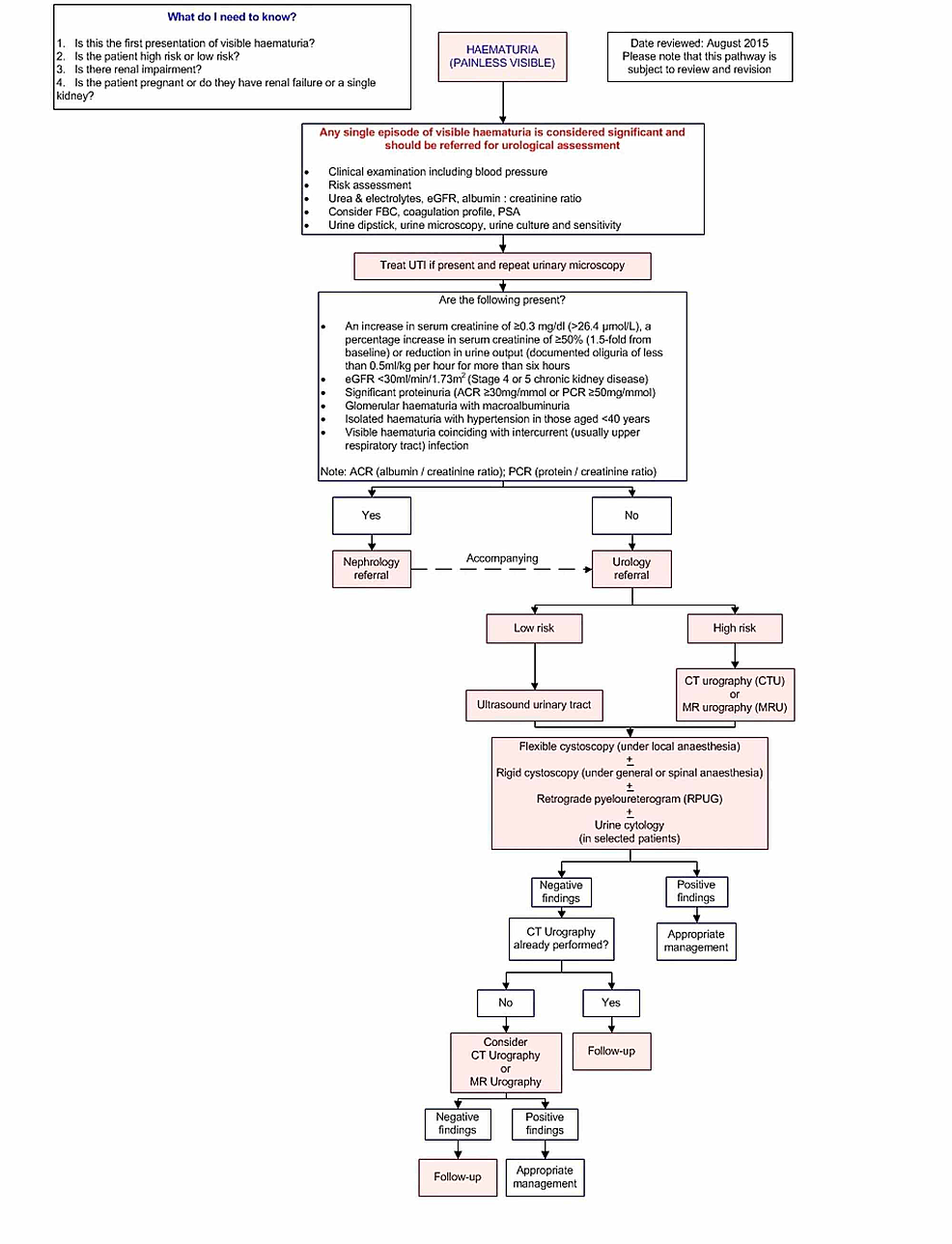
Figura1:Imaging pathway
Questo percorso fornisce una guida sull’imaging dei pazienti adulti con ematuria visibile inspiegabile indolore.
eGFR: Estimated glomerular filtration rate; FBC: Emocromo completo; PSA: Antigene prostatico specifico; ACR: Rapporto albumina/creatinina; PCR: Rapporto proteine/creatinina; UTI: Infezione del tratto urinario.
La nostra revisione non ha incluso un’analisi della guida all’imaging per l’individuazione dei calcoli del tratto urinario come causa di ematuria, poiché tipicamente questa è associata al dolore. La nostra attenzione si è concentrata principalmente sulla guida all’imaging e sulla letteratura di supporto per l’ematuria visibile indolore con tumori maligni urologici come causa potenziale.
Approccio diagnostico e work-up iniziale
Il consenso della British Association of Urological Surgeons (BAUS) e dell’Interregional Chiefs of Urology Service (IRCUS), Kaiser Permanente, America ha suggerito che ogni singolo episodio di VH è considerato significativo e dovrebbe essere sottoposto a valutazione urologica che in quasi tutti i casi includerà la cistoscopia.
Nel frattempo, le indagini possono essere effettuate per identificare le cause transitorie e trattabili, e organizzare l’imaging primario. I pazienti con VH e comprovata infezione del tratto urinario (UTI) devono ancora essere indagati per la malignità concomitante, dal momento che la malignità comunemente coesiste con o agisce come un nido per un’infezione di propagare da . infezione del tratto urinario deve essere trattata prima della cistoscopia in quanto vi è un rischio di uro-sepsi se la cistoscopia viene eseguita in presenza di UTI attivo.
La presenza di VH non dovrebbe anche essere attribuita alla terapia anti-coagulante o anti-piastrinica e questi pazienti dovrebbero anche essere valutati indipendentemente da questi farmaci, in quanto i rapporti di malignità sottostante sono stati trovati nel 24% e 7% dei pazienti in due serie separate.
Quindi, il ruolo primario di imaging è quello di identificare i pazienti con una causa maligna di ematuria. Tuttavia, la scelta della modalità di imaging dipende da vari fattori individuali del paziente (ad esempio, l’età, i fattori di rischio per la malignità, la funzione renale e la gravidanza) e da altri fattori, come la politica e la pratica locale, il rapporto costo-efficacia e la disponibilità delle risorse.
Tradizionalmente, le indagini di prima linea hanno incluso la radiografia convenzionale, l’ecografia renale (US), e/o il pielogramma intravenoso (IVP) in combinazione con la cistoscopia. Quest’ultima è importante in quanto molte lesioni sanguinanti del tratto urinario sorgono nella vescica urinaria e le procedure di imaging non hanno ancora definitivamente dimostrato di essere sensibili come la cistoscopia nella diagnosi della maggior parte di esse.
Le indagini di seconda linea hanno incluso l’urogramma con tomografia computerizzata multidetettore (MDCTU) e l’urografia a risonanza magnetica (MRU), spesso eseguite solo se i test di prima linea rivelano un’anomalia.
Il CIRCUS ha raccomandato di eseguire una CTU modificata o una IVP con un’ecografia renale concomitante per i pazienti con ematuria significativa. Non c’è bisogno della tomografia renale all’urografia endovenosa (IVU) se viene eseguita un’ecografia renale concomitante. Questo approccio ridurrà l’esposizione alle radiazioni ionizzanti.
Nel raccomandare l’imaging per la valutazione della VH, Cowan ha suggerito che il tipo di modalità di imaging impiegato sia basato su un punteggio di rischio con pazienti >40 anni da sottoporre a urografia CT mentre i pazienti <40 anni da sottoporre a ecografia come modalità di imaging di prima linea. La Società Europea di Radiologia Urogenitale (ESUR) ha suggerito che l’indagine dei pazienti a basso rischio richiede ecografia e cistoscopia e i pazienti ad alto rischio richiedono CTU e cistoscopia per l’imaging completo del tratto renale e urinario .
Citologia urinaria
La citologia urinaria, sebbene controversa, è essenziale per la valutazione del carcinoma a cellule uroteliali del tratto urinario superiore (UUT-UCC) e le linee guida della European Association of Urology (EAU) raccomandano che la citologia urinaria sia eseguita come parte del work-up diagnostico standard. La citologia delle urine ha una sensibilità del 25%, una specificità del 91%, un alto valore predittivo positivo ma un basso valore predittivo negativo.
Tuttavia, la citologia delle urine ha un alto tasso di falsi negativi per l’individuazione della malignità e una citologia negativa non può mai escludere completamente la presenza di un tumore vescicale, la cistoscopia è garantita in tutti i casi.
Numerosi test delle urine disponibili in commercio per i biomarcatori delle urine includono BTA TRAK, ImmunoCyt/uCyt+, CxBladder, Nuclear Matrix Protein 22 (NMP-22) e UroVysion (FISH), anche se questi possono mancare una percentuale significativa di pazienti con cancro della vescica in particolare quando la sua accuratezza è scarsa per i tumori a basso stadio e basso grado . Per queste ragioni, non è stato raggiunto un consenso sul ruolo della citologia delle urine e/o dei marcatori tumorali della vescica nella valutazione dei pazienti con ematuria.
Immagini iniziali nei pazienti a basso rischio
L’ESUR ha suggerito che l’indagine dei pazienti a basso rischio richiede US e cistoscopia e i pazienti ad alto rischio richiedono CTU e cistoscopia per un imaging completo del tratto renale e urinario. La sensibilità dell’US non è, tuttavia, sufficiente per ovviare alla necessità della cistoscopia a causa della sua mancanza di sensibilità nel rilevare i piccoli tumori della vescica, in particolare quelli che sono meno di 0,5 cm di diametro.
L’ecografia (US) è importante nella valutazione iniziale dell’ematuria e oltre ad essere facilmente disponibile e poco costosa, non comporta l’esposizione a radiazioni ionizzanti ed è particolarmente utile nelle popolazioni sensibili alle radiazioni, come i bambini e le donne in gravidanza o in età fertile. L’ecografia permette anche piani di scansione illimitati, consentendo così una buona visualizzazione dei reni e della vescica urinaria. Inoltre, gli studi Doppler possono fornire ulteriori informazioni sulla vascolarizzazione delle masse (Figura 2A, 2B).
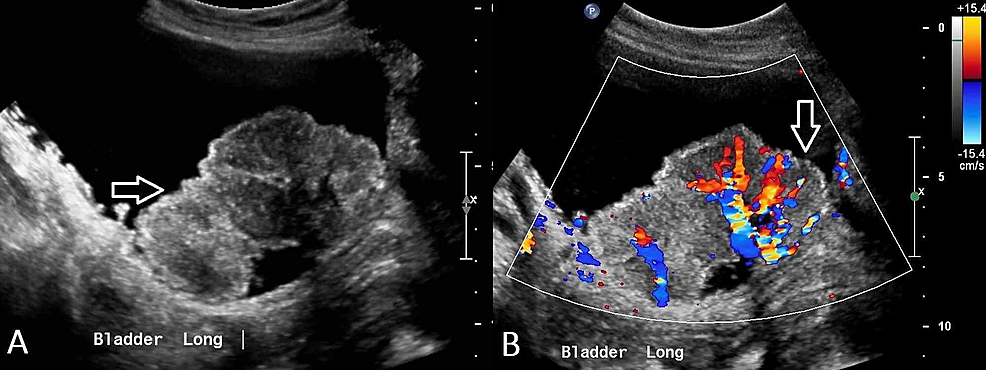
Figura2:Carcinoma a cellule transizionali della vescica (US)
(A) L’ecografia pelvica dimostra un irregolare, eterogeneo all’interno della vescica urinaria con più piccole lesioni polipoidi viste adiacenti che è suggestivo di cancro alla vescica urinaria. (B) La vascolarizzazione è dimostrata all’interno di questa massa.
Nella rilevazione dei tumori UUT, gli USA hanno una sensibilità variabile nella rilevazione dei carcinomi uroteliali, con una sensibilità moderata (82%) per la rilevazione del carcinoma a cellule renali e una bassa sensibilità (12%) per la rilevazione del carcinoma uroteliale dell’uretere. Tuttavia, rispetto alla IVP nel rilevamento di anomalie dell’UUT in pazienti che presentano ematuria, gli USA sono più sensibili nel rilevamento di tumori renali e vescicali, con una maggiore sensibilità (96% contro 25%) e un valore predittivo negativo (98% contro 91%) rispettivamente. Tuttavia, rispetto all’imaging trasversale come la MDCTU o la MRU, gli US hanno una sensibilità inferiore nel rilevare le anomalie del tratto urinario.
L’ecografia è eccellente nel determinare se una massa è cistica o meno e se una lesione cistica è una cisti semplice o minimamente complicata o complicata. Le lesioni che non sono cisti semplici richiedono un ulteriore work-up con CT o MRI. La Contrast-enhanced US (CEUS) è un’alternativa promettente nel work-up iniziale delle masse renali. Le prestazioni riportate del CEUS nella valutazione di sospette masse cistiche solide o complesse suggeriscono un valore simile del CEUS rispetto alla TC. La CEUS ha i vantaggi della mancanza di nefrotossicità, della mancanza di radiazioni ionizzanti e della capacità di valutare il pattern di enhancement in tempo reale – e questo può essere fatto durante la visita iniziale del paziente. Tuttavia, il posto della CEUS nell’algoritmo diagnostico ha bisogno di ulteriori chiarimenti.
Pertanto, l’utilizzo degli USA come modalità di imaging di prima linea nella valutazione dell’ematuria sembra giustificabile. Dato che gli ultrasuoni da soli possono potenzialmente mancare lesioni ureterali e uroteliali, è necessaria un’ulteriore valutazione con cistoscopia, mentre la pielo-ureterografia retrograda è un utile complemento (Figura 3).
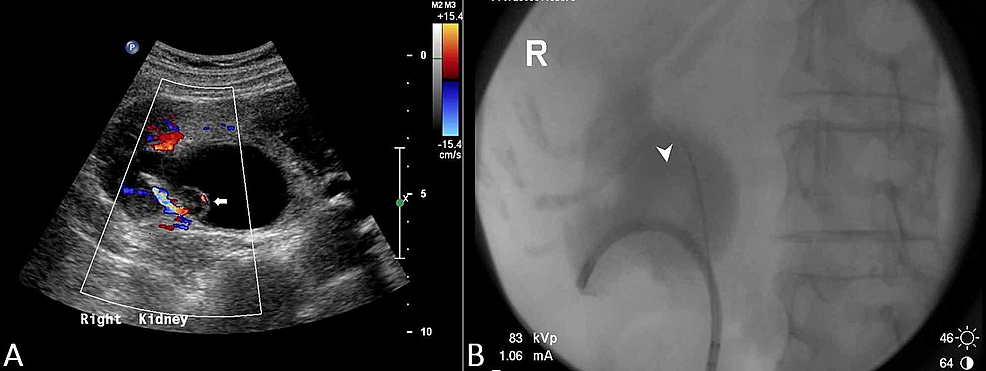
Figura3:Carcinoma a cellule transizionali renale (US e RPUG)
(A) L’ecografia della pelvi dimostra un uretere destro prossimale diffusamente ispessito con una lesione papillare (freccia) vista all’interno della pelvi renale destra, e conseguente idronefrosi destra. (B) Questo corrisponde ai risultati del pielo-ureterogramma retrogrado (RPUG) (freccia) che è suggestivo di un carcinoma a cellule transizionali del tratto urinario superiore destro.
Immagini iniziali in pazienti ad alto rischio
Urografia CT
L’urografia CT (detta anche CT IVP anche se CTU è il termine preferibile) supera US, IVU, e la radiografia nella valutazione delle masse parenchimali renali e dei calcoli del tratto urinario con sensibilità e specificità per i tumori uroteliali del tratto superiore del 67-100% e del 93-99%, rispettivamente.
La strategia diagnostica ottimale per indagare i pazienti ad alto rischio dopo aver escluso l’UTI è una strategia combinata che utilizza la CTU e la cistoscopia flessibile. I “pazienti” con lesioni coerenti con il cancro della vescica sulla CTU dovrebbero essere indirizzati direttamente per la cistoscopia rigida ed evitare così la cistoscopia flessibile con un vantaggio di una riduzione del 17% del numero di cistoscopie flessibili eseguite .
Per tutte le altre categorie di pazienti, compresi i pazienti più giovani e pazienti con indicazioni più benigne e più basse probabilità di cancro pre-test, US è la modalità di imaging di prima linea . Le modifiche della tecnica di esame CT urografia, che consistono in protocolli limitati e combinazioni di fasi di scansione, potrebbero essere utilizzati in alternativa o complementari agli altri test di imaging.
Il protocollo di scansione dovrebbe includere: scansione senza contrasto, fase nefrografica (90-100 secondi dopo il bolo di contrasto) e fase escretoria (o pielografica) (5-15 minuti dopo la somministrazione del contrasto). Una fase cortico-midollare è utile in casi selezionati, per esempio, se si sospetta uno pseudoaneurisma o uno pseudotumore. L’acquisizione di routine durante questa fase può non essere giustificata. Le immagini senza contrasto sono utili per rilevare il calcolo renale. La fase nefrografica ha la più alta sensibilità nell’individuazione delle masse renali, e la correlazione con le immagini non aumentate è necessaria per mostrare un miglioramento inequivocabile. La fase pielografica/escretoria è usata per valutare il sistema di raccolta, gli ureteri e la vescica con l’uso di tecniche di distensione ureterica come la compressione, il bolo salino endovenoso e i diuretici, tutti con risultati variabili. L’urografia TC può anche rilevare la malattia extra-urinaria.
A differenza dei tumori uroteliali, molti pazienti con neoplasie renali rimangono asintomatici fino alle ultime fasi della malattia, dato che la stragrande maggioranza dei tumori renali sono piccoli e rilevati incidentalmente. Inoltre, le masse renali raramente invadono il sistema di raccolta. Di conseguenza, la classica triade di dolore al fianco, ematuria e una massa renale addominale palpabile del carcinoma a cellule renali (RCC) si verifica al massimo nel 6-9% dei pazienti e, quando presente, suggerisce fortemente una malattia localmente avanzata e una prognosi infausta. Qui, la TC e la RMN sono raccomandate per il work-up e sono considerate uguali per la stadiazione e la diagnosi (Figure 4, 5). Tuttavia, si attendono studi comparativi tra CT e RM ad alto campo. Nel frattempo, la RM può essere utilizzata in casi selezionati per la risoluzione dei problemi. Anche la risonanza magnetica pesata in diffusione (DWI) può essere utile nel rilevamento e nella caratterizzazione delle lesioni, ma le revisioni sistematiche indicano solo una moderata accuratezza.
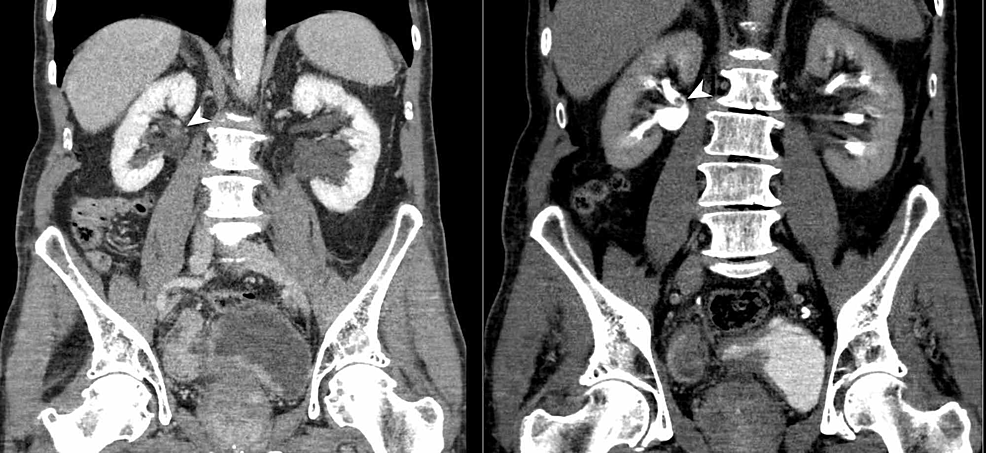
Figura4:TCC vescicale e renale (CTU)
L’urografia TC (riformato coronale) dimostra un ispessimento irregolare della parete della vescica urinaria e anche un difetto di riempimento polipoide sessile nella parte posteriore della pelvi renale destra (teste di freccia). I risultati sono suggestivi di un carcinoma a cellule transizionali (TCC) multifocale del tratto urinario.
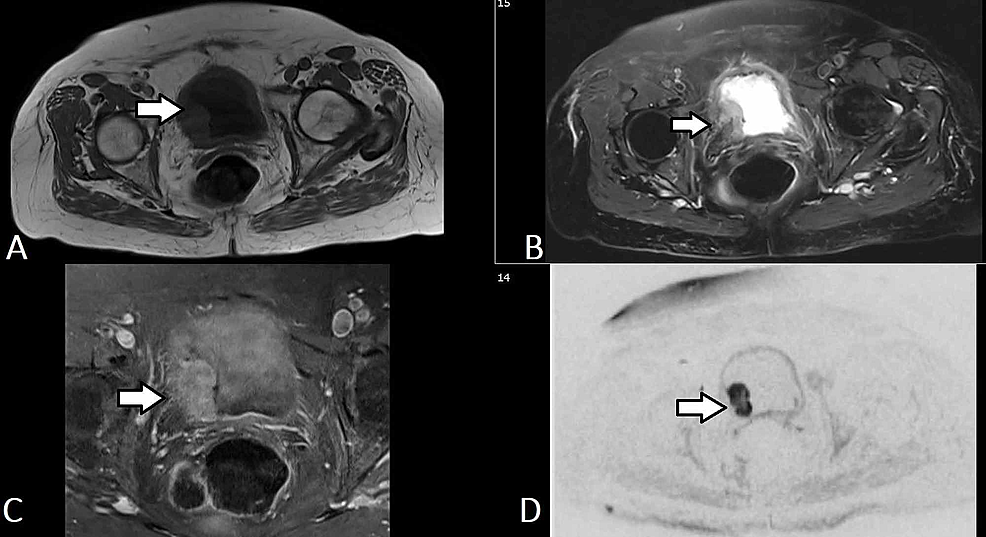
Figura5:TCC della vescica (MRI)
(A-D) Le immagini assiali selezionate dell’urografia MR dello stesso paziente dimostrano una massa lobulata (freccia) derivante dalla parete laterale destra della vescica urinaria che si estende al trigono e invade la parete della vescica urinaria per coinvolgere lo strato esterno senza estensione nel grasso perivescicale. La massa è di bassa intensità di segnale T1 e alta T2. La massa dimostra un aumento di contrasto relativamente omogeneo e diffuso e una prominente restrizione della diffusione (b50/400/800). La costellazione dei risultati riflette un tumore della vescica che è probabilmente classificato come T2b No Mx.
TCC: Carcinoma a cellule transizionali
La classificazione di Bosniak delle masse renali cistiche è basata sulle caratteristiche di imaging sulla CT con contrasto ed è utile per prevedere il rischio di malignità e fornire una guida nella gestione. Il rischio di malignità per le lesioni cistiche Bosniak 1, 2, 2F, 3, e 4 sono 0%, 0%, 25%, 54%, e 100%, rispettivamente.
L’urografia TC può anche essere efficace nella diagnosi dei tumori della vescica. Tuttavia, i risultati possono essere diversi a seconda della popolazione specifica studiata. Nel gruppo ad alto rischio, i risultati inequivocabili della CTU erano sensibili al 93% e specifici al 99% per l’individuazione del cancro della vescica con un valore predittivo negativo (NPV) complessivo del 95%. L’alto NPV della CTU può ovviare alla cistoscopia in questi pazienti selezionati, anche se la cistoscopia rimane il gold standard nell’individuazione del tratto urinario inferiore, compresi i tumori uroteliali della vescica, poiché né la IVP né la MDCTU hanno costantemente sensibilità abbastanza significative da escludere anomalie della mucosa vescicale.
Le dosi di radiazioni sono una preoccupazione con MDCTU e questo può essere ridotto limitando il numero di fasi di imaging attraverso l’uso della TC a doppia energia (DECT) o la tecnica split-bolus. Inoltre, (25) l’omissione dell’acquisizione non potenziata comporta una riduzione dell’esposizione alle radiazioni di quasi il 50%.
DECT fornisce informazioni su come le sostanze si comportano alle diverse energie, la capacità di generare set di dati virtuali non potenziati e una migliore individuazione delle sostanze contenenti iodio sulle immagini a bassa energia. Altri vantaggi di DECT includono una buona registrazione temporale e spaziale e una buona separazione spettrale tra scansioni ad alta e bassa energia facile da equalizzare la dose e il rumore. Uno studio prospettico ha dimostrato che l’urografia DECT monofase con potenziamento sincrono della fase nefrografica-escretoria rappresenta un accurato approccio “all-in-one” con un risparmio di dose di radiazioni fino al 45% rispetto ad un protocollo standard a doppia fase con una buona opacizzazione nell’86.9% dei casi e immagini virtuali non migliorate (VUE) eccellenti o buone nell’83,3% dei casi.
D’altra parte, lo split-bolus MDCTU fornisce almeno il 50% di opacizzazione della maggior parte dei segmenti UUT con un’alta sensibilità (88.9-100%), specificità (99-99,5%) e precisione (98,5-99,5%) per l’individuazione di tumori del tratto urinario superiore (Figura 6).
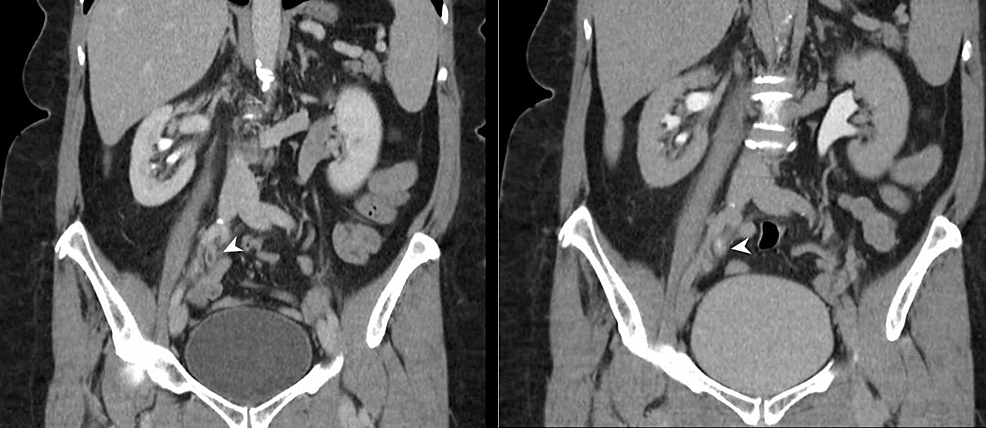
Figura6:TCC ureterico (CTU)
L’urografia TC (riformati coronali) dimostra un segmento di 4 cm di ispessimento uroteliale circonferenziale alla giunzione dell’uretere medio e distale destro (teste di freccia) con aumento uroteliale anomalo. C’è un’ostruzione secondaria del sistema di raccolta di destra con il punto di transizione notato a livello di ispessimento uroteliale anormale che è altamente sospetto per un TCC uroteliale lato destro.
TCC: Carcinoma a cellule transizionali
Urografia a risonanza magnetica
La risonanza magnetica è utile nella diagnosi e nella stadiazione dei tumori maligni dei reni, della vescica e della prostata e nella valutazione della funzione renale. Serve come una tecnica di imaging alternativa per la popolazione sensibile alle radiazioni, compresi i bambini e le donne incinte; quelli che richiedono esami ripetuti del tratto urinario e quelli con controindicazione ai mezzi di contrasto iodati.
Un protocollo MRU completo può essere utilizzato per l’imaging di tutti i componenti dei reni e del sistema di raccolta urinario in una singola sessione di imaging. L’urografia MR viene eseguita con due metodi principali: urografia statico-fluido con sequenze pesate T2 ultraveloci, simile a quella utilizzata per la colangiopancreatografia a risonanza magnetica (MRCP), e sequenze pesate T1 di urografia escretoria dopo la somministrazione di contrasto gadolinio IV.
La MRU statico-fluido è preferita alla MRU escretoria nell’imaging di pazienti con funzione renale compromessa, pazienti in gravidanza e pazienti con ostruzione ureterale soprattutto quando c’è un ragionevole rischio di fibrosi sistemica nefrogenica. Tuttavia, dato che le sequenze T2 pesate vengono eseguite senza somministrazione di contrasto per via endovenosa, le modifiche di imaging sono spesso necessarie per ottimizzare l’imaging ureterico.
L’imaging ureterico può anche essere migliorato in particolare a MRU escretoria, dopo la somministrazione di materiale di contrasto IV, soluzione salina e un diuretico per ottenere una distribuzione più uniforme del contrasto . Anche se l’evidenza rivela che DWI dimostra solo moderata accuratezza per la previsione di malignità renale, le sue prestazioni come un test indipendente è ancora non testato. L’aggiunta della DWI all’imaging pesato in T1 e T2 aumenta la sensibilità nell’identificazione del tumore della UUT con un eccellente accordo inter-osservatore. In particolare, la combinazione di T2WI+DWI dimostra sensibilità tra il 92-98% per la diagnosi di tumori della vescica (Figura 5).
Gli svantaggi della MRU includono il costo, la disponibilità, il tempo di acquisizione più lungo, la degradazione dell’immagine dovuta agli artefatti di movimento, la risoluzione spaziale inferiore e la fiducia diagnostica nell’individuazione della malignità uroteliale rispetto alla CTU. Tuttavia, lo sviluppo di sequenze più veloci e l’ottimizzazione dei protocolli di risonanza magnetica 3-T dovrebbero risolvere questi problemi.
Cistoscopia
La cistoscopia è ancora il metodo di scelta per la valutazione della vescica urinaria e non dovrebbe essere sostituito da nessuna tecnica di imaging escretorio. Le recenti linee guida dell’EAU raccomandano anche che la cistoscopia dovrebbe essere eseguita per escludere un tumore vescicale concomitante (Figura 7) quando viene diagnosticato un tumore dell’UUT, in particolare quando gli autori hanno dimostrato notevoli risultati falsi positivi e falsi negativi alla CTU e alla MRU nell’individuazione dei tumori della vescica quando vengono confrontati con l’istopatologia in pazienti con ematuria visibile . Una cistoscopia dovrebbe essere eseguita praticamente su tutti i pazienti con ematuria visibile indolore.
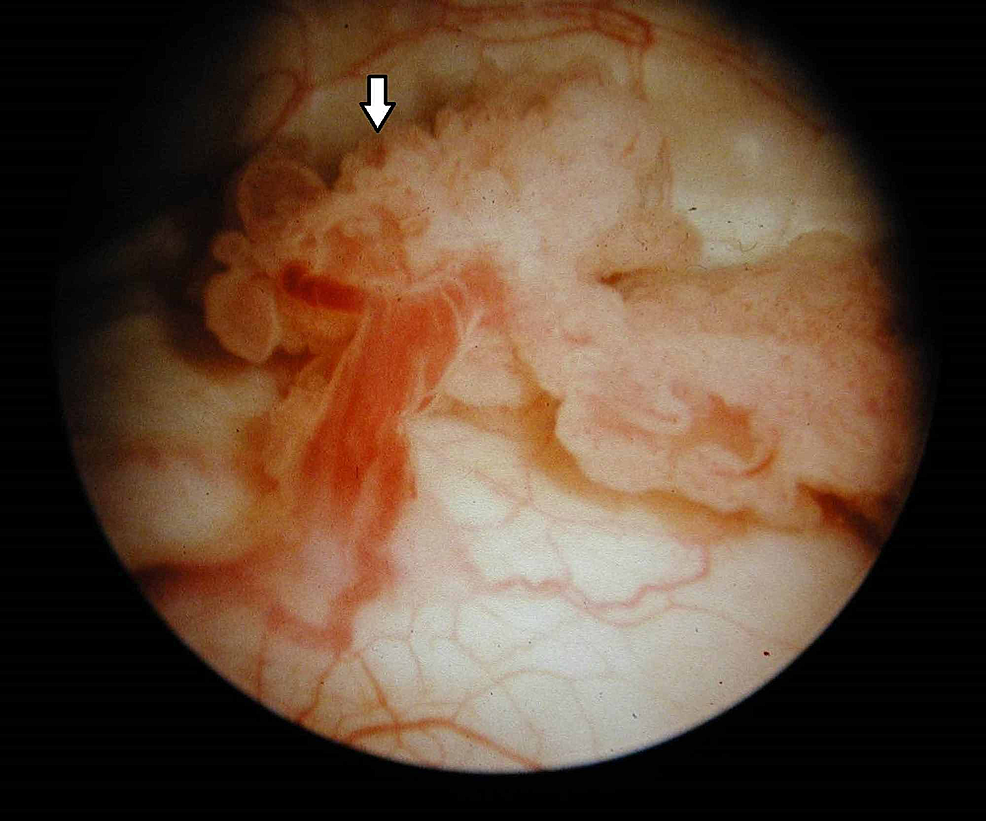
Figura7:Tumore della vescica (cistoscopia)
La cistoscopia rivela una crescita esofitica, simile a un cavolfiore, con delicate fronde e aree di ulcerazione, in linea con una neoplasia della vescica urinaria (freccia).
La cistoscopia flessibile è una procedura semplice, rapida e sicura eseguita in anestesia locale come un caso diurno con rassicurazione affidabile e che permette ai pazienti operativi di essere diagnosticati e preparati per il loro intervento nella stessa visita.
D’altra parte, la cistoscopia rigida viene eseguita in anestesia generale o spinale in particolare quando sono previste procedure aggiuntive più complesse. Un pielo-ureterogramma retrogrado (RPUG) può essere eseguito al momento della cistoscopia rigida per l’immagine dei tratti superiori se la CTU non è già stata eseguita.
Altri studi di imaging
Pielo-ureterografia retrograda
L’urogramma CT è stato trovato per avere una maggiore accuratezza diagnostica rispetto alla RPUG per il rilevamento di lesioni uroteliali. Pertanto, è giustificato l’utilizzo della CTU prima della RP, come test unico, non invasivo e completo che permette la diagnosi simultanea e/o la stadiazione.
La pielografia retrograda può ancora essere impiegata come indagine di seconda linea per caratterizzare ulteriormente i difetti di riempimento rilevati con altre modalità, CTU non diagnostica, o in pazienti con insufficienza renale o casi di allergia al mezzo di contrasto. La pielo-ureterografia retrograda può mostrare solo il lume ureterico e non può raffigurare direttamente anomalie estrinseche (Figura 3).
Radiografia Plain dei reni, degli ureteri e della vescica urinaria (Plain X-ray KUB)
Plain X-ray KUB attualmente è di scarso valore nell’indagine dei pazienti con ematuria indolore e non è utilizzato come modalità di prima linea di immagine.
Urografia escretoria/Urografia endovenosa (IVU)
L’urografia endovenosa è una buona scelta nella valutazione della malattia uroteliale e intraluminale, ma non è sufficientemente sensibile per rilevare masse renali <2-3 cm di dimensione e ora è stato sostituito da CTU per l’imaging della UUT . L’indagine dell’ematuria nei pazienti ad alto rischio con la sola IVU non è più raccomandata.
Il suo principale vantaggio è che la IVU immagina l’intera UUT con un alto grado di risoluzione spaziale e fornisce anche informazioni strutturali oltre a limitati dati funzionali. È spesso il test più conveniente in molti centri.
Tuttavia, gli svantaggi dell’IVU includono un lungo tempo di acquisizione, potenziali reazioni di contrasto pericolose, che richiedono la preparazione dell’intestino e l’esposizione a un carico di radiazioni apprezzabile. La sua relativa imprecisione è il suo principale difetto e sarà presto obsoleto.
Follow-up clinico
C’è un rischio dell’1-3% dei pazienti con un workup negativo di sviluppare una malignità entro tre anni se non controllato. L’American Urological Association (AUA) raccomanda che i medici di base controllino la presenza di VH, nuovi sintomi urinari e citologia positiva ogni sei mesi per tre anni e se i risultati sono costantemente negativi, il follow-up può essere interrotto. BAUS raccomanda di rinviare all’urologia se c’è uno sviluppo di VH o di ematuria non visibile sintomatica (NVH) durante il follow-up delle cure primarie, la cui durata non è stata chiaramente definita. Il Best Practice Advocacy Centre New Zealand ha raccomandato il monitoraggio annuale per cause nefrologiche con dipstick delle urine, pressione sanguigna, eGFR e rapporto albumina/creatinina urinaria/proteine/creatinina (ACR/PCR) mentre l’ematuria persiste, e annualmente per due anni per cause urologiche con dipstick delle urine, eGFR, ACR/PCR urinario e citologia. Questa iniziativa permette il follow-up delle cure primarie per offrire rassicurazione ai pazienti che hanno a che fare con preoccupazioni di ematuria continua che può essere intermittente ma persistente nonostante un work-up negativo. L’indicazione per il rinvio in nefrologia e urologia è riassunta nella tabella 2.
Rinvio in nefrologia
Un aumento della creatinina sierica di ≥0.3 mg/dl (>26,4 µmol/L), un aumento percentuale della creatinina sierica di ≥50% (1,5 volte dal basale) o una riduzione della produzione di urina (oliguria documentata di meno di 0.5 ml/kg all’ora per più di sei ore
Proteinuria significativa (ACR ≥30 mg/mmol o PCR ≥50 mg/mmol) in aggiunta all’ematuria fa sospettare una malattia renale intrinseca
Ematuria glomerulare con macroalbuminuria
Ematuria isolata (cioè, in assenza di proteinuria significativa) con ipertensione in quelli di età <40
Ematuria visibile che coincide con un’infezione intercorrente (di solito del tratto respiratorio superiore)
Riferimento all’urologia
Ematuria visibile in tutti i pazienti (indipendentemente dall’età)
Pazienti con qualsiasi sintomatico nonvisibile in assenza di UTI o altre cause transitorie (indipendentemente dall’età)
Pazienti maschi con ematuria non visibile asintomatica
Tutti i pazienti con ematuria non visibile asintomatica e altri fattori di rischio
Tabella2: Indicazioni per il rinvio
† La presenza di globuli rossi dismorfici, proteinuria, colate cellulari, e/o insufficienza renale, o qualsiasi altro indicatore clinico sospetto per una malattia parenchimale renale, giustifica un controllo nefrologico concomitante ma non preclude la necessità di una valutazione urologica.
‡ Le femmine con ematuria asintomatica non visibile di età <40 anni non richiedono un riferimento urologico.
