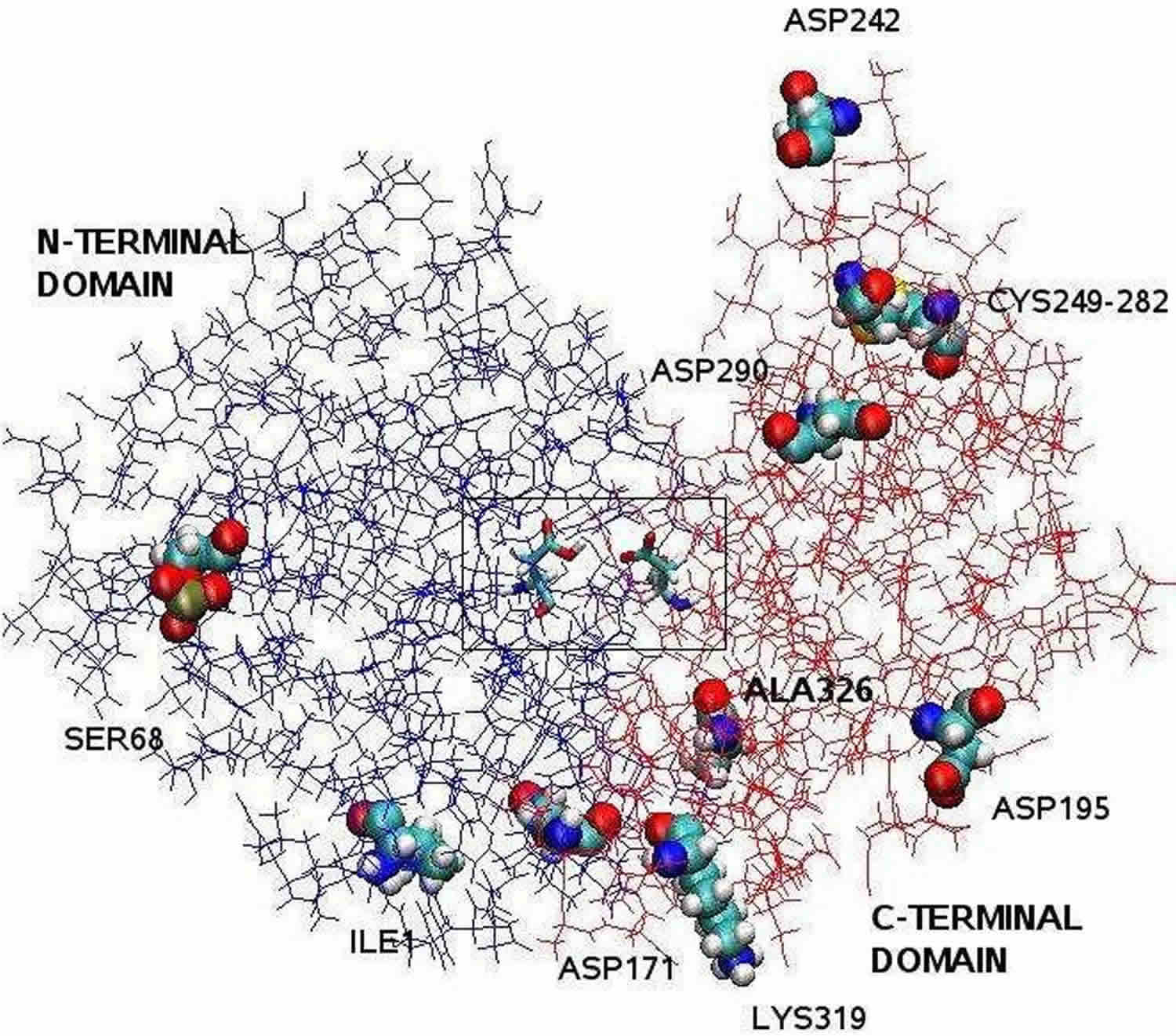
 Nota: La struttura della pepsina chiarita dalla cristallografia a raggi X è bilobata con una grande fessura del sito attivo tra i due lobi. I residui da 1 a 175 formano il dominio N-terminale, mentre i residui da 176 a 326 costituiscono il dominio C-terminale. Due aspartati al centro della fessura, Asp32 e Asp215, funzionano come residui catalitici. Il sito catalitico, costituito da Asp32 e Asp215, si trova al centro della fenditura. I residui aminoacidici carichi situati sulla superficie della proteina sono, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminale), Ala326 (C-terminale). Il Ser68 fosforilato è completamente esposto al solvente e il ponte disolfuro tra Cys 249 e Cys 282 si trova sulla superficie della proteina.
Nota: La struttura della pepsina chiarita dalla cristallografia a raggi X è bilobata con una grande fessura del sito attivo tra i due lobi. I residui da 1 a 175 formano il dominio N-terminale, mentre i residui da 176 a 326 costituiscono il dominio C-terminale. Due aspartati al centro della fessura, Asp32 e Asp215, funzionano come residui catalitici. Il sito catalitico, costituito da Asp32 e Asp215, si trova al centro della fenditura. I residui aminoacidici carichi situati sulla superficie della proteina sono, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminale), Ala326 (C-terminale). Il Ser68 fosforilato è completamente esposto al solvente e il ponte disolfuro tra Cys 249 e Cys 282 si trova sulla superficie della proteina.
La pepsina, come proteasi aspartica, ha un pH ottimale molto basso. Kondjoyan, Daudin e Santé-Lhoutellier 9) hanno studiato la digeribilità delle proteine miofibrillari trovando la massima attività della pepsina a pH intorno a 2. Pletschke, Naudé e Oelofsen 10) hanno studiato l’idrolisi dell’emoglobina da parte della pepsina di maiale e di struzzo, e hanno anche trovato un pH ottimale di 2,0 per l’attività della pepsina. Una volta attivato da pH <4.5, l’enzima pepsina è facilmente denaturato da pH superiori a 7.0, costituendo proprietà che determinano le caratteristiche della pepsina 11).
In contrasto con l’influenza del pH, l’effetto della forza ionica sull’attività enzimatica è meno spesso discusso. Un lavoro precedente di Dale e White 12) ha dimostrato che l’aumento della forza ionica diminuisce chiaramente la velocità di reazione della ribonucleasi pancreatica immobilizzata, mentre Butré, Wierenga e Gruppen 13) hanno studiato l’idrolisi enzimatica dell’isolato proteico del siero di latte da parte di alcalasi e neutrasi, e hanno anche scoperto che la presenza di 0. 5M NaCl diminuiva la velocità di reazione.5M NaCl diminuiva il tasso di idrolisi.
Sono noti due potenti inibitori naturali della pepsina: la pepstatina, un pentapeptide di Streptomyces, e un unico inibitore proteico di Ascaris. La pepsina subisce anche un’inibizione di ritorno; un prodotto della digestione delle proteine rallenta la reazione inibendo la pepsina 14).
Dove viene prodotta la pepsina?
Le cellule del capo secernono pepsina sotto forma di un precursore enzimatico inattivo chiamato pepsinogeno. Quando il pepsinogeno entra in contatto con l’acido cloridrico delle cellule parietali, si rompe rapidamente, formando la pepsina 15). La pepsina inizia la digestione di quasi tutti i tipi di proteine alimentari in polipeptidi. Questo enzima è più attivo in un ambiente acido, che è fornito dall’acido cloridrico nel succo gastrico.
Figura 2. Cellule dello stomaco (ghiandole gastriche)
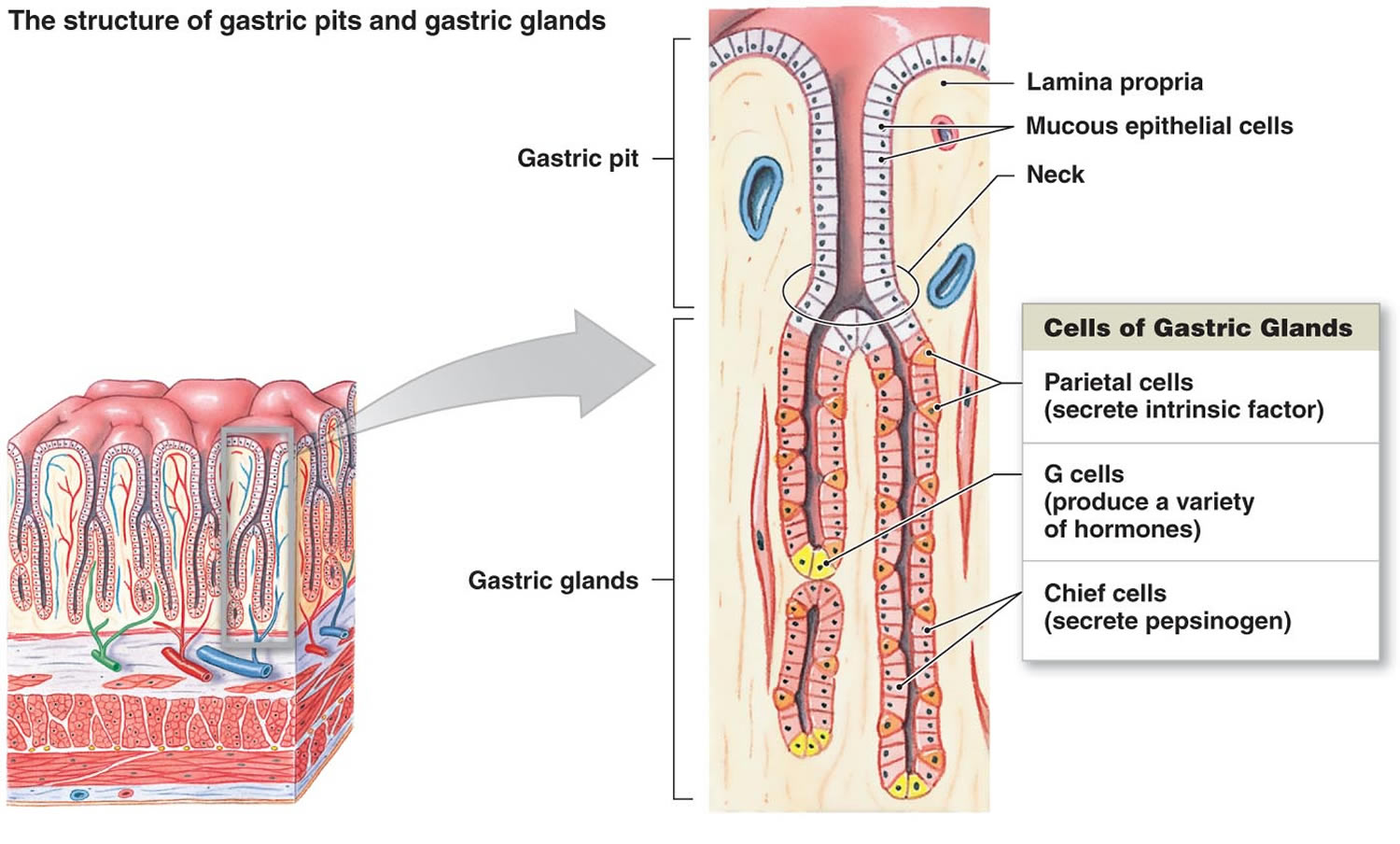 Nota: Rivestimento dello stomaco. Le ghiandole gastriche includono cellule mucose, cellule parietali e cellule capi. La mucosa dello stomaco è costellata di fosse gastriche che sono le aperture delle ghiandole gastriche.
Nota: Rivestimento dello stomaco. Le ghiandole gastriche includono cellule mucose, cellule parietali e cellule capi. La mucosa dello stomaco è costellata di fosse gastriche che sono le aperture delle ghiandole gastriche.
Cosa fa la pepsina?
La pepsina formata dal pepsinogeno (forma inattiva della pepsina) in presenza di acido cloridrico, digerisce quasi tutti i tipi di proteine alimentari in polipeptidi (composti proteici più piccoli). La pepsina digerisce le proteine in un forte acido gastrico. La pepsina è ottimizzata per la digestione del cibo nell’ambiente acido dello stomaco ed è la prima proteasi che le proteine alimentari incontrano nel tratto digestivo. La pepsina è più attiva in ambienti acidi tra 37 °C e 42 °C 16).
La specificità della pepsina (cioè la probabilità di scissione dei legami peptidici da parte della pepsina) è principalmente influenzata dai residui di aminoacidi in posizione P1 e P1′, mentre i residui di aminoacidi in altri sottositi possono anche giocare un ruolo. In generale, la pepsina preferisce scindere dopo fenilalanina, leucina e metionina, mentre raramente scinde dopo istidina, lisina, prolina e arginina 17). I residui aromatici tirosina, triptofano e fenilalanina sono favoriti in posizione P1′. La prolina è fortemente sfavorita in posizione P2, P2′ e P3′, mentre istidina, lisina e arginina sono sfavorite in posizione P3. Le posizioni P4 e P4′ hanno poca influenza 18).
Figura 3. Funzione della pepsina