![]()
Le persone che utilizzano tecnologie assistive potrebbero non essere in grado di accedere completamente alle informazioni contenute in questo file. Per assistenza, si prega di inviare un’e-mail a: [email protected]. Digita 508 Accommodation e il titolo del rapporto nella riga dell’oggetto dell’e-mail.
![]() PDF
PDF
L’Advisory Committee on Immunization Practices (ACIP) rivede annualmente il programma di vaccinazione per adulti raccomandato per assicurare che il programma rifletta le raccomandazioni attuali per l’uso dei vaccini autorizzati. Nel giugno 2005, l’ACIP ha approvato l’Adult Immunization Schedule per ottobre 2005-settembre 2006. Questo programma è stato approvato anche dall’American Academy of Family Physicians e dall’American College of Obstetricians and Gynecologists.
Cambiamenti nel programma per ottobre 2005-settembre 2006
Il programma 2005-2006 differisce dal programma precedente come segue:
- I vaccini elencati nel programma basato sull’età (Figura 1) sono visualizzati in modo che i vaccini raccomandati per l’uso di routine possano essere differenziati da quelli raccomandati per gli adulti con certi indicatori di rischio (simile al programma di vaccinazione infantile). Questo è illustrato sia dallo schema di colori che dalla linea spezzata.
- Le barre gialle (“Per tutte le persone in questo gruppo”) e le barre verdi (“Per le persone che non hanno la documentazione della vaccinazione o l’evidenza della malattia”) dal programma precedente sono state fuse in una barra gialla, che ora recita, “Per tutte le persone in questa categoria che soddisfano i requisiti di età e che non hanno prove di immunità (ad esempio,
- La barra viola è stata cambiata da “Per le persone a rischio (ad esempio, con indicazioni mediche/esposizione)” a “Raccomandata se è presente qualche altro fattore di rischio (ad esempio, sulla base di indicazioni mediche, professionali, stile di vita o altro)”. La barra viola è stata aggiunta alle colonne dei gruppi di età 50–64 anni e >65 anni per il vaccino contro morbillo, parotite, rosolia (MMR).
- La colonna, “Diabete, malattia cardiaca, malattia polmonare cronica, o malattia epatica cronica compreso l’alcolismo cronico” è stata trasposta con la colonna, “Immunodeficienza congenita, leucemia, linfoma, neoplasia generalizzata, terapia con agenti alchilanti, antimetaboliti, perdite di liquido cerebrospinale, radiazioni, o grandi quantità di corticosteroidi” sulla tabella medica / altre indicazioni (Figura 2) in modo che le controindicazioni per i vaccini MMR e varicella sono ora fianco a fianco.
- La riga per il vaccino contro la varicella è stata spostata in alto su entrambe le figure (cioè, immediatamente dopo il vaccino MMR) perché il vaccino è ora universalmente raccomandato per alcuni gruppi di età.
- Il vaccino meningococcico è stato aggiunto al programma medico/altre indicazioni (Figura 2). La nota è stata rivista per incorporare le raccomandazioni ACIP recentemente pubblicate per questo vaccino (1).
- La nota relativa a tetano e difterite (#1) è stata riformulata.
- La nota relativa alla varicella (#3) è stata riformulata in conformità alle raccomandazioni ACIP adottate nel giugno 2005.
- La nota a piè di pagina sull’influenza (#4) è stata rivista per aggiungere la più recente condizione ad alto rischio: condizioni neuromuscolari che compromettono la funzione respiratoria (2).
- È stata aggiunta una decima nota a piè di pagina riguardante la vaccinazione contro l’Haemophilus influenzae tipo b per popolazioni ad alto rischio (cioè, persone con asplenia, leucemia e infezione da virus dell’immunodeficienza umana).
Il programma di immunizzazione degli adulti è disponibile in inglese e spagnolo all’indirizzo http://www.cdc.gov/nip/recs/adult-schedule.htm. Informazioni generali sull’immunizzazione degli adulti, comprese le raccomandazioni riguardanti la vaccinazione delle persone con HIV e altre condizioni immunosoppressive, sono disponibili presso i dipartimenti sanitari statali e locali e presso il National Immunization Program al http://www.cdc.gov/nip. Le dichiarazioni informative sui vaccini sono disponibili all’indirizzo http://www.cdc.gov/nip/pubblicazioni/vis. Le dichiarazioni ACIP per ogni vaccino raccomandato possono essere visualizzate, scaricate e stampate dal sito web del National Immunization Program a http://www.cdc.gov/nip/publications/acip-list.htm. Le istruzioni per la segnalazione di eventi avversi al Vaccine Adverse Event Reporting System sono disponibili al http://www.vaers.hhs.gov o per telefono, 800-822-7967.
- CDC. Prevenzione e controllo della malattia meningococcica: raccomandazioni del Comitato consultivo per le pratiche di immunizzazione (ACIP). MMWR 2005;54(No. RR-7).
- CDC. Prevenzione e controllo dell’influenza: raccomandazioni del Comitato consultivo per le pratiche di immunizzazione (ACIP). MMWR 2005;54(No. RR-8).
Figura 1
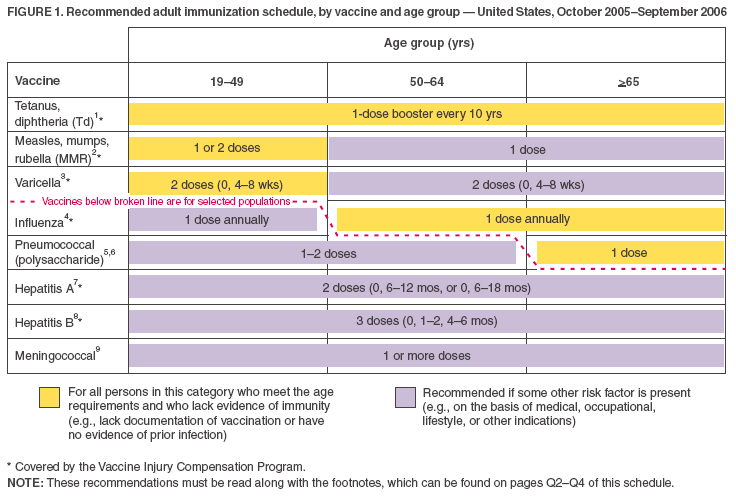
Ritorna in alto.
Figura 2

Ritorna in alto.
Approvato dal Comitato consultivo sulle pratiche di immunizzazione, dall’American College of Obstetricians and Gynecologists e dall’American Academy of Family Physicians
1. Vaccinazione antitetanica e antidifterica (Td). Gli adulti con storie incerte di una serie completa di vaccinazione primaria con vaccini contenenti difterite e tossoide tetanico dovrebbero ricevere una serie primaria usando il tossoide Td combinato. Una serie primaria per gli adulti è di 3 dosi; somministrare le prime 2 dosi ad almeno 4 settimane di distanza e la terza dose 6-12 mesi dopo la seconda. Somministrare 1 dose se la persona ha ricevuto la serie primaria e se l’ultima vaccinazione è stata ricevuta >10 anni prima. Consultare la dichiarazione ACIP per le raccomandazioni per la somministrazione di Td come profilassi nella gestione delle ferite (http://www.cdc.gov/mmwr/preview/mmwrhtml/00041645.htm). L’American College of Physicians Task Force on Adult Immunization sostiene una seconda opzione per l’uso della Td negli adulti: un singolo richiamo Td all’età di 50 anni per le persone che hanno completato la serie pediatrica completa, compreso il richiamo per adolescenti/giovani adulti. Un vaccino tetano-difterico-acellulare-pertosse di recente autorizzazione è disponibile per gli adulti. Le raccomandazioni ACIP per il suo uso saranno pubblicate.
2. Vaccinazione contro morbillo, parotite, rosolia (MMR). Componente del morbillo: gli adulti nati prima del 1957 possono essere considerati immuni al morbillo. Gli adulti nati durante o dopo il 1957 dovrebbero ricevere >1 dose di MMR a meno che non abbiano una controindicazione medica, una documentazione di >1 dose, una storia di morbillo basata sulla diagnosi di un fornitore di assistenza sanitaria, o prove di laboratorio di immunità. Una seconda dose di MMR è raccomandata per gli adulti che 1) sono stati recentemente esposti al morbillo o in un focolaio; 2) sono stati precedentemente vaccinati con il vaccino ucciso contro il morbillo; 3) sono stati vaccinati con un tipo sconosciuto di vaccino contro il morbillo durante il 1963–1967; 4) sono studenti in istituzioni educative post-secondarie; 5) lavorano in una struttura sanitaria; o 6) prevedono di viaggiare a livello internazionale. Trattenere il MMR o altri vaccini contenenti morbillo da persone con infezione da HIV con grave immunosoppressione. Componente parotite: 1 dose di vaccino MMR dovrebbe essere adeguata per la protezione di coloro che sono nati durante o dopo il 1957 e che non hanno una storia di parotite basata sulla diagnosi di un operatore sanitario o che non hanno prove di laboratorio di immunità. Componente rosolia: somministrare 1 dose di vaccino MMR alle donne la cui storia di vaccinazione contro la rosolia non è affidabile o che non hanno prove di laboratorio di immunità. Per le donne in età fertile, indipendentemente dall’anno di nascita, determinare di routine l’immunità alla rosolia e consigliare le donne sulla sindrome da rosolia congenita. Non vaccinare donne che sono incinte o che potrebbero rimanere incinte entro 4 settimane dal ricevimento del vaccino. Le donne che non hanno prove di immunità dovrebbero ricevere il vaccino MMR al completamento o al termine della gravidanza e prima della dimissione dalla struttura sanitaria.
3. Vaccinazione contro la varicella. La vaccinazione contro la varicella è raccomandata per tutti gli adulti senza evidenza di immunità alla varicella. Particolare considerazione dovrebbe essere data a coloro che 1) hanno stretto contatto con persone ad alto rischio di malattia grave (operatori sanitari e contatti familiari di persone immunocompromesse) o 2) sono ad alto rischio di esposizione o trasmissione (ad esempio, gli insegnanti di bambini piccoli; dipendenti di assistenza all’infanzia; residenti e membri del personale di ambienti istituzionali, compresi gli istituti correzionali; studenti universitari; personale militare; adolescenti e adulti che vivono in famiglie con bambini; donne non incinte in età fertile; e viaggiatori internazionali). La prova dell’immunità alla varicella negli adulti include uno dei seguenti elementi: 1) vaccinazione documentata contro la varicella adeguata all’età (cioè, ricevimento di 1 dose prima dei 13 anni di età o ricevimento di 2 dosi dopo i 13 anni di età); 2) persone nate negli Stati Uniti prima del 1966 o storia di malattia da varicella prima del 1966 per persone non nate negli Stati Uniti; 3) storia di varicella.nati negli USA; 3) anamnesi di varicella basata sulla diagnosi di un operatore sanitario o sulla dichiarazione dei genitori o su se stessi di una tipica malattia da varicella per le persone nate durante il 1966–1997 (per un paziente che riporta un’anamnesi di un caso atipico, lieve, gli operatori sanitari dovrebbero cercare o un collegamento epidemiologico con un tipico caso di varicella o la prova della conferma di laboratorio, se è stata eseguita al momento della malattia acuta); 4) anamnesi di herpes zoster basata sulla diagnosi di un operatore sanitario; o 5) prove di laboratorio di immunità. Non vaccinare le donne che sono incinte o che potrebbero diventare incinte entro 4 settimane dal ricevimento del vaccino. Valutare le donne incinte per la prova di immunità alla varicella. Le donne che non hanno prove di immunità dovrebbero ricevere la dose 1 del vaccino contro la varicella al completamento o al termine della gravidanza e prima della dimissione dalla struttura sanitaria. La dose 2 dovrebbe essere somministrata 4-8 settimane dopo la dose 1.
4. Vaccinazione antinfluenzale. Indicazioni mediche: disturbi cronici del sistema cardiovascolare o polmonare, inclusa l’asma; malattie metaboliche croniche, incluso il diabete mellito, disfunzioni renali, emoglobinopatie, o immunosoppressione (inclusa immunosoppressione causata da farmaci o HIV); qualsiasi condizione (es, disfunzione cognitiva, lesione del midollo spinale, disturbo convulsivo o altro disturbo neuromuscolare) che compromette la funzione respiratoria o la gestione delle secrezioni respiratorie o che può aumentare il rischio di aspirazione; e gravidanza durante la stagione influenzale. Non esistono dati sul rischio di malattie influenzali gravi o complicate tra persone con asplenia; tuttavia, l’influenza e’ un fattore di rischio per infezioni batteriche secondarie che possono causare malattie gravi tra persone con asplenia. Indicazioni professionali: operatori sanitari e dipendenti di strutture di assistenza a lungo termine e di vita assistita. Altre indicazioni: residenti di case di cura e altre strutture di assistenza a lungo termine e di vita assistita; persone che possono trasmettere l’influenza a persone ad alto rischio (cioè, contatti domestici e badanti di bambini di età compresa tra 0 e 23 mesi, o persone di tutte le età con condizioni ad alto rischio), e chiunque desideri essere vaccinato. Per le persone sane e non incinte di età compresa tra i 5 e i 49 anni senza condizioni ad alto rischio che non sono contatti di persone gravemente immunocompromesse in unità di cura speciali, il vaccino antinfluenzale somministrato per via intranasale (FluMist®) può essere somministrato al posto del vaccino inattivato.
5. Vaccinazione polisaccaridica pneumococcica. Indicazioni mediche: disturbi cronici del sistema polmonare (esclusa l’asma); malattie cardiovascolari; diabete mellito; malattie croniche del fegato, comprese le malattie del fegato a seguito di abuso di alcol (ad esempio, cirrosi); insufficienza renale cronica o sindrome nefrosica; asplenia funzionale o anatomica (ad es, falcemia o splenectomia); condizioni immunosoppressive (ad esempio, immunodeficienza congenita, infezione da HIV, leucemia, linfoma, mieloma multiplo, malattia di Hodgkin, neoplasia generalizzata, o trapianto di organi o midollo osseo); chemioterapia con agenti alchilanti, antimetaboliti, o corticosteroidi sistemici a lungo termine; e impianti cocleari. Altre indicazioni: Nativi dell’Alaska e alcune popolazioni di indiani d’America; residenti di case di cura e altre strutture di assistenza a lungo termine.
6. Rivaccinazione con vaccino pneumococcico polisaccaridico. Rivaccinazione una tantum dopo 5 anni per le persone con insufficienza renale cronica o sindrome nefritica; asplenia funzionale o anatomica (ad esempio, malattia falciforme o splenectomia); condizioni immunosoppressive (ad es, immunodeficienza congenita, infezione da HIV, leucemia, linfoma, mieloma multiplo, malattia di Hodgkin, malignità generalizzata, o trapianto di organi o midollo osseo); o chemioterapia con agenti alchilanti, antimetaboliti, o corticosteroidi sistemici a lungo termine. Per le persone di età >65 anni, rivaccinazione una tantum se sono stati vaccinati >5 anni prima ed erano di età <65 anni al momento della vaccinazione primaria.
7. Vaccinazione contro l’epatite A. Indicazioni mediche: persone con disturbi del fattore di coagulazione o malattia epatica cronica. Indicazioni comportamentali: uomini che fanno sesso con uomini o consumatori di droghe illegali. Indicazioni professionali: Persone che lavorano con primati infettati dal virus dell’epatite A (HAV) o con HAV in un laboratorio di ricerca. Altre indicazioni: persone che viaggiano o lavorano in paesi che hanno un’endemicità alta o intermedia dell’epatite A (per la lista dei paesi, vederehttp://www.cdc.gov/travel/diseases.htm#hepa) così come qualsiasi persona che desidera ottenere l’immunità. I vaccini attuali devono essere somministrati in una serie di 2 dosi a 0 e 6-12 mesi, o 0 e 6-18 mesi. Se viene utilizzato il vaccino combinato per l’epatite A e l’epatite B, somministrare 3 dosi a 0, 1 e 6 mesi.
8. Vaccinazione contro l’epatite B. Indicazioni mediche: pazienti in emodialisi (usare una formulazione speciale o due dosi da 20 µg/mL) o pazienti che ricevono concentrati di fattore di coagulazione. Indicazioni professionali: operatori sanitari e di pubblica sicurezza che hanno esposizione al sangue sul posto di lavoro e persone in formazione nelle scuole di medicina, odontoiatria, infermieristica, tecnologia di laboratorio e altre professioni sanitarie alleate. Indicazioni comportamentali: consumatori di droghe iniettabili; persone con più di un partner sessuale nei 6 mesi precedenti; persone con una malattia a trasmissione sessuale (STD) acquisita di recente; e uomini che fanno sesso con altri uomini. Altre indicazioni: contatti familiari e partner sessuali di persone con infezione cronica da virus dell’epatite B (HBV); clienti e membri del personale di istituti per persone con disabilità di sviluppo; tutti i clienti di cliniche STD; detenuti di istituti di correzione; e viaggiatori internazionali che saranno in paesi con alta o media prevalenza di infezione cronica da HBV per più di 6 mesi (per l’elenco dei paesi, vedere http://www.cdc.gov/travel/diseases.htm#hepa).
9. Vaccinazione meningococcica. Indicazioni mediche: adulti con asplenia anatomica o funzionale o carenze terminali dei componenti del complemento. Altre indicazioni: studenti universitari del primo anno che vivono nei dormitori; microbiologi che sono abitualmente esposti a isolati di Neisseria meningitidis; reclute militari; e persone che viaggiano o risiedono in paesi in cui la malattia meningococcica è iperendemica o epidemica (ad esempio, la “cintura della meningite” dell’Africa subsahariana durante la stagione secca), in particolare se il contatto con le popolazioni locali sarà prolungato. La vaccinazione è richiesta dal governo dell’Arabia Saudita per tutti i viaggiatori che si recano alla Mecca durante l’Hajj annuale. Il vaccino meningococcico coniugato è preferito per gli adulti che soddisfano una qualsiasi delle indicazioni di cui sopra e che sono di età <55 anni, anche se il vaccino polisaccaridico meningococcico (MPSV4) è un’alternativa accettabile. La rivaccinazione dopo 5 anni potrebbe essere indicata per gli adulti precedentemente vaccinati con MPSV4 che rimangono ad alto rischio di infezione (ad esempio, persone residenti in aree in cui la malattia è epidemica).
10. Condizioni selezionate per le quali può essere utilizzato il vaccino Haemophilus influenzae tipo b (Hib). I vaccini coniugati Hib sono autorizzati per i bambini di età compresa tra 6 e 71 mesi. Non sono disponibili dati di efficacia su cui basare una raccomandazione relativa all’uso del vaccino Hib per i bambini più grandi e per gli adulti con condizioni croniche associate ad un aumentato rischio di malattia da Hib. Tuttavia, gli studi suggeriscono una buona immunogenicità nei pazienti che hanno l’anemia falciforme, la leucemia o l’infezione da HIV o che hanno avuto splenectomie; la somministrazione del vaccino a questi pazienti non è controindicata.
Il Recommended Adult Immunization Schedule è stato approvato dall’Advisory Committee on Immunization Practices, l’American College of Obstetricians and Gynecologists e l’American Academy of Family Physicians. Il formato standard della nota MMWR è stato modificato per la pubblicazione di questo programma.
Citazione suggerita: Centri per il controllo e la prevenzione delle malattie. Recommended Adult Immunization Schedule—United States, October 2005–September 2006. MMWR 2005;54:Q1–Q4.
Questo programma indica i gruppi di età raccomandati e le indicazioni mediche per la somministrazione di routine dei vaccini attualmente autorizzati per persone di età >19 anni. I vaccini combinati autorizzati possono essere utilizzati ogni volta che uno qualsiasi dei componenti della combinazione è indicato e quando gli altri componenti del vaccino non sono controindicati. Per raccomandazioni dettagliate, consultare i foglietti illustrativi dei produttori e le dichiarazioni complete dell’ACIP (http://www.cdc.gov/nip/publications/acip-list.htm).
Riportare tutte le reazioni postvaccinazione clinicamente significative al Vaccine Adverse Event Reporting System (VAERS). I moduli di segnalazione e le istruzioni su come presentare un rapporto VAERS sono disponibili per telefono, 800-822-7967, o dal sito web VAERS a http://www.vaers.hhs.gov.
Informazioni su come presentare una richiesta di risarcimento per lesioni da vaccino è disponibile a http://www.hrsa.gov/osp/vicp o per telefono, 800-338-2382. Per presentare una richiesta di risarcimento per lesioni da vaccino, contattare la U.S. Court of Federal Claims, 717 Madison Place, N.W., Washington, DC 20005, telefono 202-357-6400.
Informazioni aggiuntive sui vaccini sopra elencati e sulle controindicazioni alla vaccinazione sono disponibili anche al http://www.cdc.gov/nip o presso il Contact Center CDC-INFO al numero 800-CDC-INFO (232-4636) in inglese e spagnolo, 24 ore al giorno, 7 giorni alla settimana.
L’uso di nomi commerciali e fonti commerciali è solo per l’identificazione e non implica l’approvazione da parte del Dipartimento della Salute e dei Servizi Umani degli Stati Uniti.I riferimenti a siti non-CDC su Internet sono forniti come servizio ai lettori di MMWR e non costituiscono o implicano l’approvazione di queste organizzazioni o dei loro programmi da parte del CDC o del Dipartimento della Salute e dei Servizi Umani degli Stati Uniti. CDC non è responsabile del contenuto delle pagine trovate in questi siti. Gli indirizzi URL elencati nel MMWR erano aggiornati alla data di pubblicazione.
Disclaimer Tutte le versioni HTML di articoli del MMWR sono conversioni elettroniche da testo ASCII in HTML. Questa conversione può aver causato errori di traduzione dei caratteri o di formato nella versione HTML. Gli utenti non devono fare affidamento su questo documento HTML, ma sono rinviati alla versione elettronica PDF e/o alla copia cartacea originale MMWR per il testo ufficiale, le figure e le tabelle. Una copia cartacea originale di questo numero può essere richiesta al Superintendent of Documents, U.S. Government Printing Office (GPO), Washington, DC 20402-9371; telefono: (202) 512-1800. Contattare GPO per i prezzi correnti.
**Domande o messaggi riguardanti errori di formattazione devono essere indirizzati a [email protected].
Data dell’ultima revisione: 10/13/2005
