Autore: Amelie Stahlbuhk
ritorno al solfato
Questo articolo sarà rilasciato presto.
Abstract
Saranno presentate le diverse forme idrate di solfato di magnesio e il comportamento riguardo alla solubilità e igroscopicità.
Forme idrate
Kieserite MgSO4-H2O
Sanderite MgSO4-2H2O
Starkeyite MgSO4-4H2O
Pentaidrite MgSO4-5H2O
Esaidrite MgSO4-6H2O
Epsomite MgSO4-7H2O
Meridianiite MgSO4-11H2O
Solubilità
Come risulta dalla tabella 1, le diverse forme idrate di solfato di magnesio sono sali facilmente solubili, il che porta ad un’alta mobilità dei sali nei materiali porosi.
| Forma idrata | Solubilità a 20°C |
| Kieserite | 5.60 |
| Starkeyite | 5.04 |
| Pentahydrite | 4.40 |
| Hexahydrite | 3.61 |
| Epsomite | 2.84 |
A causa delle diverse forme idrate di solfato di magnesio con equilibri stabili e meta stabili, il diagramma di solubilità del sistema MgSO4-H2O contiene più informazioni dei diagrammi dei sali con meno o anche senza forme idrate. Con la dipendenza dalla temperatura della solubilità è possibile che i cambiamenti di temperatura siano accompagnati da un’idratazione o una disidratazione di una fase considerata.
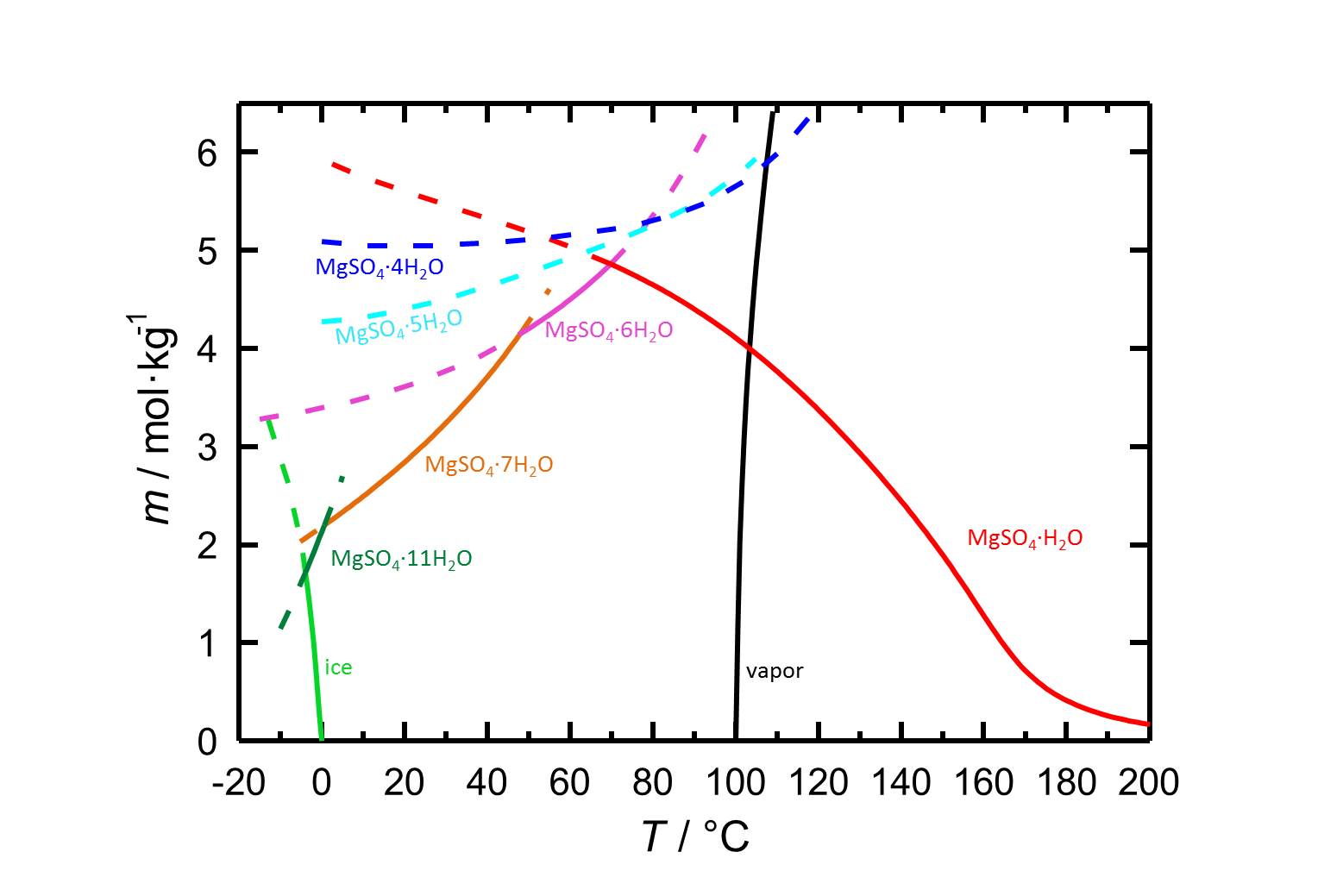
Autore: Steiger, Michael; Linnow, Kirsten; Ehrhardt, Dorothee; Rohde, Mandy
 .
.Hygroscopicity
Nel sistema MgSO4-H2O cambiamenti di temperatura o umidità relativa possono portare a processi di idratazione/deidratazione o deliquescenza/cristallizzazione. A 20 °C l’epsomite è la fase cristallina presente quando l’umidità relativa è inferiore alla sua umidità di deliquescenza del 91,3%. Quando l’umidità relativa raggiunge valori inferiori al 47% inizia la disidratazione a livelli idratati inferiori, come è rappresentato dalle curve delle umidità di equilibrio nella figura 2.
| Transizione di fase | Deliquescenza o umidità di equilibrio a 20°C |
| Epsomite-soluzione | 91,3 % |
| Epsomite-esaidrite | 46.6 % |
| Epsomite-Kieserite | 46.7 % |
| Esaidrite-Starkeyite | 39.1 % |
accompagnato da un’idratazione o una disidratazione di una fase considerata.
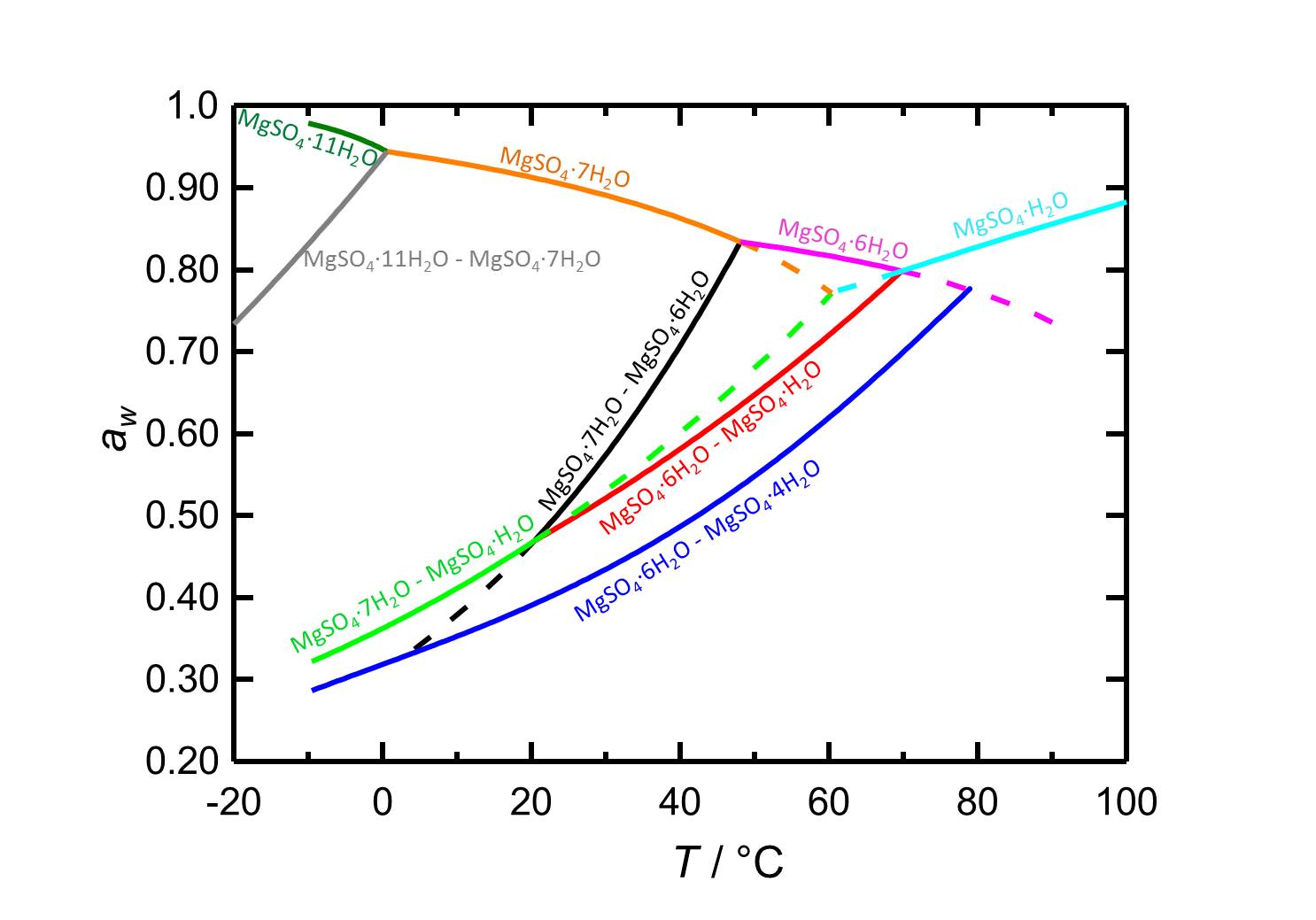
Autore: Steiger, Michael; Linnow, Kirsten; Ehrhardt, Dorothee; Rohde, Mandy
 .
.Nell’intervallo di temperatura da -10 a 100 °C le umidita’ di deliquescenza delle forme idrate presenti (a seconda della temperatura) si trovano sempre sopra l’80 % u.r, quindi i sali non appartengono ai sali igroscopici.
Weblinks
Letteratura
| Mainusch, Nils (2001): Erstellung einer Materialsammlung zur qualitativen Bestimmung bauschädlicher Salze für Fachleute der Restaurierung, Diplomarbeit, HAWK Hochschule für angewandte Wissenschaft und Kunst Hildesheim/Holzminden/Göttingen, file:Diplomarbeit Nils Mainusch.pdf |   |
|
| Stark, Jochen; Stürmer, Sylvia (1996): Bauschädliche Salze, Bauhaus-Univ. Weimar |  |
|
| Steiger, Michael; Linnow, Kirsten; Ehrhardt, Dorothee; Rohde, Mandy (2011): Reazioni di decomposizione di idrati di solfato di magnesio ed equilibri di fase nei sistemi MgSO4-H2O e Na+-Mg2+-Cl–SO42–H2O con implicazioni per Marte. Geochimica et Cosmochimica Act, 75 (12), 3600-3626, 10.1016/j.gca.2011.03.038, |  |
