 Articolo ad accesso aperto
Articolo ad accesso aperto Questo articolo ad accesso aperto è rilasciato sotto una
Questo articolo ad accesso aperto è rilasciato sotto una
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc e Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
college of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Prima pubblicazione il 27 marzo 2017
I derivati del polietilenglicole (PEG) sono stati ampiamente utilizzati nella ricerca bio-correlata. Tuttavia, gli oligomeri di PEG (con diversi pesi molecolari) o i monomeri a base di PEG (con diversi gruppi terminali della catena) hanno effettivamente diverse proprietà chimiche e fisiche, che potrebbero portare a una potenziale tossicità. In questo lavoro, la citotossicità di una serie di derivati del PEG (oligomeri e monomeri) è stata misurata usando cellule di cancro cervicale umano (HeLa) e una linea cellulare di fibroblasti derivati da topi (L929) come cellule modello. La maggior parte degli oligomeri PEG sono sicuri per entrambi i tipi di cellule, tranne il trietilenglicole (TEG), che è tossico ad alte concentrazioni per le cellule L929. D’altra parte, i monomeri a base di PEG tra cui il poli (etilenglicole) metil etere acrilato (mPEGA) e il poli (etilenglicole) metil etere metacrilato (mPEGMA) hanno mostrato una citotossicità evidente. Successivamente, questi derivati PEG tossici sono stati studiati per rivelare i diversi meccanismi della loro tossicità. Questa ricerca attuale ha valutato la citotossicità dei derivati del PEG e ha evidenziato il potenziale pericolo dei biomateriali ‘sicuri’, che potrebbe offrire un utile riferimento per le persone che utilizzano i derivati del PEG nella futura ricerca biomedica.
Introduzione
Il polietilenglicole (PEG) è stato ampiamente applicato in vari campi medici grazie alle sue proprietà eccezionali come la sicurezza soddisfacente, la biocompatibilità, l’idrofilia ecc. Per esempio, il PEG è stato usato in alcuni lassativi approvati dalla Food and Drug Administration per la sua eccellente capacità di ritenzione dell’umidità e di lubrificazione.1-3 In un altro esempio, la modifica di farmaci/proteine con il PEG (PEGilazione) può migliorare efficacemente la loro idrosolubilità e l’emivita di circolazione dei farmaci,4,5 con conseguente maggiore sicurezza ed effetti terapeutici. Attualmente, la PEGilazione sta diventando una delle biotecnologie più attraenti e sta ottenendo un enorme successo nella ricerca fondamentale e nel mercato.6-11 Ormai, molti derivati del PEG sono stati usati come eccellenti materiali di partenza per sintetizzare una serie di nuovi materiali polimerici per bioapplicazioni.12 Per esempio, un PEG lineare è stato modificato come un PEG difunzionalizzato (DF-PEG) che potrebbe essere usato per generare rapidamente un interessante idrogel autorigenerante.13,14 Alcuni oligomeri PEG sono stati usati per modificare la superficie delle nano-particelle inorganiche per migliorare la solubilità in acqua e ridurre la tossicità di questi materiali inorganici.15-17 Alcuni monomeri commerciali a base di PEG come il poli(etilenglicole) metil etere acrilato (mPEGA) e il poli(etilenglicole) metil etere metacrilato (mPEGMA) sono stati usati per preparare polimeri ramificati per la successiva coniugazione delle proteine, l’auto-assemblaggio, il rilascio di farmaci ecc.18-27
Anche se il PEG è normalmente considerato come quasi non tossico, alcuni problemi di sicurezza del PEG con basso peso molecolare sono stati notati dai ricercatori. Smyth et al. hanno riportato la tossicità cronica orale dell’oligomero PEG (Mn ∼ 200) nei ratti,28,29 i risultati negativi sono stati osservati anche nelle scimmie,30 suggerendo potenziali problemi di sicurezza di questi materiali “sicuri”. Pertanto, considerato l’ampio utilizzo dei derivati del PEG nelle aree di ricerca, lo studio sistematico della citotossicità di questi oligomeri del PEG e dei monomeri a base di PEG è necessario e importante per la loro ulteriore applicazione nei campi biologici (Schema 1).
Nel presente lavoro è stata valutata la citotossicità di alcuni oligomeri di PEG (con diversi pesi molecolari) e di monomeri commerciali a base di PEG (con diversi gruppi terminali della catena) verso cellule di cancro cervicale umano (HeLa) e una linea cellulare di fibroblasti derivati da topi (L929). La citotossicità dipendente dal peso molecolare degli oligomeri di PEG è stata osservata, e i diversi meccanismi di citotossicità degli oligomeri di PEG e dei monomeri a base di PEG sono stati rivelati per la prima volta. Queste informazioni sulla citotossicità dei derivati del PEG potrebbero essere riferimenti preziosi per le persone per scegliere il PEG come materiale di partenza e progettare percorsi di purificazione per preparare materiali biocompatibili a base di PEG per ulteriori applicazioni biomediche.
Materiali e metodi
2.1 Prodotti chimici
Trietilenglicole (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poli(etilenglicole) metil etere acrilato 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poli(etilenglicole) metiletere metacrilato 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) e poli(etilenglicole) metiletere metacrilato 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) sono stati usati direttamente senza ulteriore purificazione.
Cellule umane di cancro cervicale (HeLa) e una linea cellulare di fibroblasti derivati da topi (L929) sono state acquistate dalla American type culture collection (ATCC). Il terreno di coltura Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), Phosphate Buffered Saline (PBS, pH ∼ 7.2-7.4, 0.01 M, Solarbio), fetal bovine serum (FBS, Gibco), Roswell Park Memorial Institute 1640 culture medium (RPMI 1640 culture medium, Gibco), penicillin-streptomycin solution (Gibco), trypsin-EDTA (Gibco, 0.25%), 4-(3-(2-metossi-4-nitrofenil)-2-(4-nitrofenil)-2H-tetrazol-3-ium-5-yl)benzene-1,3-disolfonato (CCK-8, Beyotime), 2,7-diclorodiidrofluoresceina diacetato (DCFH-DA, Beyotime), glutatione ossidato (GSSG, Beyotime), nicotinamide adenina dinucleotide fosfato (NADPH, Beyotime), 5,5′-ditiobis-(acido 2-nitrobenzoico) (DTNB, Beyotime), fluoresceina diacetato (FDA, Sigma) e ioduro di propidio (PI, 94%, Sigma) sono stati utilizzati come acquistati.
2.2 Coltura cellulare
La coltura cellulare è stata mantenuta in un incubatore a 37 °C con 5% di CO2, il mezzo di coltura è stato cambiato ogni uno o due giorni per mantenere la crescita esponenziale delle cellule. Le cellule HeLa sono state derivate da cellule di cancro cervicale e coltivate in terreno DMEM integrato con 10% di siero bovino fetale (FBS) e 1% di penicillina e streptomicina. Le cellule L929 sono state derivate da topi e coltivate in un terreno RPMI 1640 integrato con il 10% di siero fetale bovino (FBS) e l’1% di penicillina e streptomicina.
2.3 Analisi della citotossicità
I risultati sono stati presentati come media ± deviazione standard (SD), e i valori della metà della concentrazione massima inibitoria 50% (IC50) dei derivati PEG sono stati calcolati da SPSS 15.0.
Secondo il nostro lavoro precedente,32,33 fluoresceina diacetato (FDA) e ioduro di propidio (PI) potrebbe essere utilizzato come un metodo rapido e conveniente doppia colorazione per osservare la vitalità cellulare. Le cellule L929 sono state seminate in una piastra da 24 pozzetti ad una densità di ∼5 × 104 cellule per mL. Dopo l’attacco, le cellule sono state lavate con PBS e coltivate con diverse concentrazioni di derivati PEG nel terreno di coltura per 24 ore. Poi, il terreno è stato rimosso, le cellule sono state lavate con PBS. Una soluzione mista PBS-FDA-PI (FDA: 3 μg mL-1; PI: 3 μg mL-1) è stata successivamente aggiunta e la piastra da 24 pozzetti è stata incubata a 37 °C per 15 min. Un microscopio a fluorescenza (Leica Germania) è stato utilizzato per osservare le cellule vive e morte sotto 450-490 nm e 515-560 nm filtri di eccitazione passa-banda (I3 e N2.1), rispettivamente (100 W lampada al mercurio).
In breve, le cellule L929 sono state seminate in una piastra a 24 pozzetti e incubate in 0,5 mL di terreno di coltura con diversa concentrazione di TEG (A, A′) per 1 h (Fig. 1), A1-A6 pozzi sono stati utilizzati per misurare la quantità totale di glutatione (GSH + GSSG) mentre A′1-A′6 pozzi sono stati utilizzati per misurare la quantità di glutatione ossidato (GSSG) in presenza di TEG. Dopo 1 h, le cellule sono state raccolte da digestione tripsina e centrifugazione (1000 rpm, 5 min). Poi, è stato aggiunto un triplo volume di soluzione di rimozione delle proteine (50 mg mL-1) per rimuovere le proteine rumorose. Dopo tre cicli rapidi di congelamento-scongelamento in azoto liquido e un bagno d’acqua a 37 °C, le sospensioni sono state poste in frigorifero (4 °C) per 5 min, e i campioni di surnatante cellulare sono stati ottenuti dopo la centrifugazione (10 000 rpm, 10 min). I campioni dai pozzetti A1-A6 sono stati utilizzati per misurare il livello di glutatione totale (GSH + GSSG). La soluzione di NADPH (0,5 mg mL-1) è stata aggiunta per ridurre tutto il glutatione a GSH, poi, 5,5′-ditiobis-(acido 2-nitrobenzoico) (DTNB) è stato usato per ossidare il GSH, l’assorbanza modificata a 405 nm è stata registrata da un lettore di micropiastre (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 I campioni dai pozzetti A′1-A′6 sono stati utilizzati per misurare il livello di glutatione ossidato (GSSG). Utilizzando la soluzione di rimozione GSH, solo GSSG è stato lasciato nella soluzione del campione. I campioni sono stati analizzati con lo stesso metodo di cui sopra per misurare il livello di GSSG. La quantità di glutatione totale e la quantità di glutatione ossidato sono state raccolte per calcolare il livello di glutatione ridotto, mentre il livello di GSH delle cellule in terreno di coltura puro è stato usato come controllo. I risultati sono stati presentati come media ± SD.
000 rpm, 10 min). I campioni dai pozzetti A1-A6 sono stati utilizzati per misurare il livello di glutatione totale (GSH + GSSG). La soluzione di NADPH (0,5 mg mL-1) è stata aggiunta per ridurre tutto il glutatione a GSH, poi, 5,5′-ditiobis-(acido 2-nitrobenzoico) (DTNB) è stato usato per ossidare il GSH, l’assorbanza modificata a 405 nm è stata registrata da un lettore di micropiastre (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 I campioni dai pozzetti A′1-A′6 sono stati utilizzati per misurare il livello di glutatione ossidato (GSSG). Utilizzando la soluzione di rimozione GSH, solo GSSG è stato lasciato nella soluzione del campione. I campioni sono stati analizzati con lo stesso metodo di cui sopra per misurare il livello di GSSG. La quantità di glutatione totale e la quantità di glutatione ossidato sono state raccolte per calcolare il livello di glutatione ridotto, mentre il livello di GSH delle cellule in terreno di coltura puro è stato usato come controllo. I risultati sono stati presentati come media ± SD.
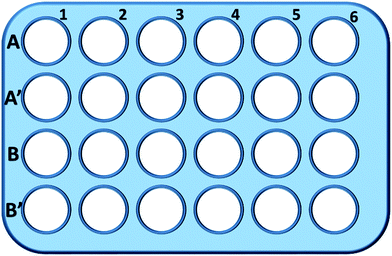
I pozzetti in linea B e B′ sono stati utilizzati per testare la quantità totale di GSH e GSSG in presenza di mPEGA-480, rispettivamente, attraverso la stessa procedura.
Risultati e discussione
3.1 Studio della vitalità cellulare
Quando è stata usata la cellula HeLa (un modello di cellule tumorali) (Fig. 2A), la citotossicità di tutti gli oligomeri di PEG a basse concentrazioni (≤5 mg mL-1) poteva essere trascurata. Con l’aumento della concentrazione (≥10 mg mL-1), è stata osservata la citotossicità dipendente dal peso molecolare dei campioni di PEG. Il trietilenglicole (TEG) ha mostrato un’evidente citotossicità oltre i 10 mg mL-1 (p < 0,05; contrasto con qualsiasi altro oligomero quando la concentrazione è superiore a 5 mg mL-1) e il valore IC50 del TEG alle cellule HeLa è stato calcolato come 19,8 mg mL-1. Nel frattempo, altri oligomeri PEG (Mn ∼ 400-4000) hanno anche mostrato una citotossicità minuscola.
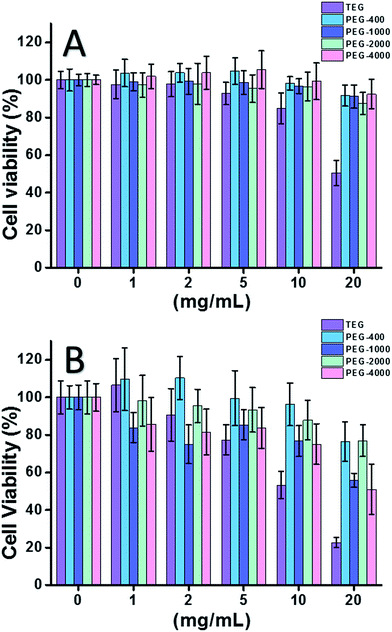
È stata valutata anche la citotossicità degli oligomeri di PEG alle cellule L929 (un modello di cellule normali) (Fig. 2B). La vitalità delle cellule è diminuita con l’aumento della concentrazione di PEG come previsto. Oltre al TEG, alcuni oligomeri PEG (PEG-1000, PEG-4000) che sono sicuri per le cellule HeLa hanno anche mostrato una citotossicità rilevabile, i valori IC50 di TEG, PEG-1000 e PEG-4000 sono stati calcolati come 12,4, 22,5, e 20,0 mg mL-1 alle cellule L929, rispettivamente, indicando anche la citotossicità dipendente dal peso molecolare degli oligomeri PEG.
I risultati di cui sopra hanno suggerito che le cellule HeLa hanno una migliore tolleranza agli oligomeri PEG rispetto alle cellule L929 a causa della tenace vitalità delle cellule tumorali, e il TEG ha una citotossicità molto più elevata rispetto ad altri oligomeri PEG con pesi molecolari più elevati (p < 0,05; contrasto con qualsiasi altro oligomero quando la concentrazione è superiore a 5 mg mL-1). Si nota che la ricerca attuale ha dimostrato la moderata citotossicità di PEG-1000 e PEG-4000 per le cellule L929, e la quasi non citotossicità di PEG-400 e PEG-2000, che è diversa dall’impressione comune che i PEG ad alto peso molecolare dovrebbero essere più biocompatibili delle loro controparti a basso peso molecolare. Anche se la ragione della citotossicità del PEG non è ancora chiara, il PEG-400 e il PEG-2000 sembrano essere scelte migliori per le persone per sintetizzare materiali biocompatibili.
Quando mPEGMA-500 è stato testato, la vitalità cellulare sia delle cellule HeLa che delle cellule L929 è diminuita con l’aumento della concentrazione di mPEGMA-500 (Fig. 3A), e non è stata osservata alcuna differenza apparente tra due tipi di cellule. I valori IC50 di mPEGMA-500 sono 4,7 mg mL-1 per le cellule HeLa, e 5,3 mg mL-1 per le cellule L929 dopo 24 ore di cultura, indicando citotossicità più significativa di mPEGMA-500 rispetto ai suddetti oligomeri PEG, e implicando i gruppi terminali della catena di derivati PEG sono fondamentali per la loro tossicità. Quando mPEGMA-950, un altro metacrilato a base di PEG con lo stesso gruppo terminale della catena, ma più alto peso molecolare è stato testato attraverso la stessa procedura (Fig. 3B), citotossicità molto più bassa di mPEGMA-950 alle cellule HeLa o cellule L929 è stato osservato (p < 0,05; quando la concentrazione è superiore a 2 mg mL-1), i valori IC50 di mPEGMA-950 sono 20,8 mg mL-1 a cellule HeLa, e 21.7 mg mL-1 alle cellule L929 dopo 24 ore di coltura, dimostrando anche la citotossicità dipendente dal peso molecolare del metacrilato a base di PEG.
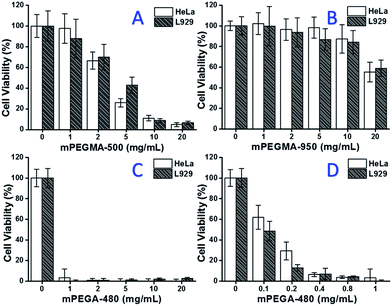
Inoltre, è stato testato anche l’acrilato mPEGA-480 a base di PEG. Anche se la differenza tra mPEGA-480 e mPEGMA-500 è solo un gruppo metile all’estremità della catena, mPEGA-480 ha mostrato una citotossicità acuta (Fig. 3C). Più del 95% delle cellule hanno perso la vitalità anche con 1 mg mL-1 mPEGA-480 nel mezzo di coltura. Così, ulteriori esperimenti devono essere effettuati con concentrazioni inferiori per determinare la sua citotossicità (Fig. 3D), e i valori IC50 di mPEGA-480 sono stati calcolati come 0,2 mg mL-1 per le cellule HeLa e 0,1 mg mL-1 per le cellule L929 dopo 24 ore di cultura.
Gli esperimenti di vitalità cellulare hanno confermato che sia i gruppi terminali della catena che il peso molecolare sono importanti elementi di influenza per la citotossicità dei derivati del PEG, e i monomeri a base di PEG hanno mostrato una citotossicità molto più evidente rispetto agli oligomeri di PEG.
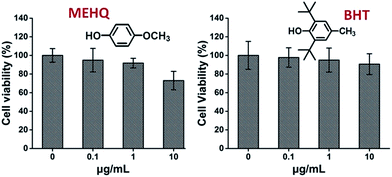
Nel frattempo, la citotossicità degli inibitori nei monomeri a base di PEG, idrochinone metil etere (MEHQ, 100 ppm in mPEGA) e butilidrossitoluene (BHT, 300 ppm in mPEGMA), sono stati valutati anche (Fig. 4), e le cellule L929 sono rimaste ad alta vitalità (≥90%) a inibitori a bassa concentrazione (≤ 1 μg mL-1). Ci sono 0,1 μg mL-1 di MEHQ in 1 mg mL-1 di mPEGA-480, e 3 μg mL-1 di BHT in 10 mg mL-1 di mPEGA-500, mentre mPEG-480 e mPEGMA-500 dimostrato citotossicità evidente a quelle concentrazioni. Quindi, le tracce di inibitori nei monomeri a base di PEG sembravano avere un’influenza trascurabile sulla citotossicità dei monomeri.
3.2 Osservazione della morfologia cellulare
L’osservazione al microscopio ottico è stata usata per valutare direttamente la citotossicità dei derivati PEG sulle cellule L929. Le immagini ottiche delle cellule L929 esposte a 20 mg mL-1 TEG e 0,1 mg mL-1 mPEGA per 24 ore sono state mostrate in Fig. 5A e B, rispettivamente.
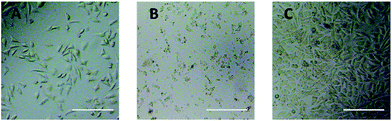
Dopo l’incubazione con 20 mg mL-1 TEG per 24 ore, le cellule hanno mantenuto la morfologia simile (Fig. 5A) con il gruppo di controllo (Fig. 5C, cellule in terreno di coltura puro), ma il numero di cellule è diminuito drasticamente, indicando la citotossicità del TEG ad alta concentrazione, che ha portato alla morte e seguito il distacco delle cellule dal fondo della micropiastra. La Fig. 5B ha mostrato la morfologia delle cellule L929 dopo l’incubazione con 0,1 mg mL-1 mPEGA-480. Quasi tutte le cellule hanno perso la morfologia normale, suggerendo la citotossicità acuta di mPEGA-480 anche ad una concentrazione così bassa.
Inoltre, le cellule sono state anche colorate con fluoresceina. La doppia colorazione FDA/PI è una procedura rapida, semplice e simultanea per osservare le cellule vive e morte.43 FDA può entrare nelle cellule complete e accumularsi nelle cellule, quindi, la membrana cellulare completa è necessaria per prevenire la fuoriuscita di fluoresceina dalla cellula. Al contrario, PI non può passare attraverso la membrana cellulare intatta, ma può macchiare il nucleo delle cellule morte passando attraverso la membrana cellulare danneggiata. Come mostrato nella Fig. 6, le cellule L929 incubate con 20 mg mL-1 TEG hanno meno cellule vitali dopo la colorazione FDA (Fig. 6b) rispetto al controllo (Fig. 6a), e più cellule morte possono essere osservate dopo la colorazione PI (Fig. 6b′), identico al risultato dell’osservazione attraverso una microscopia ottica. La citotossicità acuta di mPEGA-480 è stata osservata anche dopo la procedura di doppia colorazione FDA/PI, nessun segnale verde potrebbe essere identificato dopo aver incubato le cellule con 0,1 mg mL-1 mPEG-480 per 24 ore (Fig. 6c e c′′′).
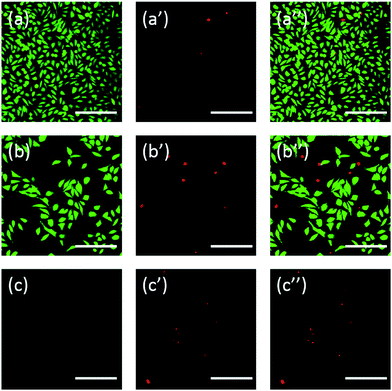
Entrambe le immagini ottiche e fluorescenti hanno dimostrato intuitivamente la citotossicità di questi derivati PEG, sostenendo ulteriormente la conclusione ottenuta attraverso i saggi CCK-8. Si è notato che il mPEGA-480 sembrava più tossico dal saggio di doppia colorazione FDA/PI, che è attribuito alla doppia colorazione FDA/PI distingue la completezza della membrana delle cellule vive/morte mentre il saggio CCK-8 rileva l’attività della deidrogenasi nei mitocondri, suggerendo la colorazione FDA/PI un eccellente supplemento del saggio CCK-8 per offrire maggiori dettagli sullo stato delle cellule.
3.3 Studio del meccanismo
Secondo gli esperimenti di vitalità cellulare, i valori IC50 degli oligomeri PEG e dei monomeri a base di PEG per le cellule HeLa e L929 dopo 24 ore di coltura sono stati calcolati e riassunti (Tabella 1), suggerendo che i monomeri a base di PEG sono molto più tossici per le cellule degli oligomeri PEG, e il mPEGA ha la più alta citotossicità. La generazione di ROS e il declino di GSH nelle cellule, due meccanismi principali di citotossicità sono stati quindi analizzati per sondare la possibile ragione della citotossicità.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| Cellule HeLa | 19.8 | 32.5 | 36.2 | 38.2 | 29.6 | 4.7 | 20.8 | 0.2 |
| L929 cellule | 12.4 | 24.7 | 22.5 | 28.7 | 20.0 | 5.3 | 21.7 | 0.1 |
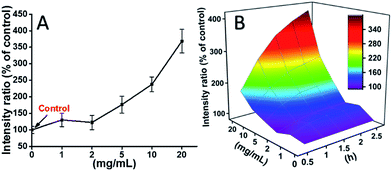
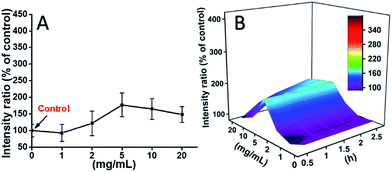
Le cellule L929 sono state incubate con TEG, e i livelli di ROS a diversi punti di tempo (0, 0.5, 1.0, 1.5, 2 h) sono stati rilevati secondo le nostre relazioni precedenti e mostrato nella Fig. 7. Come esempio, i livelli di ROS dopo l’incubazione con diverse concentrazioni di TEG per 2 ore sono stati mostrati in Fig. 7A. Si vede chiaramente che i livelli di ROS sono rimasti stabili con una bassa concentrazione di TEG (≤2 mg mL-1), ma significativamente aumentati quando la concentrazione di TEG è superiore a 2 mg mL-1, coerentemente con il risultato dell’esperimento di vitalità cellulare in Fig. 2B. Allo stesso modo, le figure del livello di ROS vs concentrazione TEG a diversi punti di tempo sono stati disegnati e uniti per ottenere una mappa 3D (Fig. 7B). I livelli massimi di ROS sono stati trovati a 2 h con 20 mg mL-1 TEG, è stato rilevato un livello di ROS aumentato di circa il 400% rispetto al controllo (livello ROS = 100), con conseguente intensità di fluorescenza più brillante. Questi risultati suggeriscono che la generazione di ROS è il possibile meccanismo della citotossicità del TEG, e l’alto livello di ROS indotto dal TEG potrebbe essere la ragione principale dell’apoptosi cellulare.
Sono stati testati anche i livelli di ROS indotti da mPEGA-480 dopo 2 h (Fig. 8A). Diverso dal TEG, mPEGA non ha causato il rapido aumento di ROS nelle cellule, solo ∼170% di aumento ROS rispetto al controllo è stato osservato come massimo. Il livello di ROS 3D vs. mPEGA & tempo (Fig. 8B) ha mostrato il livello di ROS indotto da mPEGA-480 come un’onda e la cresta è apparsa a concentrazione moderata di mPEGA (5 mg mL-1), nessuna generazione significativa di ROS può essere osservata, suggerendo che la generazione di ROS potrebbe solo parzialmente contribuire alla citotossicità di mPEGA-480.
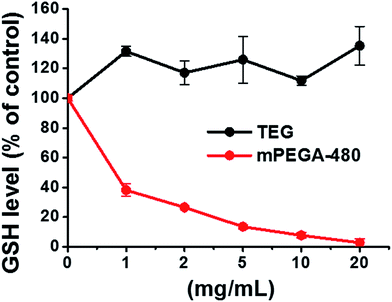
Il gruppo tiolo riducente nel GSH è un’importante fonte di antiossidazione negli organismi. Un possibile meccanismo per la citotossicità di mPEGA-480 è attribuito alla reazione di addizione di Michael tra il gruppo tiolo e il legame vinilico, portando alla rottura dell’equilibrio redox intracellulare e all’apoptosi cellulare. Ricerche precedenti hanno suggerito che l’addizione di Michael tra tiolo e acrilato è molto più veloce di quella tra tiolo e metacrilato,52 che potrebbe essere una causa ragionevole per la diversa citotossicità acuta tra mPEGA-480 e mPEGMA-500.
Conclusioni
La citotossicità degli oligomeri PEG e dei monomeri a base di PEG alle cellule HeLa e L929 è stata valutata per la prima volta. La citotossicità dipendente dalla concentrazione degli oligomeri PEG e dei monomeri a base di PEG è stata confermata e presentata come valori IC50 alle cellule HeLa e L929. PEG-400, PEG-2000 sembrano quasi non citotossici nella ricerca attuale. PEG-1000, PEG-4000 e mPEGMA-950 hanno mostrato una citotossicità moderata soprattutto ad alta concentrazione. TEG e mPEGMA-500 hanno mostrato una citotossicità significativa, e mPEGA-480 ha mostrato una citotossicità acuta. Inoltre, i tipi di cellule influenzano anche i risultati dello studio di citotossicità, le cellule HeLa sono più robuste delle cellule L929 nel tollerare i derivati del PEG. Questi risultati sulla citotossicità dei derivati del PEG sono preliminari ma fondamentali per la loro futura applicazione biomedica, ulteriori informazioni sulla risposta e il comportamento delle cellule ad altri derivati del PEG saranno ulteriormente studiati.
Riconoscimenti
Questa ricerca è stata sostenuta dalla National Science Foundation of China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein e G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan e J. L. Herrera, Am. J. Gastroenterol, 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper e M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang e D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun e H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris e R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese e G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley e J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill e W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner e W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann e A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li e Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao e Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng e Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad e S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan e D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li e Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao e Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo e H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka e H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya e C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander e P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang e K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao e K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh e E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu e W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter e C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter e C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice e S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki e M. Watanabe, Anal. Commun, 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei e X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li e Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang e J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller e C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode e S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown e A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta e S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han e W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel e H. D. Maynard, Chem. Commun, 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake e L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang e P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones e J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim e I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka e M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu e H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li e J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim e M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate e H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch e W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser e P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer e D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
