INTRODUCTION
近年行われた基礎および臨床研究では、慢性腎臓病と心血管疾患の直接的かつ2方向性の関係が確立されています1,2。 日常臨床では、腎機能の推定に血清クレアチニン濃度やCockcroft-Gault3式、MDRD(Modification of Diet in Renal Disease)4式による糸球体濾過量がよく用いられますが、このうちCockcroft-Gault3式とMDRD4式による糸球体濾過量の差は1.5~2.5倍と言われています。 しかし、血漿クレアチニン濃度は、患者の年齢、性別、筋肉量、身体活動、食事、投薬などの多くの要因によって影響を受けます5
シスタチンCは、すべての有核細胞で安定的に合成されているシステインプロテアーゼの阻害蛋白であります。 低分子で等電点が高いため、ほとんど糸球体濾過によって排泄される。 シスタチンC濃度は、年齢、性別、タンパク質の摂取量に影響されず、糸球体濾過のわずかな変化にも敏感に反応します。 最近、いくつかの研究で、冠動脈疾患患者におけるシスタチンC値の上昇と心血管合併症の発生との関連が報告されている。 この関係が、シスタチンCが血清クレアチニンよりも優れた腎機能マーカーであることによるのか、糸球体濾過とは別にこの蛋白の濃度に影響を与え、さらに心血管リスクに関係する因子があるのかは、現在のところ不明である10。
本研究の目的は、高リスクの急性冠症候群(ACS)で入院した患者における血漿シスタチンC濃度の予後を評価し、シスタチンCと他の腎機能および炎症のマーカーとの関係を調べることであった。
高リスクACSの診断基準には、虚血特性を伴う痛み、虚血と一致する心電図変化、および/または心筋壊死マーカーの上昇のうち少なくとも2つが含まれていた。 入院中に行われた治療や追加検査は、主治医の臨床的判断に基づいて行われた。 ほとんどの患者で、入院後24時間から72時間の間に緊急冠動脈造影(ST上昇または左脚ブロックのある心筋梗塞の場合)または早期予定冠動脈造影を含む侵襲的戦略が使用された。
臨床的特徴
患者の臨床記録から以下のデータを記録した:人口統計学的情報,古典的な心血管危険因子(糖尿病,全身性高血圧,脂質異常症,喫煙)の存在,既知の血管疾患(虚血性心疾患,脳血管疾患,末梢動脈疾患,心筋血行再建治療歴)の既往歴。 その他の臨床的変数としては、ACSのタイプ、入院時のKillipクラス、収縮期および拡張期の血圧値、脈圧(収縮期と拡張期の動脈圧の差として推定)、心拍数が分析された。
すべての患者が心エコー検査を受け、左室駆出率は4室アプローチを用いたシンプソン法で推定された。洞調律の患者では3回の測定の平均値が、心房細動の患者では5回の測定の平均値が算出された。
95%の患者で冠動脈造影が行われ,冠動脈病変の重症度は,影響を受けた心外膜冠動脈の数に基づくスコアで評価された。
分析データ
ベースラインのヘモグロビン,ヘマトクリット,白血球,グルコース,クレアチニン値は,入院時に当センターで行われた最初の検査分析で記録された。 総コレステロール,高密度リポ蛋白コレステロール(HDL-C),低密度リポ蛋白コレステロール(LDL-C),グルコース,高感度CRP,シスタチンCの濃度は,トロポニンI(TpI)ピーク値とともに最初の24時間に記録された。
シスタチンCはDade-Behring BN ProSpecネフェロメーターを用いた自動均質免疫測定法で測定された。 分析試薬はタンパク質に対する抗体を塗布したポリスチレン粒子で、シスタチンCを含む試料と混合すると凝集し、分析対象物の濃度に比例した強度で光を散乱させるものであった。
使用するネフェロメトリック法による成人の血清シスタチンC濃度の基準範囲は0.51~0.95mg/Lである。 高感度C反応性蛋白の濃度もイムノアッセイで測定された。 糸球体濾過量は、MDRD式を用いて推定した。
解析したエピソード
解析した心血管合併症は,院内死亡,追跡中の全死亡,心電図変化を伴う胸痛または同等の狭心症,入院後24時間の腫瘍壊死マーカーの上昇(冠動脈インターベンション治療後にマーカーが上昇した患者は除外)と定義した新規心筋梗塞の発症,入院または追跡中の心不全発症とした。
臨床的フォローアップ
平均フォローアップ期間は186(SD,110;中央値,156)日であり,この間に患者のすべての臨床的イベントが記録された。 フォローアップは,電話連絡,外来診療,入院中の医療記録の確認により行われた。 統計解析
すべての情報は,Microsoft Office Access 2003 SP2で作成されたデータベースに前向きに記録された。 統計解析はSPSS(Statistical Package for the Social Sciences)、バージョン12.0を用いて行われた。 カテゴリー変数または二項変数は絶対値およびパーセンテージで表し,ピアソンχ2検定で比較した。 正規分布を持つ連続変数は平均値(SD)で表記し、群間比較にはStudent t検定を用いた。 ガウス分布を示さない変数は、Mann-Whitney U検定で比較した。
シスタチンC濃度と高感度C反応性蛋白および糸球体濾過量の相関を評価するために、スピアマンの相関係数を使用した。 ロジスティック回帰分析により,単変量解析における有意な変数を含め,入院中の心血管合併症の発症を予測するための,シスタチンCに関する臨床・検査因子の独立した役割を評価した。 調整オッズ比と95%信頼区間(CI)が示された。 追跡期間中のKaplan-Meier生存曲線を作成し、long-rank検定を用いて比較した。
研究対象集団の記述的分析を行うため、いくつかの量的変数を区間に分類した:糸球体濾過量(>90、90-60、55%、0.95、
P値が.05未満を統計的に有意と見なした。
RESULTS
2006年5月から2007年7月までに,ハイリスクACSと診断され入院した203名の患者を対象とした。 平均年齢は66.6歳(13.16歳)であった。 そのうち,非ST上昇型ACSが62.1%(n=126),ST上昇型ACSが37.9%(n=77)であった。 研究対象者のベースライン特性は表1の通りである。
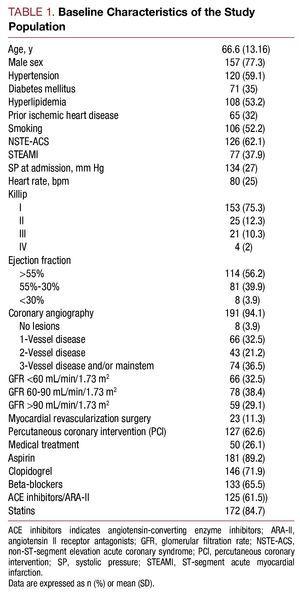
シスタチンC濃度の中央値は1.01(範囲、0.83-1.35)mg/L、最初に実施した分析での血漿クレアチニンは1(0.9-1.3)mg/L,糸球体濾過量は72.4(49.12-93.73)mL/min/1.73m2,高感度C反応性蛋白は1.37(0.46-5.02)mg/Lであった。 入院時の糸球体濾過量は32.5%の患者で2、血清シスタチンCは113人(55.7%)で<5239>0.95mg/Lであった。
シスタチンC値が高い患者は,より悪い臨床プロファイルを示し,高齢で,高血圧の有病率が高く,入院時のKillipクラスが悪く,冠動脈造影でより重度の冠動脈疾患があり,血漿クレアチニン値およびC反応蛋白値が高かった(表2)。
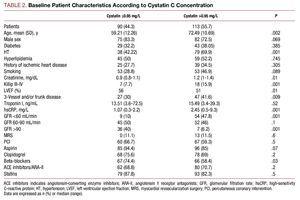
実施した冠動脈インターベンションに関して,シスタチンC2群間に有意差はなく,最終的に得られた血管造影結果も同様の成功率で有意合併症もなかった(シスタチンC ≦0.95 患者で 3.27%, その他の群で 4.09%)…. 薬物療法の解析では,cystatin C≦0.95の群でβ遮断薬とaspirinの使用量が大幅に増加した(表2)。
血清シスタチンC値は,微量アルブミン尿(r=0.302,P=.01)よりも推定糸球体濾過量(r=0.655,P=.001)(図1)と高い相関を示し,C反応性タンパク質(r=0.29,P=.01)とは低い相関であった。
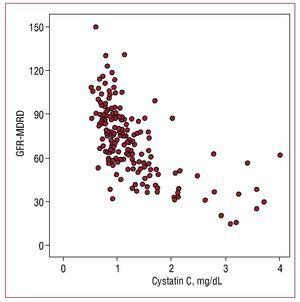
図1. シスタチンC値とMDRD式(GFR-MDRD)で推定した糸球体濾過量の相関<7887><7367>シスタチンC値<5239>0.95の患者群では、6.5%が正常糸球体濾過量、46%が60〜90mL/min/1.73m2までの糸球体濾過量とした。 また、濾過量2の腎機能障害患者の10%がシスタチンC値
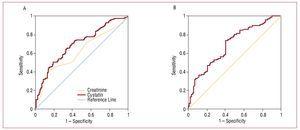
図2.シスタチンC値
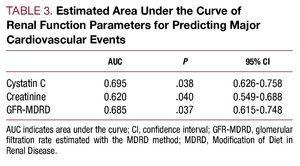
の場合 A、心血管合併症(心不全、梗塞、心血管死)の発症に関連するシスタチンCとクレアチニンのROC。 B、MDRDで推定した糸球体濾過量の心血管合併症(心不全、梗塞、心血管死)発症との関係におけるROC曲線
入院期間は中央値9(6-19)日間。 入院から研究追跡終了までに,全体から56名(27.58%)が心不全を発症し,そのほとんどがシスタチンC値高値群(45名)であった。 院内死亡率はシスタチンC値上昇群で有意に高く(17.6% vs 3.3%、P=.001)、これらの差は追跡調査中も継続した(図3、表4)。
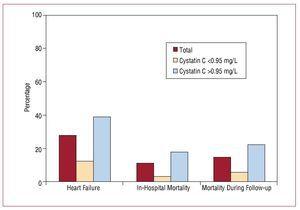
図3. シスタチンC 0.95mg/Lと院内心血管系イベント発症の関連性。

単変量解析では,心血管合併症とACSのタイプ,高脂血症,TpIピーク濃度の間に関連は認められなかったが,残りの心血管危険因子である患部血管数,駆出率,腎機能マーカー,シスタチンC,高感度CRPと関連がみられた. 糸球体濾過量<5239>60 mL/min/1.73 m2の患者の結果を分析したところ、シスタチンC<5239>0.73 m2の患者を発見した。95mg/Lの患者は、糸球体濾過量<5239>60、シスタチンC 60およびシスタチンC <7887><1284><1284><7730><8472><8472><7367> 平均186日間のフォローアップ後の推定無イベント生存率(すなわち心不全、心筋梗塞、死亡がなかったこと)が、シスタチン値≦0.の患者グループで顕著に高くなったことが示された。95 mg/L:75%対44%(P=.02)であった(図4)。

図4. シスタチンC値による、主要な心血管イベントから解放される生存確率を推定するカプランマイヤー曲線。
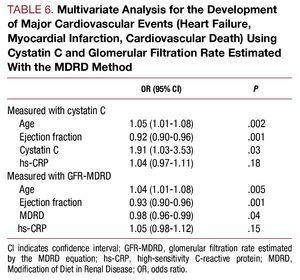
多変量解析では、年齢、駆出率、シスタチンC濃度が入院中の心血管合併症の独立予測因子として同定された(表6)。
DISCUSSION
本研究の結果から,高リスクのACS患者ではシスタチンC値の上昇が,他の古典的危険因子とは無関係に院内心不全,心筋梗塞および心血管死の発生を予測することが示唆された。 さらに、血漿シスタチンC値は、他の腎機能評価方法よりも、入院中の心血管系合併症のリスクが高い患者を層別化する能力が高い可能性がある。 我々は、糸球体濾過量が正常な患者群においても、シスタチンCの上昇は心血管系の予後不良と関連することを見いだした。 我々の知る限り、これはこの関連を示した最初の報告であり、この患者集団のリスク層別化に影響を与える可能性があると考える。
近年、急性および慢性虚血性心疾患患者、ならびに心血管系疾患の他の臨床症状、特に心不全患者の追跡調査において、腎機能障害と心血管合併症との密接な関連性がいくつかの論文で報告されています1、10-12。糸球体ろ過が60mL/分未満に低下すると、心血管疾患の既往があるかないかにかかわらず死亡、心筋梗塞、脳卒中のリスクが著しく増加することが報告されています13。 特に、この関係はST上昇を伴うACS患者と伴わない患者で報告されています。VALIANT試験16(ST上昇型心筋梗塞後の心室機能障害および心不全患者)において、腎機能の悪化(糸球体濾過量で評価)は、追跡中の死亡率および心血管合併症の増加との関連が認められます。 同様の結果は、SAVE試験(心筋梗塞後の心室機能障害)、HOPE試験(心血管リスクの高い患者、大多数は慢性虚血性心疾患)、PEACE試験(慢性虚血性心疾患患者)の対象患者群でも報告されています。 これらの研究では,腎機能障害と予後の関係は,尿中アルブミン排泄量だけでなく糸球体濾過量の低下についても観察された16-19。
前述のように,腎機能障害と心血管疾患には直接的な2方向性の関係があるとされている。 慢性腎不全は高血圧や脂質異常症の発症を促し、レニン-アンジオテンシンナルドステロン系の活性化を促進する。 これらの因子は、炎症性メディエーターの増加とともに、動脈硬化の進行や心血管系の傷害に関与するフリーラジカルの産生を増加させる一因となるようである。 さらに、ミネラル代謝の変化(石灰化の促進因子の増加と抑制因子の減少)は、冠動脈へのカルシウム沈着を促進する。20,21 最後に、腎機能障害を持つ患者では、臨床的および予後的に有益と認められる治療介入をあまり行わないことが記述されている。 特に、ACS患者では、積極的な治療が行われず、冠動脈インターベンションの実施に時間がかかり、IIb/IIIa、レニン・アンジオテンシン-アルドステロン軸の遮断薬、βブロッカー、スタチン、抗血小板薬の使用が少ないため、この患者集団で報告されている予後が悪くなる原因になっている可能性があります22。
日常診療における腎機能の評価は、通常、血清クレアチニン測定とCockcroft-Gault式またはMDRD式による糸球体濾過量の推定に基づいて行われる。 これらの方法はいずれもいくつかの制約があり、その多くは年齢、女性の性別、人種的特徴、食事、慢性疾患の経過など、クレアチニン産生に影響を及ぼす要因に由来する。
最近、心不全患者においてこれらの式が評価され、予後判定マーカーであるNT-proBNPと比較された。 7887>
シスタチンCは分子的、代謝的な特徴から、血漿中の濃度は腎機能推定に適した生体マーカーであり、小さな機能変化は従来のパラメーターより高い感度で検出される24。 このことは、血清シスタチンC濃度が正常上限を超えた患者群のうち、15%が糸球体濾過量が正常であったという事実を正当化しうる。スタチンCの測定は、腎疾患の前臨床状態にある患者の同定に有用であると考えられる6。
本研究で得られた結果は、シスタチンCが冠動脈疾患患者の心血管合併症の独立した予測因子であることを示す報告結果25-27とある程度一致する。さらに、我々のデータはこの概念を正常糸球体濾過量の患者にも広げることができる。 Jernbergら26は、ST上昇型でないACSで入院した患者群における血漿シスタチンC値と予後の関係を解析し、シスタチンC値と死亡率の間に有意な関連があることを報告した。 また、外来通院中の慢性冠疾患患者では、シスタチンC濃度の上昇が死亡、心血管合併症、心不全の発生リスクの上昇と関連することが報告されている24。顕性腎疾患のない高齢者では、シスタチンCは死亡、心血管疾患、慢性腎疾患のリスクマーカーとなる6。 これは、このタンパク質の動態によって説明できると考えられる。このタンパク質の動態は、サンプルの採取時点に依存する特異的で特徴的なスペクトルを持つ(ピークは症状発現後49時間に起こり、ST上昇型急性心筋梗塞ではより遅いピークが見られる)。 本研究で対象とした患者さんが罹患した心血管系合併症は、最近のレジストリで発表されたものと異なっています29。これは、非常にリスクが高く、合併症の発生率が高い患者さんが含まれているためと思われます。 最近発表されたMASCARAレジストリでは、ICUまたは心臓ICUに最初に入院した患者は全体の50%に過ぎなかったが、本研究ではすべての患者が心臓ICUの出身であり、この事実は間違いなく何らかの選択バイアスを意味するものである。 しかしながら、シスタチンCが高値を示した患者群は、残りの患者群よりも有意に高いリスクプロファイルと心血管合併症を有する集団であった。 本研究は、高リスクのACSの入院後数時間におけるシスタチンC値の上昇が、院内心血管系合併症の独立した予測因子であることを初めて報告し、これらの関連性をより正確に立証することに貢献するものである。 さらに、シスタチンCと心血管合併症のリスクとの関連は、腎機能を推定するために広く用いられている他のパラメータよりも高く、糸球体ろ過が正常の患者群においても維持されている。 シスタチンCが他の一般的なパラメータ(血清クレアチニンや糸球体濾過量)よりも腎機能の優れたマーカーであることが、合併症リスクの高さを予測することにつながるのか、糸球体濾過とは別にシスタチンC濃度に影響を与え、心血管リスクに直接関連しうる他の因子があるのかは、現在のところ正確には分かっていない。 PRIME研究(Prospective Epidemiological Study of Myocardial Infarction)では、冠動脈疾患のない患者を対象に、シスタチンCと急性心筋梗塞心筋死および狭心症の発症との関連を検討した。 一般的な心血管危険因子で調整した後、血漿シスタチンC値は虚血性起源の最初の冠動脈合併症の発症と有意に関連していた。 著者らの意見では、糸球体濾過量の減少は、症例が対照群に対して示した高いシスタチンC値を正当化せず、炎症がシスタチンCと心血管疾患のリスクとの関係の起源である可能性が提案された31,32。 これらのデータと同様に、今回の結果は、シスタチンCと心血管合併症の独立した予測因子でもある高感度CRPとの間に正の相関(r=0.2)を示し、腎疾患、炎症、および心血管疾患の間の直接的関係の存在を正当化するさらなる証拠を提供するものです。
今回発表された研究の主な限界として、この結果は心臓ICUに入院した高リスクのACS患者のみを対象としており、大多数は早期の冠動脈造影で積極的に治療されていることを指摘する必要があります。 一方、入院時にシスタチンCが測定されたこの特定の集団に関する情報はほとんどないため、これらの特徴を強調する必要がある。 ほとんどすべての発表された研究において、測定の時点が示されておらず、少なくともACS患者では、血漿シスタチンC濃度は、イベントからの時間の長さ、行われた診断および治療的介入によって影響を受ける可能性がある。 追跡期間が短いという制約があるため、我々の観察を中・長期に拡張することはできない。 しかし、今回の知見は、高リスクのACSで入院した患者のリスク層別化を改善する可能性を提供し、診断の確定だけでなく治療法の決定にも有用であろう。
ABBREVIATIONS
ACS:急性冠症候群
MDRD:Modification of Diet in Renal Disease
TpI:トロポニンI
