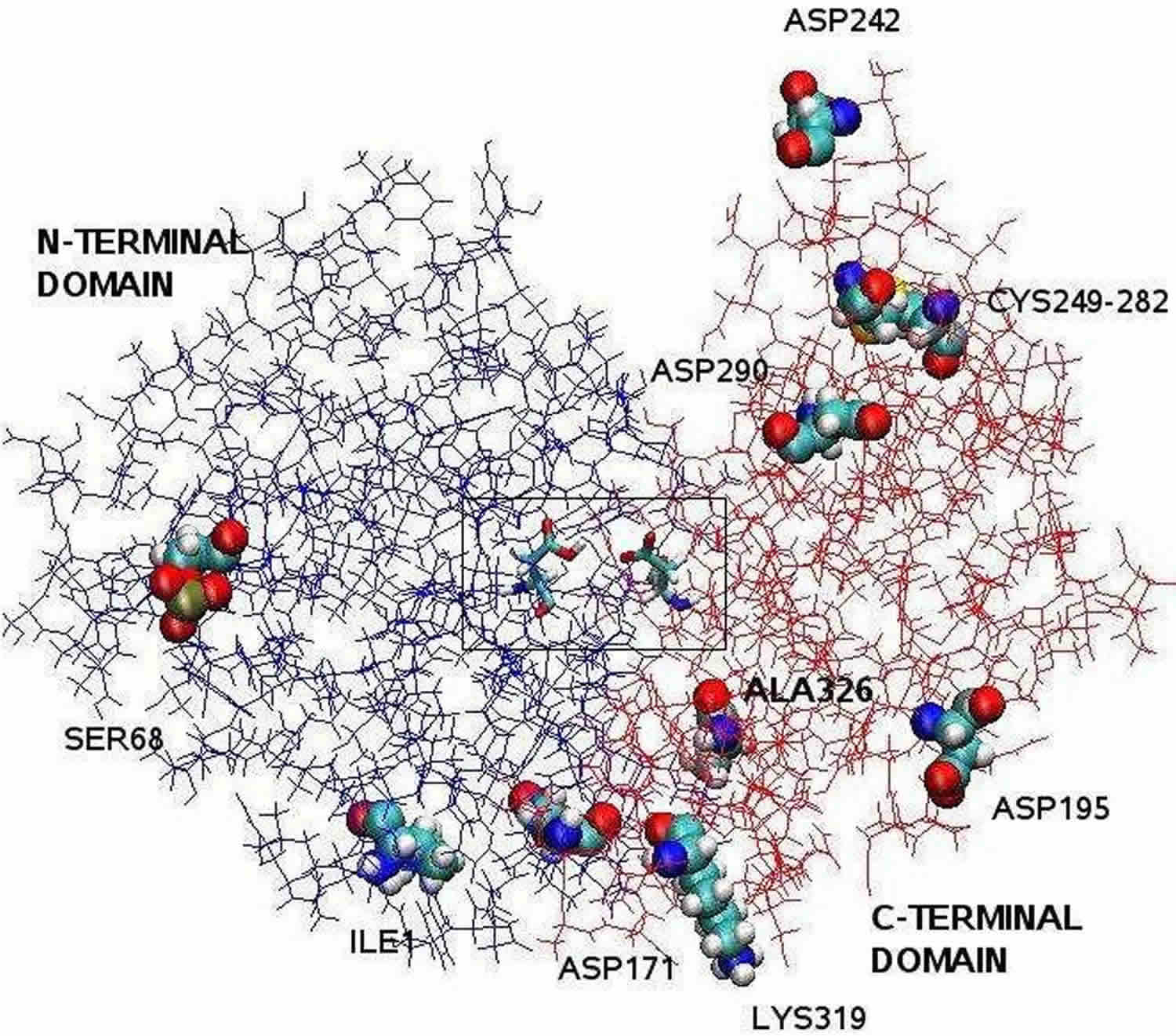
 脚注:X線結晶構造解析で明らかになったペプシン構造は、2つのローブの間に大きな活性部位の裂け目を持つ2葉型であった。 1から175残基がN-末端ドメイン、176から326残基がC-末端ドメインを形成している。 クレフト中央の2つのアスパラギン酸、Asp32とAsp215は触媒残基として機能する。 Asp32とAsp215からなる触媒部位は、クレフトの中央に位置している。 タンパク質表面にある荷電アミノ酸残基は、Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal one), Ala326 (C-terminal one)であり、Asp32とAsp215は触媒残基として機能している。 リン酸化されたSer68は溶媒に完全に露出し、Cys249とCys282の間のジスルフィド結合はタンパク質表面に位置している。
脚注:X線結晶構造解析で明らかになったペプシン構造は、2つのローブの間に大きな活性部位の裂け目を持つ2葉型であった。 1から175残基がN-末端ドメイン、176から326残基がC-末端ドメインを形成している。 クレフト中央の2つのアスパラギン酸、Asp32とAsp215は触媒残基として機能する。 Asp32とAsp215からなる触媒部位は、クレフトの中央に位置している。 タンパク質表面にある荷電アミノ酸残基は、Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal one), Ala326 (C-terminal one)であり、Asp32とAsp215は触媒残基として機能している。 リン酸化されたSer68は溶媒に完全に露出し、Cys249とCys282の間のジスルフィド結合はタンパク質表面に位置している。
ペプシンはアスパラギン酸プロテアーゼとして、至適pHが非常に低い。 Kondjoyan, Daudin, and Santé-Lhoutellier 9)は筋原繊維タンパク質の消化率について研究し、pH2付近でペプシン活性が最大になることを見いだした。 Pletschke, Naudé, and Oelofsen 10)は、ブタとダチョウのペプシンによるヘモグロビンの加水分解を研究し、ペプシン活性の最適なpHを2.0であることも見いだした。 ペプシン酵素はpH <4.5 で活性化されると、pH 7.0 以上で容易に変性し、ペプシンの特性を決定する性質を構成する11)。
pHの影響と対照的に、イオン強度が酵素活性に及ぼす影響はあまり議論されていない。 DaleとWhiteによる以前の研究12)では、イオン強度を上げると固定化膵臓リボヌクレアーゼの反応速度が明らかに低下することが示され、Butré、Wierenga、Gruppen 13)ではアルカラーゼとニュートラースによる乳清タンパク質分離物の酵素的加水分解を研究し、また、0.5M NaClは加水分解速度を低下させた。
ペプシンの強力な天然由来の阻害剤としては、Streptomyces由来のペンタペプチドであるペプタチンとAscaris由来の独特のタンパク質性阻害剤の2つが知られている。 ペプシンはフィードバック阻害も受ける。蛋白消化の産物がペプシンを阻害して反応を遅くする14)。
ペプシンはどこで作られるか
チーフ細胞はペプシノーゲンという不活性酵素前駆体の形で、ペプシンを分泌している。 ペプシノーゲンが頭頂細胞からの塩酸と接触すると、急速に分解され、ペプシンが生成されます15)。 ペプシンは、ほとんどすべての種類の食物タンパク質のポリペプチドへの消化を開始する。 この酵素は、胃液中の塩酸が供給する酸性の環境下で最も活性化される。 胃の細胞(胃腺)
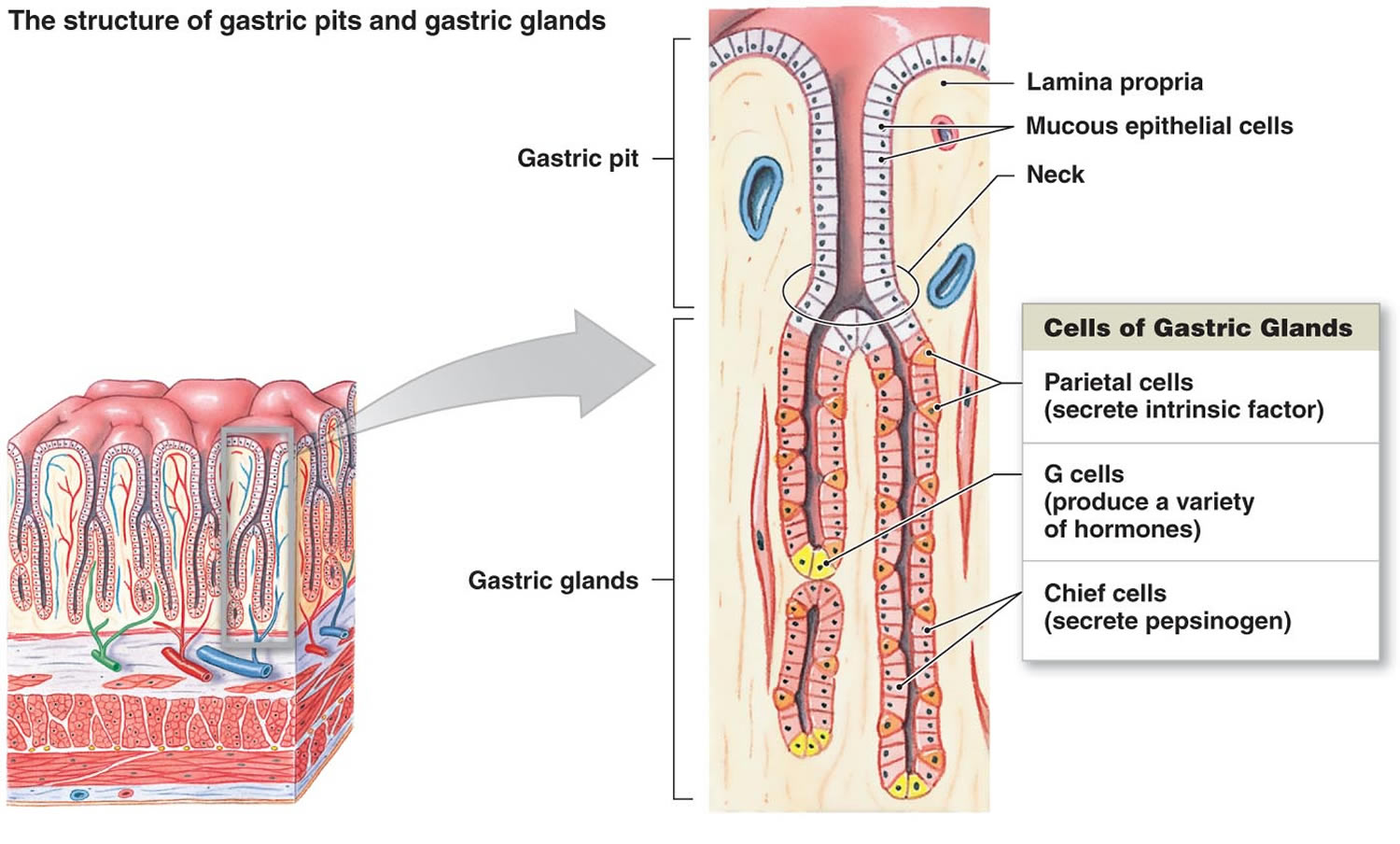 Footnote: Lining of the stomach. 胃腺には、粘液細胞、壁細胞、主任細胞などがある。 胃の粘膜には、胃腺の開口部である胃孔が点在しています。
Footnote: Lining of the stomach. 胃腺には、粘液細胞、壁細胞、主任細胞などがある。 胃の粘膜には、胃腺の開口部である胃孔が点在しています。
ペプシンの働き
ペプシノゲン(ペプシンの不活性型)から塩酸存在下で生成したペプシンは、ほとんどすべての種類の食物タンパク質をポリペプチド(小さなタンパク質成分)に消化する働きがあります。 ペプシンは、強い胃酸の中でタンパク質を消化します。 ペプシンは、胃の酸性環境での食物消化に最適化されており、食物タンパク質が消化管内で最初に遭遇するプロテアーゼです。 ペプシンは37℃から42℃の酸性環境で最も活性が高い16)。
ペプシンの特異性(ペプシンによるペプチド結合の切断確率)は主にP1位とP1′位のアミノ酸残基によって影響を受けるが、他のサブサイトのアミノ酸残基も役割を果たす場合がある。 一般にペプシンはフェニルアラニン、ロイシン、メチオニンでの切断を好み、ヒスチジン、リジン、プロリン、アルギニンでの切断はほとんどない17)。 芳香族残基であるチロシン、トリプトファン、フェニルアラニンはP1′の位置が好まれる。 プロリンはP2、P2′、P3′の位置で強く嫌われ、ヒスチジン、リジン、アルギニンはP3位で嫌われる。 P4とP4′位はほとんど影響しない18)。
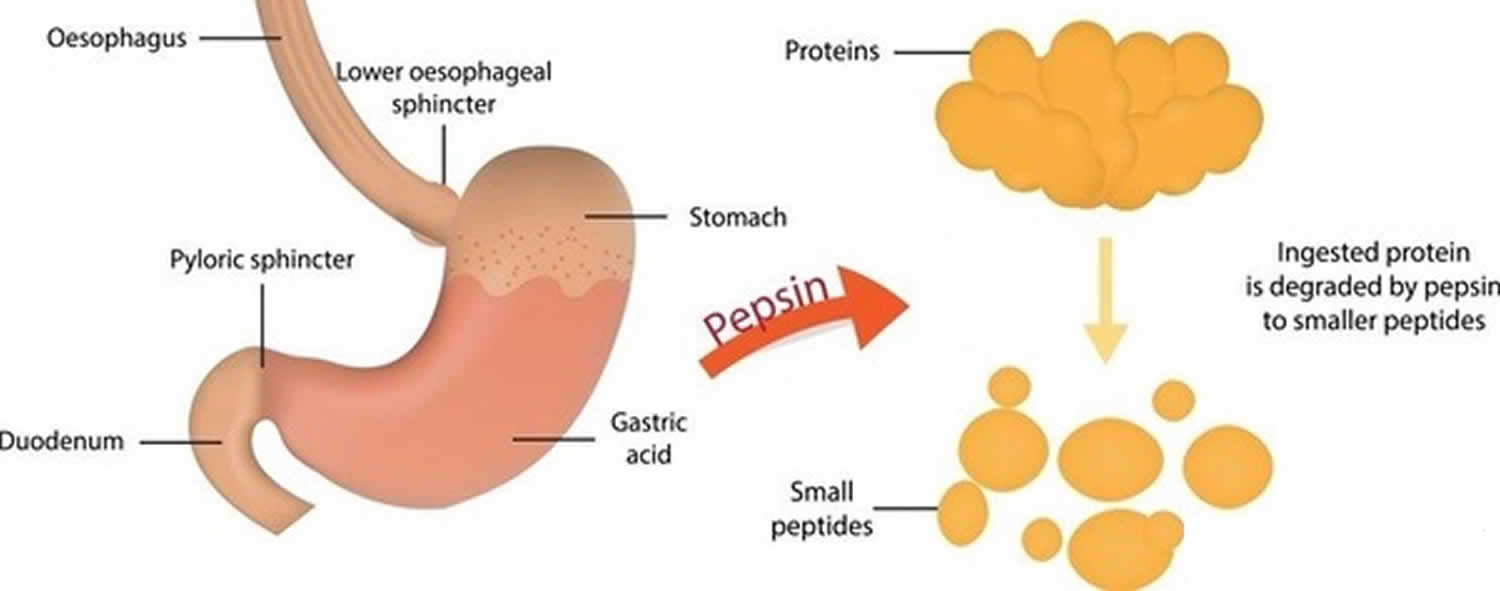
図3. ペプシンの機能