はじめに
大腸憩室疾患は欧米では大腸を冒す最も一般的な疾患である。 喫煙、過体重、運動不足、低繊維食などのライフスタイルの変化により、過去100年の間に世界中で憩室疾患の有病率は増加している。 有病率は年齢とともに増加し、40歳未満の成人では約5%、80歳以上では50~70%であり、憩室炎を呈する患者の80%は50歳以上である。 憩室は単発から数百個まで存在し、通常直径5-10mmですが、2cmを超えることもあります。 憩室症は主にS状結腸と下行結腸に発生し、90%以上の患者に見られるが、程度の差こそあれ、他の結腸にも散見される1
このレビューでは、いくつかの憩室関連の用語が使用されることになる。 明らかな炎症を伴わない大腸の憩室の存在は、憩室症または合併症のない憩室病(UDD)と呼ばれる。 有症状と無症状の場合がある。 憩室に炎症が生じ、合併症(合併症性ACD)に移行する場合としない場合があり、「急性大腸憩室炎」(ACD)と呼ばれます。 また、憩室炎を繰り返すため、あるいは憩室に関連する分節性大腸炎を発症するため、慢性憩室炎もあります。
憩室疾患の自然史に関する研究では、憩室患者の大部分(約80%)は生涯を通じて無症状であることが指摘されている。 症状を発症する15-20%のうち、約1/4は最終的に炎症を伴わない有痛性憩室疾患のエピソードを有し、最大で10-25%がACDのエピソードを有することになる。 約1-2%は入院を必要とし、0.5%は手術が必要となります。 大腸憩室は粘膜と粘膜下層のヘルニアであり、直腸絨毛が筋層を貫通する弱点に相当する。 憩室疾患の発症機序は未だ十分に解明されていないが、食事、大腸内細菌叢、遺伝的要因、大腸運動、構造などの複雑な相互作用により、経時的に大腸憩室を形成するものと一般には認識されている5。 1971年、PainterとBurkittは、憩室病は食物繊維の摂取不足に基づく分節化による大腸の過剰な圧力によって引き起こされるという有名な仮説を発表した。 その後、食物繊維の憩室病予防効果について、多くの観察研究が行われてきた。 8-10 これらの証拠に基づき、現在のほとんどのガイドラインやポジションペーパーでは、憩室疾患の予防のために高繊維食が推奨されています。しかし、(1) 最近のいくつかの疫学研究において、繊維摂取と憩室症の逆相関が疑問視されていること16、17、(2) 神経障害仮説や筋萎縮仮説などの新しい病原仮説が登場していること18、などこの仮説には最近反論が出ています。-22 その他、運動不足、便秘、肥満、喫煙などが憩室疾患のリスク上昇に関連するとされている23。-27
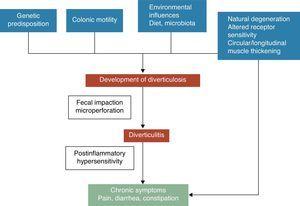
憩室疾患における症状発現は、おそらく遺伝的特徴、結腸構造、腸管運動低悪性度炎症、炎症後過敏症の複雑な相互作用に関連している。
合併症のない憩室疾患(UDD)と症状の関連性は不明である。 有痛性憩室疾患は、炎症と結腸の神経筋機能への影響に関連した疾患であることを示唆するいくつかの証拠がある22-28。慢性的で低レベルの腸の炎症が存在すると、感覚-運動機能障害を引き起こし、症状の発現や持続につながると考えられる。 腸内細菌叢の変化は、低悪性度炎症の原因となる推定メカニズムの1つであると考えられます。 憩室内の糞便貯留による細菌の過剰増殖は、慢性的な低悪性度炎症を引き起こし、内在性一次求心性ニューロンと外在性一次求心性ニューロンの両方を感作する可能性がある。 図1参照)
前述したように、大腸憩室症患者の多くは無症状であるが、最終的にはACDや憩室出血などの合併症を発症する可能性がある。 今回はACDに焦点を当てます。 この事象の臨床症状は、穿孔の大きさ、大腸外の汚染の程度、この汚染を封じ込める身体の能力など、多くの要因によって決まる。29,30
憩室疾患の管理合併症のない憩室疾患の管理
無症状のUDD患者2においては、高繊維食は症候性UDDと合併症を予防する効果が期待できるので勧められることがある。 これらの患者において、他の薬剤が有用であるという証拠はない。
症候性UDDにおける治療の有益性については、より多くの証拠が存在する。 最も頻度の高い症状は腹痛であり、食事により悪化し、排便または鼓腸の通過により緩和することがある。 その他の症状としては、吐き気、下痢、便秘、腹部膨満感などがあります。 31
治療薬としては、5つの薬剤が提案されている(図2参照):

合併症のない憩室性疾患の治療。 Mechanisms of Action.
A) High fiber diet or bulking agents
いくつかの無作為比較試験(RCT)やその他の介入研究で、症状のあるUDDにおけるファイバーの効果について評価しているが、一貫性のない結果となっている32。-37 いずれにしても、食物繊維は、現在のほとんどのガイドラインやポジションペーパーで、症候性UDDの予防と治療、およびACDの予防に推奨されています11-15
B) 抗生物質治療
症候性UDDに抗生物質を使用する根拠は、明確に確立されていません。 最近の研究では、腸内細菌叢の変化(腸内細菌の過剰増殖)が、炭水化物の発酵による腸内ガスの過剰生成による症状の発現に寄与している可能性が示唆されている。 系統的な影響を避けるためには、腸内病原体に作用し、系統的な毒性や副作用のリスクが少ない吸収の悪い抗菌薬が最も適していると思われる。 Rifaximin
は非系統的なリファマイシンアナログで、in vitroで広いスペクトルの活性を持つ。 リファキシミンは腸内細菌叢の代謝活性を低下させ、糞便量を増加させ、また細菌の過繁殖を根絶させる可能性がある。 この抗生物質は、高い安全性と高い忍容性プロファイルを有する。33,38 リファキシミンの血漿レベルは最小であるため、腸管以外の病原体は選択圧にさらされず、耐性菌のリスクは低い。39 3つのオープンおよび2つのダブルブラインドRCT40-44では、繊維単独と比較してリファキシミンと繊維の循環投与が症状を軽減する有効性が検討されている。 システマティックレビューと2つのメタアナリシスにより、これらの試験が分析されている。44-46は、UDD患者の1年後の症状緩和には、併用療法が有効であると結論付けている。 ファイバー単独で治療した患者の35%が無症状であったのに対し、併用治療群では64%が無症状であった。 治療必要数は、症状緩和のためにリファキシミン対プラセボで3人、合併症回避のために9人であった。 以上のことから、グルコマンナンのような水溶性食物繊維とリファキシミンを1ヶ月に1週間ずつ併用することで最良の結果が得られている。) プロバイオティクス
プロバイオティクスは生きた微生物で、憩室疾患で停滞や大腸通過時間の減少により変化した腸内常在菌叢を回復させることができる。 48-50
プロバイオティクスは、5-アミノサリチル酸(5-ASA)との併用も研究されている。 Tursiらは、5-ASA単独、プロバイオティクス単独、併用療法を比較した3つのRCTを実施した。51-53 症候性UDDの予防には、5-ASAとプロバイオティクスはともに有効であると思われたが、併用療法の方が優れていた。 この同じ科学グループによって発表された最近のダブルバインドRCTでは、環状メサラジンとLactobacillus casei subsp DGの両方、特に併用は、症候性UDDの寛解維持にプラセボよりも優れているようだと結論付けている54。しかし、まとめると、研究デザインが悪いこととサイズが小さいことから、明確な結論は得られない。
D) 5-ASA: mesalazine
Mesalazine には抗炎症および抗酸化作用があるとされてる。 2010年、Gattaら55名は、憩室疾患患者における5-ASAの役割を評価したCochraneシステマティックレビューを発表した。 著者らは、5-ASAはこの疾患の治療に有効であり、再発防止には周期的投与よりも日常的なメサラジンの投与が適していると結論づけた。 彼らの見解を確認するためには、質の高い、デザインされたRCTが必要である。 また、症状の再発を防ぐという点で、リファキシミンと比較してメサラジンが有効であることを示した興味深いRCTが2つあり、プロバイオティクスであるLactobacillus caseiと比較して、長期寛解維持に同様の効果があることを示した53,57。
E)抗コリン剤/鎮痙剤
憩室症における大腸の腰痛は、ジシクロミンやヒオスシアミンなどの鎮痙剤が筋収縮を抑制し症状を改善する可能性が示唆された。 しかし,この効果を確認したRCTはない。
F) NSAIDs治療の回避
いくつかのコントロール研究で,NSAIDsは症状,ACD,穿孔,出血の発症の危険因子であることが示されている7,58-60 NSAID使用者は非使用者に比べて症状のある憩室疾患の発症リスクが高い(RR: 1.5, CI 95% 1.1-2.1)58 また複雑性の憩室疾患患者では疾患のないコントロールに比べてNSAIDs使用が多いことが報告されている。 このようなリスクの増加は、大腸粘膜のバリア機能が損なわれ、炎症を引き起こす細菌の移動を可能にする粘膜損傷によるものと推測された。
G) ビタミンDのレベル
ACDの発生率は、地理的、季節的変動と関連していると思われる。 そのため、Maguireらは2つの興味深い観察研究を行い、ビタミンDレベルの低さと紫外線照射量の少なさ(紫外線照射量はビタミンDの状態を決定する)が、ACDの有意に高いリスクと関連していることを明らかにした。 61,62
急性大腸憩室炎(ACD)の治療
憩室症患者のほとんどは無症状であるが、約10-25%が左ACDを発症すると推定される63。一般的に、臨床診断は十分に正確ではなく、放射線技術が適用される。 64,65 画像診断が必要な場合は、超音波検査を第一選択とし、超音波検査で結論が出ない場合や疑わしい場合はコンピュータ断層撮影(CT)を行うという条件付き戦略が最も効果的であると思われる。 CT検査の回数を50%減らすことができる。 1978年、HincheyらはACDの分類を提案し、後に修正された。66,67 ACDは、0期:臨床的に軽度の憩室炎、I期(a:腹膜炎、b:原発巣に近接した777cm未満の瘍)、II期:腹腔内、骨盤、後腹膜の瘍、原発巣から遠い瘍、III期:全身性化膿性腹膜炎、 IV期:糞便性腹膜炎の5段階で区別されている。 図3参照

合併症のないACD(Hinchey stage 0またはIa)の治療
合併症のないACDの大部分は、70%から100%の成功率で安全に保存的治療が可能である14。 14 外来での治療により、医療システムのコストを大幅に削減できる。合併症のないACDの場合、入院治療の基準は、著しい炎症(発熱や腹膜炎の存在を含む)、経口液への不耐性、80~85歳以上の高齢、免疫抑制、重度の併存疾患などである。 ほとんどの場合、短期間の入院で十分である。 食事制限が治療成績に影響を与えるという証拠はないが、多くの医師は通常、透明な流動食を推奨している
合併症のないACDの管理における最近の大きな変化のひとつは、抗生物質の使用量が減少していることである。 最近のコクラン・レビューでは、定性的なアプローチ(メタ分析なし)のみで、入手可能な最良のデータは、そのルーチン使用をサポートしないことが判明した68。 したがって、この症例に抗生物質を使用することは疑問である。 おそらく、全身感染の兆候、敗血症または細菌血症の兆候のある患者、免疫不全の患者には、抗生物質の使用が適切であろう。 推奨されるレジメンは、臨床的なコンセンサスに基づいている。 グラム陽性菌、グラム陰性菌、嫌気性菌に有効であれば、アンピシリンから第3世代セファロスポリンまで、さまざまな抗生物質を使用することができる。 シプロフロキサシンとメトロニダゾールの組み合わせは、おそらく最も処方されている経口治療薬です。 この組み合わせで忍容性が低い場合は、アンピシリン・スルファバクタムを選択するとよいでしょう。 一方、最近のデータでは、抗生物質の経口投与に対する静脈内投与の優位性、7日間投与に対する4日間静脈内投与の優位性はないことが示されている69-71。通常、治療後3〜4日で臨床的改善が認められる。 7777>複雑なACD(Hinchey病期Ib~IV)の治療ACD Hinchey IbまたはII:膿瘍<7813>ACD患者の約15%が膿瘍を形成する。67 膿瘍形成を伴うACDの最適な管理に関する質の高いエビデンスは存在しない。 入院が適応となる。 大きさは治療成功の重要な決定要因である。 小さい膿瘍(
cm)では、広域抗生物質による保存的治療が推奨される。 72 保存的治療が失敗した場合、または大きな膿瘍の場合は、経皮的ドレナージを行うべきである。 ACD Hinchey IIIまたはIV:化膿性または糞便性腹膜炎
腹膜炎は最も深刻な合併症で、死亡率は14%である。 エビデンスはないが、これらの患者には早期の手術が標準治療とされている。 手術の選択は、患者の状態、手術所見、術者の経験によって左右される。 血行動態が不安定な重症患者には、Hartmannの手術が推奨される。 しかし、血行動態が安定している患者では、近位便迂回を伴う、あるいは伴わない一次吻合術を選択することが望ましいと考えられる。 この推奨は専門家の意見にのみ基づいている。 最近のレトロスペクティブスタディとシステマティックレビュー75-80によると、これらの患者における癌の発生率はむしろ低いことが示されている。 これらのエビデンスに基づき、最も効果的な方法は、症状が持続する患者や CT で疑わしき患者のみを大腸内視鏡検査に導くことであろう。
ACD発症後の管理ACD再発予防
ACDを1回発症すると、約3分の1は2回目のACDを発症し、2回目の発症後は、さらに3分の1は再び発症する。
A) High fiber diet
急性期の発症が治まると、再発予防に高繊維食がよく推奨される。 しかし、ACD患者における高繊維食に関するRCTの結果は一貫していない。 最近発表された高繊維食に関するシステマティックレビューでは、ACDの再発予防における繊維の役割について調査した研究はなかった26,81。 しかし、Strateらの大規模なプロスペクティブスタディーでは、ACDのリスク上昇との関連は認められていない。 また、減量と禁煙はACDの予防に良い影響を与える。
B) 抗生物質
ACDの再発予防における周期的リファキシミンの役割を評価した最近のシステマティックレビューは3件あるが、明確な効果は示されなかった。 病態生理学的な観点から、リファキシミンが再発予防に有効でない理由として、リファキシミン投与終了後7-14日で大腸菌群が回復するため、1ヶ月間、周期的に投与しても大腸菌群を制御できない可能性が考えられる。 しかし、最近のスペインのオープン RCT では、リファキシミンが ACD の症状を改善し、寛解期を維持できることが示されている86。リファキシミンとファイバーを併用した患者の再発率は 10.4% で、ファイバー単独の患者の 19.3% と比較している。 さらに、1年以上経過して初めて診断された患者では、増悪のリスクが高かった(OR 3.34, 95% CI: 0.01-12.18)。 しかし、現時点では推奨することはできないため、さらなる研究が必要である。 また、他の抗生物質の使用を支持するエビデンスはない
C) プロバイオティクス
いくつかのオープンラベルの研究では、ACDの再発防止にプロバイオティクスがどのような役割を果たすかを検証しています。 20年以上前にGiaccariらは、憩室炎後の大腸狭窄患者79名を対象に、リファキシミンに続くLactobacillus sp.の役割について評価した。 87 この観察研究は、このような状況におけるプロバイオティクスの役割の可能性を示唆した最初のものであった。 より最近の研究では、バルサラジドとVSL#3(8種のプロバイオティクス混合物)の併用治療が評価された。 52 まとめ:プロバイオティクスはACDの再発予防に有効であると思われるが、十分にデザインされた研究は不足している。 88-90 Raskinらは最近、興味深い同じ第3相二重盲検プラセボRCT(PREVENT1およびPREVENT2)を発表し、ACD再発予防においてメサラジンがプラセボより優れていないことを示している91。 TrivediとDasは、600人以上の患者を対象とした5つのRCTと1つの非盲検試験のデータを検討し、ACDの再発予防にはリファキシミン単独より併用療法が優れていると結論づけた92
E) 手術
数年前までは、合併症のないACDの発作を2回、あるいは合併症を持つACDを1回発症したら再発による病的死亡を減らすために選択手術を推奨されていたが、最近では再発を防ぐために外科手術が推奨されている。 しかし、選択的手術は罹患率や死亡率を増加させる。93 そのため、手術による罹患率や死亡率と合併症再発のリスクや症状の重症度を比較することが重要である。
最近のデータは、ACDの自然史が過去に考えられたよりもずっと良性であることを示している73、94。 再発の長期的なリスクはこれまで考えられていたよりも低く、その後の緊急手術(3-7%)、死亡(95では、初回ACD症例の16%が緊急手術を受けたのに対し、再発症例ではわずか6%、また初発の30日死亡率も再発に比べ高い(3%対0%)ことが示された。 また、ACDの再発は、炎症による癒着形成により、穿孔を防いでいる可能性も指摘されている。 一方、診断と治療法の改善により、合併症のあるACDの罹患率は低下している。 これらの新しいデータから、米国結腸・直腸外科学会は最新のガイドラインで、ACD 回復後の選択的 S 状結腸切除術はケースバイケースで行うべきであり14 、過去の再発回数は選択的手術の候補者を選択するための良い指標とはならないとしている。 医師は患者の病状や年齢、発作の頻度や重症度、急性期後の持続的な症状の有無を考慮すべきである14
ACDのどの症例が再発するかを予測することは非常に困難である。 ACDの初回エピソードのCTグレードの重症度は、悪い自然史を予測する因子であると思われる。 97 若年(82 歳)であるか否かについてはコンセンサスが得られていない。現在のエビデンスによれば、年齢 は内科的治療を受けた ACD の重症化とは関係がないようであり、選択的手術の適応として考慮されるべきではない。 しかし、若年者ではACDの発生率が高いことを考慮すると、この特定の問題を明らかにするためにさらなる研究が必要である。 コホート研究によると、これらの患者はACDを合併して再発するリスクが高く(穿孔のリスクは5倍)、緊急手術のリスクも高い。したがって、選択的手術の閾値を低くすれば、彼らにとって有利になるかもしれない。 したがって、この点については賛否両論ある。 瘻孔はACD患者の5%未満にしか発生しない。 最も頻度が高いのは、大腸瘻と大腸膣瘻である。 おそらく、ほとんどの患者において、瘻孔閉鎖と一次吻合を伴う一期的な外科的切除が可能であると思われる。 100,101
B) 閉塞
ACDの再発は、不顕性である場合もあるが、炎症が進行することなく結腸の慢性的な狭窄を引き起こすことがある。 高度の閉塞や完全閉塞が起こることもある。 閉塞の治療には、まず悪性の病因を除外することが必要である。 新生物が十分に除外され、ACDがない場合、内視鏡的拡張術や金属ステントを用いた一時的な減圧術が治療の選択肢となる。憩室症に伴う分節性大腸炎の管理
大腸分節の憩室間粘膜の慢性炎症と定義される。 直腸と右結腸は温存される。 血便を伴うことが多く,臨床的にも病理学的にも特徴的な疾患である。 病因は不明である。 組織学的変化は、軽度の非特異的炎症から炎症性腸疾患様の変化まで多岐にわたる。 そのため、鑑別診断が困難な場合が多い。 ほとんどの患者は数週間から数ヶ月で完全に回復します。 しかし、ほとんどの症例が自然に治癒していることから、おそらくこれらの薬剤は必要ないであろう。 現在のエビデンスによると、ファイバー+周期的リファキシミン、メサラジン+プロバイオティクスが最も効果的な治療法であるようである。 ACDでは、抗生物質が依然として治療の中心であり、合併症を伴わないACD患者の大多数では、外来管理が最適なアプローチと考えられているようです。 しかし、合併症のあるACDでは、入院管理と抗生剤の静注療法が必要である。 現在、緊急手術の役割は変わりつつある。 憩室炎に伴う膿瘍の多くは抗生剤の静注や経皮的ドレナージで治療可能であり、緊急手術は腹膜炎を起こした患者にのみ標準治療とされるであろう。 最後に、ACD回復後の選択手術はケースバイケースで行うべきである。
著者の貢献
Gargallo CJ, Sopeña F, Lanas Aは、本論文のデザイン、再編集ドラフト、査読プロセスに同様に貢献した。
利益相反
Carla J. Gargallo博士とFederico Sopeña博士は、利益相反の報告をしていない。 Angel Lanas博士は、AlfaWasserman社の顧問を務めている
。
