昆虫採集は多くの人にとって興味深い趣味ですが、科学的研究にも非常に役立ちます。 この記事では、昆虫の収集と保存の方法を説明し、どのようにピンを立てるべきかを紹介します。
昆虫採集はいつでもできますが、主に春から晩秋にかけて生息しています。 昆虫が最も多く生息しているのは夏でしょう。 暖かく、晴れた日は、おそらく最も多くの昆虫が存在することになりますが、それは異なる時間に別の昆虫が出現するので、異なる時間や気象条件を通して確認することが賢明であろう。 夜間は、街灯やポーチの灯りを見るとよいでしょう。 また、落ち葉や植物には昆虫が生息している可能性が高く、夜行性の昆虫も多いので、ライトには近づかないようにしましょう。 彼らは、ワイヤの周りにラップモスリンやキャンバス布にステッチされているネットから作られている必要があります。 そこから、網の中に壷を入れるか、虫の胸部を持って壷に移します。

Killing Jar – 様々な形や大きさの瓶を2-3個持っておくとよいでしょう。 理想はコルク栓ですが、これは場合によるかもしれません。 彼らは目立つように “POISON “のラベルを付ける必要があります。 瓶の中に石膏や綿を入れ、殺虫剤を入れておく。 Borror、Delong、Triplehornは青酸カリを推奨しているが、酢酸エチルも使用可能で、より安全である。 四塩化炭素やクロロホルムも使用できる。
捕まえたものを処理すること。 多くの柔らかい体の昆虫は、70-90%のイソプロピルアルコールやエチルアルコールに直接入れることができます。 これには多くの種の幼虫やニンフ、そしていくつかの小さな昆虫が含まれます。 堅いボディーの昆虫は殺害の瓶に置かれるべきです。 それが取る長さは昆虫および殺害の代理店に依存し、数分から数時間に及ぶかもしれません。 昆虫が死んだら、変色を防ぐためにできるだけ早く取り出してください。 これらは錠剤箱や上記の紙封筒に入れて保管します。
リラックスすること。 検体をすぐにピンと張って広げられないと、乾燥してしまう可能性が高いです。 この状態になるとかなりもろくなり、並べようとすると折れてしまいます。 これを直すには、弛緩室や弛緩液を使うか、昆虫を水で煮る(ただし傷む可能性があります)。
弛緩室は、容器に湿った砂や布を入れたものです。 カビが生えないようにカーボリック酸を入れるのが理想的です。 1~2日後には再び標本を操作できるようになります。
リラックス液にはさまざまな混合液があり、通常はその中に昆虫を数分間放置します。 バーバー液としてよく知られている混合液の1つを以下に示します。
| 95% エチルアルコール | 50cm3 |
| 水 | 50cm3 |
| エチル | 50cm3 | 95% エチル | 50 cm3 | 20cm3 |
| ベンゼン | 7cm3 |
もう一つの方法として水道水の注入があります。 これは多くの鱗翅目害虫に効果があります。 20-25ゲージの針を使って、翅の下の胸部に完全に満たされるまで水を注入します。 5~20分後、昆虫はリラックスしているはずです。
Preservation in Fluid: これは、上記のように乾燥させないとピンとこない、多くの柔らかい体の昆虫(カゲロウ、トンボ、トビケラなど)に使用することができます。 また、顕微鏡のスライドで研究するような非常に小さな標本や、昆虫の幼虫やニンフにも有効です。 昆虫以外の節足動物もこの方法で保存する。
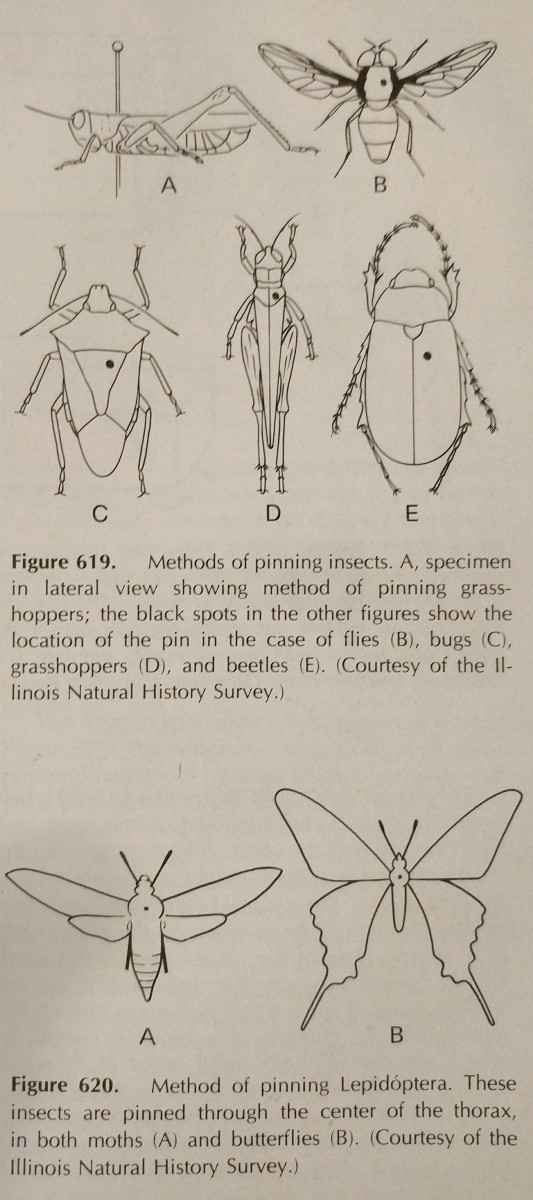
ピンでとめる。 硬い体の昆虫を保存するには、これが一番簡単な方法です。 乾燥すると色落ちすることが多いが、これを避けるのは難しい。 長さがあり、錆びない特殊な虫ピンを使用する。 サイズは00~7号までありますが、小さいと使いにくいかもしれません。 注文ごとにピンを刺す箇所を変えて、写真のようにします。 脚は、羽と同様に伸ばしてください。
コレクション内のすべての種が均一な距離に固定されている場合、それは最高です。 ポイントから約25mm上が理想的で、均一な距離は、異なる深さにドリルで穴を開けた単純な木のブロックであるピンニングブロックを使用することによって簡単に達成することができます
昆虫を広げることは非常に練習についてです。 9090>
昆虫採集は練習が大切です。採集板を使うと作業が楽になりますし、ピンと紙片を余分に持っていることが重要です。 ピンは手足や翅を動かすのに使えます。
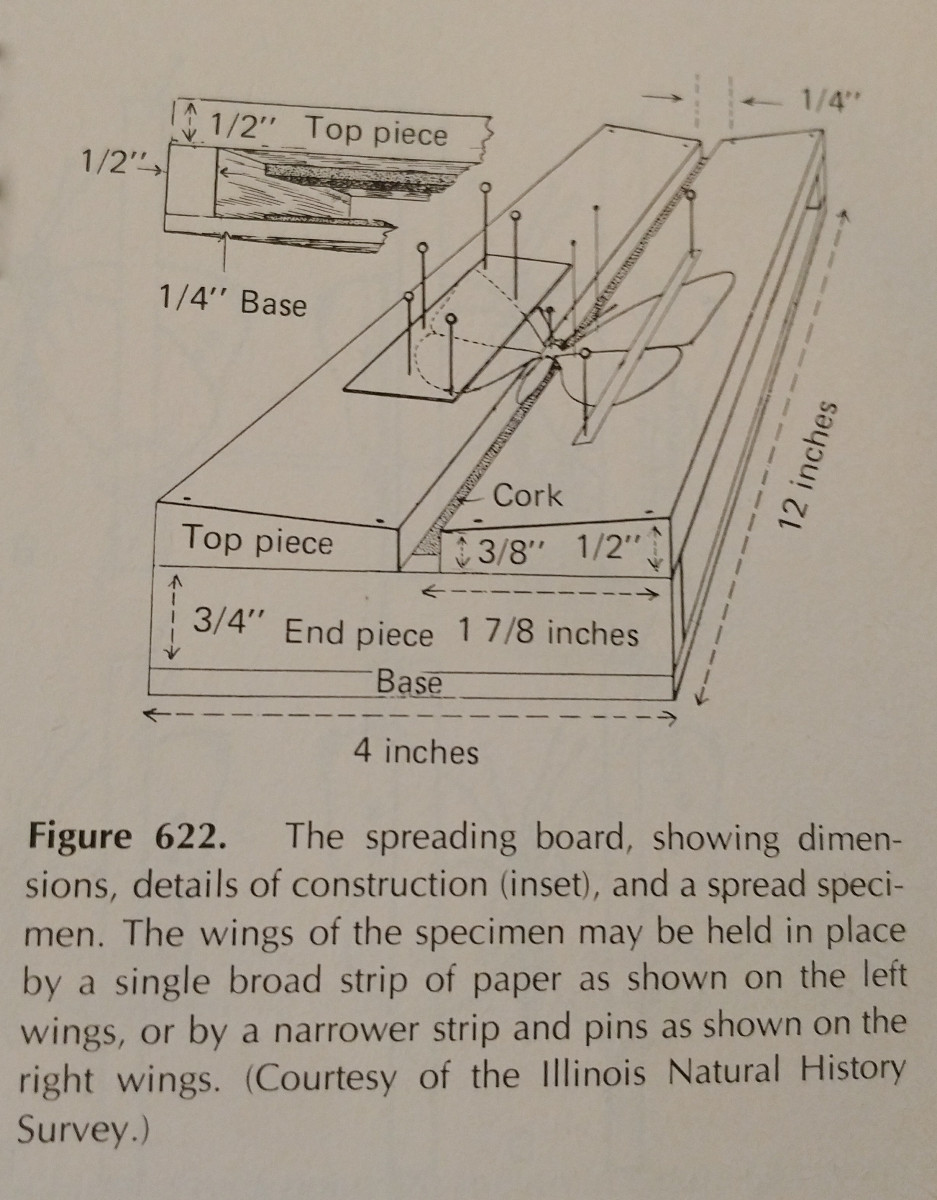
通常、特に鱗翅類では前縁翅脈に圧力をかける必要があります。 鱗翅目では写真のように翅の後縁が胸部と直角になるようにし、後翅を上にして前翅との間に隙間がないようにします。 扱いは慎重に、鉗子などを使って行うことが大切です。 非常に壊れやすく、鱗粉や触角が簡単に取れてしまうことがよくあります。
小さな昆虫の取り付けには工夫が必要で、カードチップや小さなピン、顕微鏡のスライドに接着します。 カードチップにピンを刺し、その上に接着剤を少量つけて、昆虫を接着するだけです
乾燥する。 多くのピンで留めた昆虫は、暖かく乾燥した場所で自然乾燥させることができます。 大きな蛾の場合、1つまたは複数の電球が入った乾燥室が必要で、大きな標本では腹部の器官を取り除く必要がある場合もあります。
柔らかい体の昆虫は凍結乾燥や真空乾燥をしてからピンで留めると、壊れにくく変色しない標本になる。 通常、昆虫は縮んでしまいますが、この手順によりピンで留められるほど乾燥します。
通常、エチルアルコール溶液が使用されます。 一般的なものを以下に挙げる。
| フーズ液 | |
| 70-80% エチルアルコール | 95 cm3 |
| グリセリン | 5 cm3 |
| カーレ液 | |
| 95 %の場合。 エチルアルコール | 30 cm3 |
| ホルムアルデヒド | 12 cm3 |
| 氷酢酸 | 4 cm3 |
| 水 | 60 cm3 |
| アルコール性ブアン溶液 | |
| 150 cm3 | |
| ホルムアルデヒド | 60 cm3 |
| 氷酢酸 | 15 cm3 |
| ピット酸 | 1g |
ところで、溶液についてだが、このような場合、どうすればよいのだろうか。 酢酸エチルは幼虫に効果がないことが多いので、十分な殺虫剤を紹介します。
| KAAD mixture | |
| 95% Ethyl Alcohol | 70-.100 cm3 |
| 灯油(ウジ虫など体の柔らかい幼虫は減らす) | 10 cm3 |
| 氷酢酸 | 20 cm3 |
| ジオキサン | 10 cm3 |
| XA mixture | |
| 95% ethyl acetate | 50 cm3 |
| Xylene | 50 cm3 |
いずれの方法も1/2〜4時間程度で完了します。
通常、保存された標本は、液体が蒸発していないか、年に1、2回点検することが必要です。
顕微鏡のスライドにマウントする。 顕微鏡用マウントには、パーマネントマウントとテンポラリーマウントがあります。 両者では使用するマウント液が異なり、一時マウントは通常マウント後に試料を保存液に戻し、そこで無期限に保存することができます。
軟体昆虫の多くはそのまま埋込液に入れることができますが、中には特殊な液で清澄化する必要があるものもあります。 KOHやNesbitt’s溶液が主なものです。
小さな標本は通常のスライドにマウントできますが、大きな標本はデプススライドやカバーグラスのサポートが必要な場合があります。
スライドマウントの仮留めに使われるメディウムには水、アルコール、グリセリン、グリセリンゼリーなどがあります。
以上で、この記事とBorror, Delong, and Triplehornの保存の項を終わります。 このSOSの残りの作業のほとんどは、私の文書やスライドをまとめることと、私のフローチャートやプロトコルがすべて整っているかどうかを確認することです
。
