簡単な説明
まずエテンのπ結合を簡単なMO理論の立場から考えてみましょう(この例では分子中のシグマ結合は無視し、π結合だけを考えることにします)。 まず、2つの原子軌道から始めます。各炭素のハイブリッドされていない2p軌道が1つずつあります。 それぞれ1個の電子を含んでいる。 MO理論では、2つの原子が数学的に結合して、低エネルギーのπ結合軌道と高エネルギーのπ*反結合軌道という2つのπ分子軌道を形成します。

Molecular orbitals for ethene (ethylene)
In the bonding pi orbital, the two shaded lobes of the p orbitals do as the two unshaded lobes with constructively other (remember, the arbitrary shade choice represents mathematical (+) and (-) sign for the mathematical wavefunction described the orbital).結合性pi軌道では、影を付けられた二つの葉が、陰のない二つの葉と同様に互いに作用します。
より高エネルギーの反結合π*軌道では、1つのp軌道の影のついた葉は、2番目のp軌道の影のない葉と破壊的に相互作用し、2つの核の間にノードが生じ、炭素核の間で全体的に反発し合うことになります。
再び「積み上げ」の原理を使って、2つの電子をエネルギーの低い、結合性のπ分子軌道に配置します。
より詳細な分子軌道法によるエテンの記述
分子軌道法は、大きな共役系、特に単結合と二重結合を交互に持つ炭素原子の鎖を含むものに非常にうまく適用されています。 1931 年に Hückel によって導入された近似法では、非局在化した p 電子だけが \pi -bonds の枠組みの中で動くと考える。 これは、自由電子模型をより洗練させたものである。 有機化学の入門コースでは、ヒュッケルの数学のすべてを使う必要はないが、より深く追求したい人のために、より詳細な解析をここで行う。
考えるべき最も簡単な炭化水素は、4つの水素原子と2つの炭素原子からなるエテン(エチレン)であり、このエテン結合は、水素原子と炭素原子の結合である。 実験的に、エテンの H-C-H と H-C-C の角度はおよそ 120° であることがわかっている。 この角度は炭素原子がsp2混成していることを示唆している。つまり、1つの炭素上の単座のsp2軌道が、それぞれのH上の単座のs軌道および他のC上の単座のsp2ローブに重なっている。したがって、それぞれの炭素は3つのΣ結合、すなわち2つのC-H (sp2 + s) および1つのC-C (sp2 + sp2)を形成する(以下の図 13.1 のパート (a))

Figure 13.1. (a)2組の単座の炭素sp2ハイブリッド軌道と4組の単座の水素1s軌道が重なって電子対結合を形成し、σ結合の枠組みが形成される。 これは12価の電子のうち10価を使い、合計5つのσ結合(4つのC-H結合と1つのC-C結合)を形成している。 (b) 各炭素原子上に1つの単座のハイブリッド化されていない2pz軌道が残り、炭素-炭素π結合が形成される。 (注:慣例として平面分子では分子面に垂直な軸をz軸とする)
ヒュッケル近似は共役系のπ分子軌道のエネルギーと形状を決定するために用いられる。 Hückel近似では、これらの炭化水素の共有結合は、2つの独立した「枠組み」に分離することができる:”the \sigma -bonding frameworks” と “the \sigma -bonding frameworks”. それぞれの枠組みで結合軌道を記述するために用いられる波動関数は、異なる原子軌道の組み合わせに起因する。 この方法では共役炭化水素に限定し、特にシグマ電子を無視した、分子の一般的な性質を決定する分子軌道を含んでいる。 これはσ-π分離性と呼ばれ、平面分子ではσ軌道とπ軌道が直交していることから正当化される。 このため、Hückel 法は平面系に限定される。 Hückel近似は、分子内にある全てのΣ-結合の枠組みによる静電ポテンシャルをΣ-結合中の電子が「感じる」と仮定している(つまり、Σ-結合の枠組みが既に形成されていることからΣ-結合の形成のみに着目している)。
共役系
共役系は、隣接する単結合を橋渡しするようにp軌道が重なった領域を持ち、隣接するすべてのp軌道にπ電子を非局在化することが可能である。 これらの電子は単一の結合や原子に属するのではなく、むしろ原子群に属する。
Ethene
エテンのHückel処理を考える前に、この分子の結合の一般像を確認しておくとよい。 エテンの結合は、各炭素原子の2s、2p_x、および2p_y原子軌道のsp^2混成を伴い、2p_z軌道はそのまま残ります(図13.2)
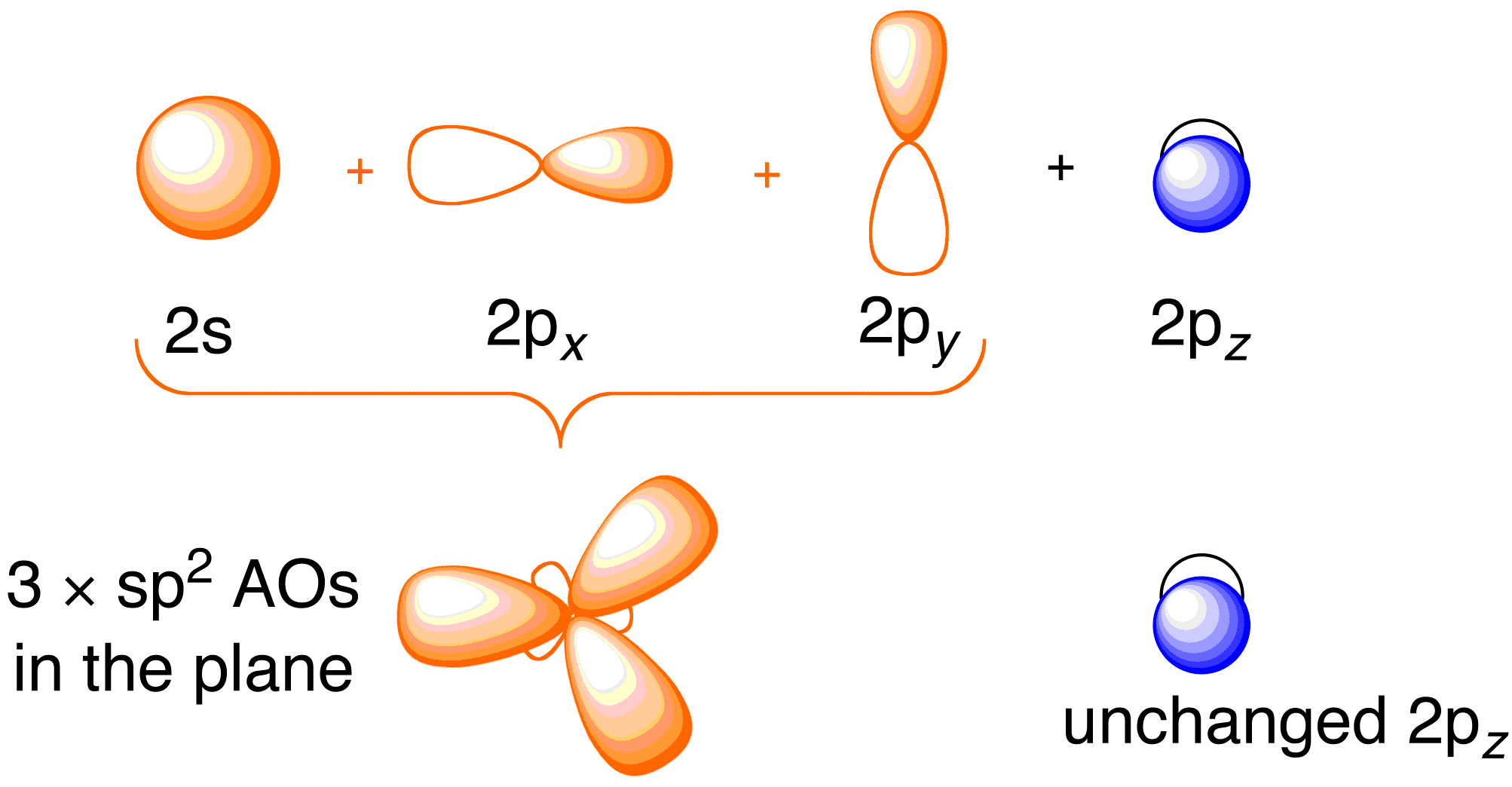
Figure 13.2. 炭素原子軌道のハイブリッド化により、エテンの水素原子に結合するためのsp^2ハイブリッド軌道を与える。 Image used with permission from ChemTube (CC-SA-BY-NC; Nick Greeves).
ここで説明する分子軌道アプローチにおけるハイブリッド軌道の使用は単なる便宜上のもので、価電子結合理論を(直接)呼び出しているわけではありません。 炭素の原子軌道だけを使っても同じような記述が抽出できるが、得られる波動関数の解釈は直感的でない。 例えば、i番目の分子軌道はhybrid orbitals
or via atomic orbitals.
where \{a_i} and \{c_i} are coefficients of the expansion.で記述することができる。
where \{c_i} is coefficients describing the hybridized orbitalなので、どちらの記述でもよく、どちらも同一のアプローチである。
結合は炭素上のsp^2混成軌道の電子と4つの水素原子の1s原子軌道の電子が混ざり合って起こる(図13.2左上)ので、Σ-結合という枠組みができる。 また、2p_z軌道がハイブリッド化されていないため、π結合の枠組みが生じる(図13.2.上、右)。 この2つの枠組みの独立性は、下図の分子軌道図に示されている。ヒュッケル理論は、π結合の枠組みの分子軌道とエネルギーだけを記述することに関係している。 図13.3:エチレンのΣ-π結合フレームワーク(青)とΣ-π結合フレームワーク(赤)のシグマ分離可能性を示す分子軌道。
Hückel の取り扱いは、あくまで \pi 結合枠組みの分子軌道とエネルギーを記述することにある。
ヒュッケル理論は分子軌道理論の特殊な考察であるから、分子軌道|Ⓐπ結合|は炭素における2p_z原子軌道|πとそれらに対応する|c_i}係数の線形結合として記述することができる。
シュレーディンガー方程式を用いた完全な量子化学的解析(有機化学の授業では必要ない)については、このLibretextsのページを参照してください。
これらの分子軌道はπ結合の枠組みを形成し、各炭素はこの枠組みに1個の電子を寄与するので、基底状態では最低分子軌道(| \psi_1|rangle )のみが占有されます(図)。 このとき、対応する電子配置は \pi_1^2 .

Figure 13.4.である。 図13.4: エチレンの分子軌道フレームワークの模式図
HOMOとLUMOはそれぞれ最高被占有分子軌道と最低非占有分子軌道の頭文字を取ったもので、フロンティア軌道と呼ばれることもあります。 HOMOとLUMOのエネルギー差はHOMO-LUMOギャップと呼ばれる。
3次元計算によるエチレンの分子軌道を図13.5に示す。

Figure 13.5: Calculated \pi molecular orbitals for ethylene . (左)結合軌道(ψ1)、(右)反結合軌道(ψ2).
投稿者
- Seymour Blinder(ミシガン大学アナーバー校名誉教授)
- Wikipedia
- StackExchange (Philipp)
