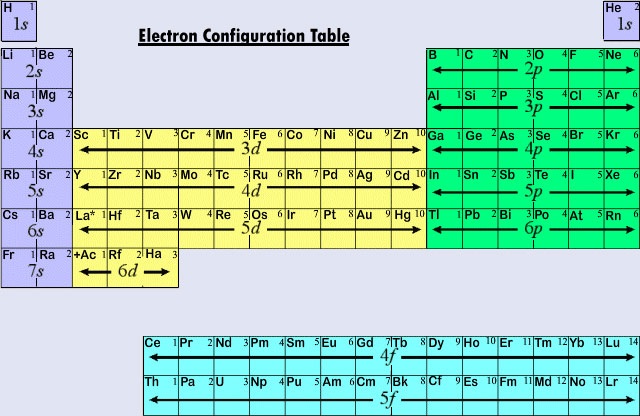
一般に使われている長い形式の周期表は、電子配置を重視したデザインになっています。 原子間の化学的相互作用に主に関与するのは一番外側の(価)電子なので、化学者にとっては最初の電子よりも、積み上げの過程で原子に加えられた最後の電子の方がはるかに興味があるのです。 この最後の電子は、周期表で直前の原子と区別されるため、区別電子と呼ばれる。 この識別電子が入る殻の種類(s、p、d、f)は、元素の化学的挙動と密接に関係しており、周期表の色分けで示される分類がなされている。 代表的な元素は、識別電子がansまたはp副殻に入るものである。 これまで述べてきた化学的性質や価数などの元素のほとんどがこれに該当する。 代表的な元素の化学的性質の多くは、ルイス図に基づいて説明することができる。 すなわち、代表的な元素の価数は、その元素が持つ価電子の数、あるいは希ガスの原子と同じ電子配置になるために追加しなければならない電子の数から予測することができる。 代表的な元素の場合、価電子数は周期群番号と同じであり、次の希ガス配置に一致するために必要な数は、8から群番号を引いた数である。 これは周期表から導かれる価数法則と一致し、その結果、価数の周期的変化を示す最初の12元素の塩化物の公式が得られる。
| 元素 | 原子量 | 水素化物 | 酸素化物 | 塩素化物 | ||
|---|---|---|---|---|---|---|
| 水素 | 1.01 | H2 | H2O, H2O2 | HCl | ||
| Helium | 4.00 | None formed | None formed | |||
| Lithium | 6.0.94 | LiH | Li2O, Li2O2 | LiCl | ||
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 | ||
| Boron | 10.81 | B2H6 | B2O3 | BCl3 | ||
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | ||
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | ||
| 酸素 | 16.H2O | 16.00 | H2O、H2O2 | O2、O3 | <Cl2O, ClO2、Cl2O7 | |
| Fluorine | 19.Ni、Ni(弗素) | HF | OF2, O2F2 | ClF, ClF3, ClF5 | ||
| Neon | 20.18 | None formed | None formed | |||
| Sodium | 22.Neon | 22.99 | NaH | Na2O, Na2O2 | NaCl | |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
現代の周期表における最初の3行または期間はすべて代表元素で構成されています。 第1周期では、HとHeの区別する電子は1s副殻にある。 第2期ではLiとBeの識別電子は2s副殻にあり、BからNeまでの原子では2p副殻に電子が追加されている。 第3期では、NaとMg、したがってAl、Si、P、S、Cl、Arで3s副殻が埋まっている。 代表的な元素の場合、原則として、区別する電子はnsまたはnp副殻になる。 識別電子の主量子数であるnの値は、周期表の上から順に数えていけばすぐにわかる。 例えば、ヨウ素は第5周期を代表する元素である。 したがって、識別電子は5sか5pのいずれかの部分殻を占めるはずです。
主量子数が3以上の場合は、d型副殻もありえます。 遷移元素または遷移金属は、その特徴的な電子がd軌道にある元素である。 遷移金属の最初の例(Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn)は、いずれも特徴的な電子が3d電子で第3殻に属していても第4周期で発見されます。 この休止は、すでに見たように、4sが3dよりもエネルギーが低いために起こります。
Figure \(\PageIndex{1}) は、V原子における4sと3dの電子の確率分布を比較したものである。 4s電子の雲は平均的には3d電子の雲よりも原子核から離れていますが、4s電子密度のごく一部は原子核に非常に近く、全核電荷+23からほとんど遮蔽されていません。 4s電子のエネルギーを3d電子よりも低くしているのは、この全4s電子密度のごく一部の非常に強い引力のおかげなのです。
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
4s electron cloud is more extensive than the 3d という事実は遷移元素の化学に大きな影響を与えている。 Vのような原子が他の原子と相互作用するとき、最初に相手と接触するのは原子核から最も遠くに伸びている4s電子です(図⑭)。 そのため、原子価や化合物の式を決定する際には、3d電子よりも4s電子の方が重要視されることが多い。 3d電子は、遷移金属の原子の表面の下に「埋もれて」いる。 3d電子を1個増やしても、代表的な元素の3s電子や3p電子を1個増やしても、その化学的性質に与える影響はかなり少ない。 そのため、遷移元素の性質は、ゆっくりではあるが、着実に変化している。 例えば、Scを除くすべての遷移金属は、金属の価数が2の場合、塩化物(MCl2)を形成することに注目しよう。 このことは、このページの一番上にある表で見ることができます。 2価は2個の4s価電子に対応します。
各遷移金属は、1個または複数の3d電子が関与する他の価数にも対応しています。 たとえば、ある化合物では、V(バナジウム)は2価(VO、VCl2)、他の化合物では3価(V2O3、VCl3)、さらに他の化合物では4価(VO2、VCl4)、少なくともある場合(V2O5)では5価を持つ。 このように価数が変化するため、遷移金属の化学はより複雑であり、遷移金属化合物の式も多様になる。 d殻の電子は、価電子として働く場合と、働かない場合がある。 3d電子雲は3sや3pほど原子核から離れないが(つまり4s電子のように別の殻を構成しない)、核電荷から徹底的に遮蔽されているため、しばしば価電子として作用するのである。 このジキルとハイドのような3d電子の振る舞いは、遷移元素を研究する化学者にとって、人生をより複雑に(そしてしばしばはるかに面白く)している。 原子電子配置
3s 1
P
P
19
Sc
3d 8 4s 2
Ru
I
56
0s
6d 1 7s 2
91
5f
第3の大きな分類は識別電子がf副殻にあるとき発生する元素である。 最初の例はランタノイド(原子番号57から71の元素)の場合に起こる。ランタノイドは一般的な電子配置
4d104f i5s25p65d0 or 16s2
(iは0から14までの数字)を持つ。 したがって、ランタノイドの生成過程では、一番外側の軌道(6s)よりも主量子数が2少ない副殻(4f)に電子が追加されることになる。 4fのように深く埋もれた内殻に電子を追加しても、これらの元素の化学的性質にはほとんど影響がない。 いずれもランタン(La)によく似ており、周期表でLaと全く同じ場所に収まるかもしれない。 ランタノイド元素は互いに非常によく似ているため、分離するためには特別な技術が必要である。 そのため、ほとんどの元素のほぼ純粋な試料さえも、1870年代まで用意することができなかった。 アクチニウム(Ac)に続くのは、5f副殻が充填されている一連の原子である。 アクチノイドは、Th、Pa、Uのように通常の充填軌道の順序に例外があるため、ランタノイドとLaの類似性にはやや劣る(Table \(PageIndex{1}) )
Lanthanoids and most of the Actinoids are chemically behave as if they fit in group IIIB of the periodic table (where Lu and Lr are found), both groups are separated from the rest of the table and put together in a block below.これは、Heがp殻ではなくs殻の領域にあるにもかかわらず、緑ではなく紫のボックスになっているからです。 ランタノイドとアクチノイドを合わせて内部遷移元素と呼ぶのは、充填されるf副殻が原子の残りの電子構造の奥深くにあるためである
Figure \(\PageIndex{2}) は、周期表のいろいろな領域の元素の原子が、どの副殻に区別電子を見出すべきかをまとめている。 この情報を利用すれば、次の例のように周期表を使って電子配置を求めることが比較的簡単にできます。 電子配置
Object for (a) Nb; (b) Pr.
解答
a) Nb(元素番号41)は第5周期、周期表ではd副殻が充填されている領域(第2遷移系列)に存在することがわかります。 周期表の後方(より低い原子番号の方)に移動すると、最も近い希ガスはKrなので、Krカーネルを使用します:
Nb _____
36Kの次の元素は37Rbで、5s部分殻が充填されています。 もう1つ右に移動すると,38Srになり,5s2のペアを持つようになります。 ここまでで、Nb _____ 5s2がNbの配置です。 次に、周期表の4d副殻領域へさらに右へ移動し、3つの空間(Y, Zr, Nb)を越えてNbに到達する。 したがって、全電子配置は Nb 4d35s2 となる(d 副殻の主量子数は 4 であり、周期数より 1 つ少ないことに注意)。 また、電子配置の表を見ると、Nbは典型的な軌道充填規則の例外であることに注意する必要がある) b) 59番元素のPrについても同様の手順で計算する。 表から逆算すると、最も近い希ガスは Xe であるので、Xe カーネルを用いる。 再び前方へ数えると、Cs と Ba は 6s2 に対応する。 次にLa、Ce、Prは4f副殻の電子が3個増えることに対応する。 したがって、Pr…4f36s2
電子配置と周期表の関係について、もう一つ強調しておかなければならないことがある。 周期表の同じ縦列にある元素の原子は、似たような電子配置をしている。 例えば、アルカリ土類(IIA族)を考えてみましょう。 電子配置の導出規則(例1)を使うと、
| 元素 | 電子配置 | ルイス図 |
|---|---|---|
| Be | 2s2 | Beのような感じになるわけですが、電子配置の導出規則(例3)では、電子配置の導出規則(例4)を使って電子配置の導出を行います。 |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr.Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
したがって、これらの元素について先に述べた化学挙動と価数の類似は、最外殻電子雲の類似と相関しているのである。 このような類似性が、メンデレーエフが未発見の元素の性質を予測したことの成功の理由です。 Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.
