ただし、塩の構成イオンが持つ酸塩基性により、塩は水に溶けて中性溶液、塩基性溶液、酸性溶液になることがあります。
水に溶けた塩(例えばNaCl)は、(Na^+_{(aq)})と(Cl^-_{(aq)})というイオンを発生させる。 電子対受容体であるため、ルイスの考え方で酸として見ることができますが、電荷が少なく半径が大きいため、非常に弱い酸です。 また、強酸であるⒶの共役塩基であるⒷイオンには塩基性がない。 そのため、”NaCl “を水に溶かしても溶液の “pH “には影響せず、溶液は中性のままです。
ここで、シアン化カリウムと酢酸ナトリウムの水溶液の挙動と比較してみましょう。 ここでも、陽イオン( \(K^+) and \(Na^+) )には基本的に酸の性質はありませんが、陰イオン( \(CN^-) and \(CH_3CO_2^-) )はそれぞれ弱酸である \(HCN) and acetic acid の共役塩基なので水と反応しうる弱塩基であることがわかります。
どちらの反応も弱い方の酸塩基対の形成が優先されるため、書いたようにあまり右へ進みません。 γ(HCN)も酢酸も水より強い酸であり、水酸化物は酢酸やシアン化物より強い塩基なので、いずれも平衡は左側にある。 しかし、いずれの反応も塩基性溶液を生成するのに十分な水酸化物イオンを生成する。 例えば、酢酸ナトリウムとシアン化カリウムの0.1M溶液の25℃におけるpHは、それぞれ8.8と11.1である。 表 ㋑と図㋒から、㋓は酢酸塩(pK_b = 9.)よりも強い塩基(㋔= 4.79)であることがわかります。24))であり、同じ濃度では酢酸ナトリウムよりも塩基性の溶液を作ることと矛盾しない。
一方、弱塩基の共役酸は弱酸であるべきである(式(Ⓐ)。 例えば、塩化アンモニウムと塩化ピリジニウムは、それぞれアンモニアとピリジンを♪HCl♪と反応させてできる塩である。 ご存知のように、塩化物イオンは水と反応しないほど弱塩基です。 一方、2つの塩の陽イオンは弱酸であり、次のように水と反応する:
Equation \(\ref{16.2}) は、ⒶはⒷ(NH_4^+Ⓐ)やⒷ(C_5H_5NH^+Ⓑ)よりも強い酸で、逆にアンモニアとピリジンは水より強い塩基であることを示しています。 したがって、平衡はどちらの場合も左寄りになり、弱い方の酸塩基のペアが有利になる。 しかし、反応によって生成される “H_3O^+”濃度は、溶液の “pH “を大きく低下させるのに十分で、0.10Mの塩化アンモニウムまたは塩化ピリジニウムの溶液の25℃における “pH “はそれぞれ5.13または3.12となった。 これは図16.2の情報と一致し、ピリジニウムイオンがアンモニウムイオンよりも酸性であることを示している。
酢酸アンモニウムのように、カチオンとアニオンが別々に水と反応してそれぞれ酸と塩基を生成できる塩の水溶液はどうなるのでしょうか。 図16.10によると、アンモニウムイオンのほうで♪pH(ペーハー)が下がり、酢酸イオンのほうで♪pH(ペーハー)は上がります。 この特殊なケースは、陽イオンが陰イオンと同じくらい強い酸であるという点で異常です(pKa ≈ pKb)。 その結果、2つの効果は相殺され、溶液は中性のままである。 陽イオンが陰イオンより強い酸である塩の場合、最終溶液のpHは7.00となり、pKaは560となります。 8653>
金属イオンの単純な塩の溶液も酸性になることがあるが、金属イオンは水に直接プロトンを供与して♪(H_3O^+)を生成することはできない。 その代わり、金属イオンはルイス酸として働き、酸素原子上の孤立電子に配位してルイス塩基である水と相互作用し、水和金属イオンを形成します(図中の(a)部分)。 金属イオンに配位した水分子は、自由な水分子よりも酸性に傾いている。 まず、正に帯電した金属イオンと配位した水分子の部分的に正に帯電した水素原子との間の反発する静電相互作用によって、配位した水はプロトンを失いやすくなる。
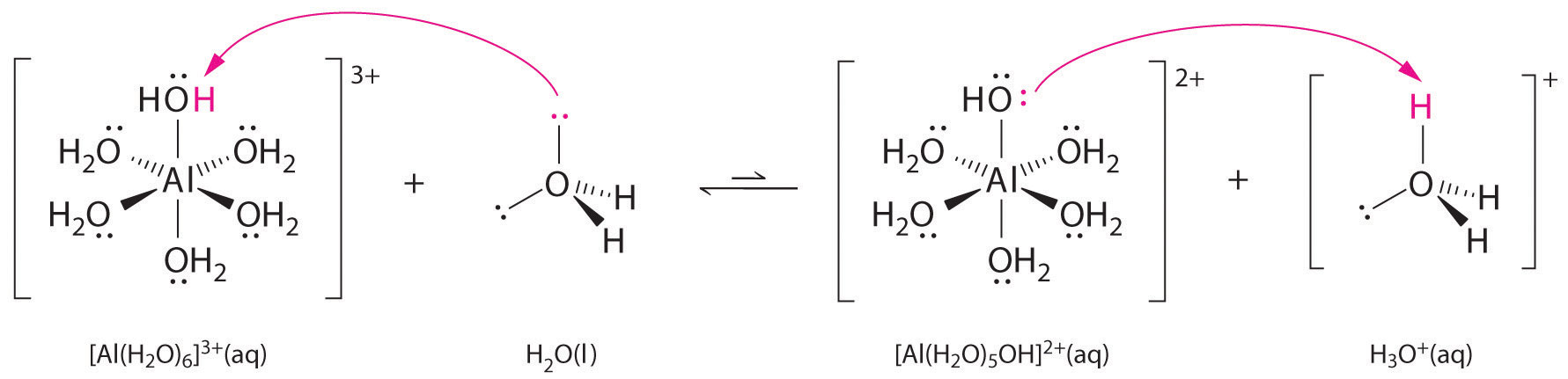
第二に、図中の(b)の部分に示すように、正電荷を持つ♪(Al^{3+)イオンが水分子の酸素原子から電子密度を引き寄せ、♪(Ce{O-H})結合中の電子密度を減少させるからです。 このように、H原子との間の電子密度が低下すると、フリーのH_2O分子よりも、”ce{O}-H}”結合が弱くなり、H^+Iが失われやすくなります。 金属イオンが水の酸性度に及ぼす影響 (a) 金属イオンⒶ(Al^{3+}) と水との反応により水和金属イオンが生成するのは、ルイス酸塩基反応の一例である。 (b) アルミニウムイオンの正電荷が酸素原子から電子密度を引き寄せ、O-H結合から電子密度が移動する。 電子密度が減少すると、水分子のO-H結合が弱まり、プロトンが失われやすくなります。
この効果の大きさは、次の2つの要因に依存します(図(㊦)):
- 金属イオンの電荷。 2価のイオンは同じ半径の1価のイオンに比べて配位水分子の電子密度に約2倍強い影響を与える。 同じ電荷を持つ金属イオンでは、イオンが小さいほど水分子の酸素原子までの核間距離が短くなり、水分子の電子密度分布に対する金属の影響が大きくなる。
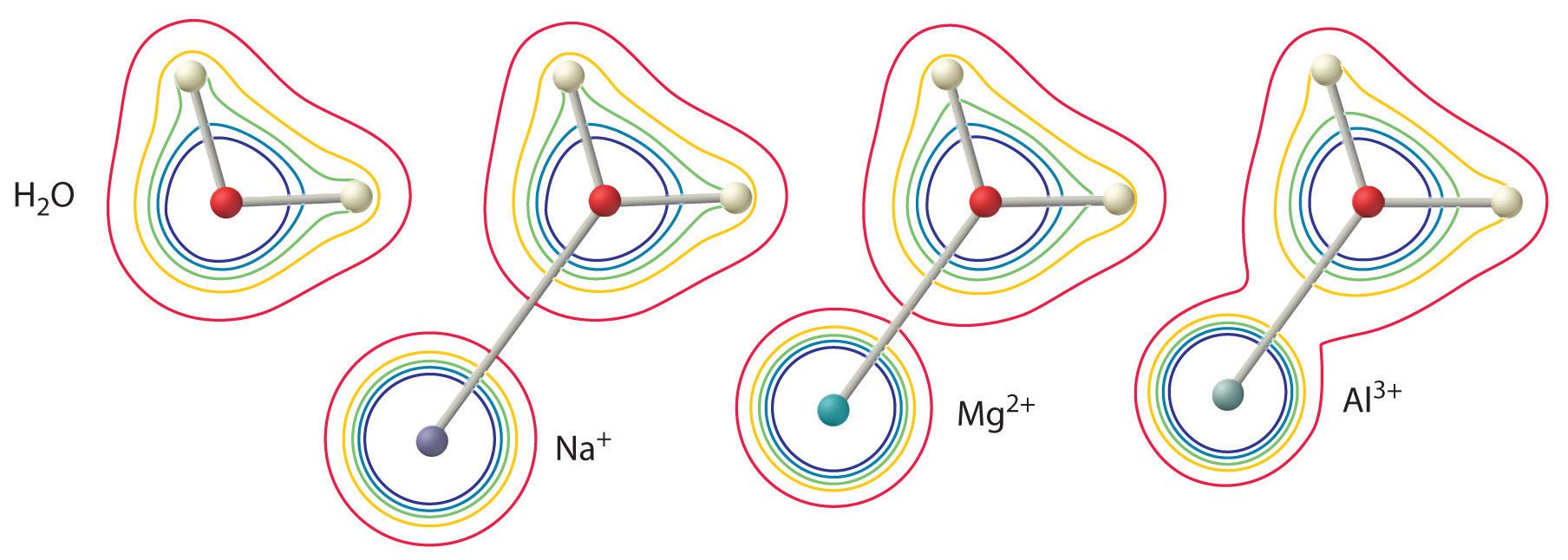
図 金属イオンの電荷と半径が配位水分子の酸性度に与える影響。 左図は自由水分子、右図は金属イオンが配位した水分子のO原子とH原子の電子密度を示している。 これらのコンターマップは、最も小さく、最も高電荷の金属イオン( \(Al^{3+}} )が、水分子のO-H結合の電子密度を最も減少させることを示している。 この効果により、水和した金属イオンの酸性度は、金属イオンの電荷が増加し、半径が減少すると増加する。
このように小さく、高電荷の金属イオン、例えば \(Al^{3+}) やFe^{3+}の水溶液は酸性になる:
Mathematics^{3+}_{(aq)} (注1) \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}]
The \(^{3+}) ion has a \(pK_a) of 5.0, and makes almost as strong an acid as acetic acid.これは、酢酸と同じ強酸です。 前述の2つの要因から、金属イオンが配位水分子の酸性度に及ぼす影響を予測する上で最も重要なパラメータは、金属イオンの電荷と半径の比である。 周期律表の対角線上にある金属イオンの組、例えば \(Li^+) and \(Mg^{2+}) or \(Ca^{2+}) and \(Y^{3+}) は、大きさと電荷は異なるが、電荷-半径比は似ているものが多数存在する。
小さく、電荷の高い金属イオンの水溶液は酸性である。
本節で述べたような、塩と水が反応して酸性または塩基性の溶液を与える反応は、しばしば加水分解反応と呼ばれている。 この種の反応に別の名前を使うのは、両者が何か異なるものであることを示唆しているので残念なことである。 実際、加水分解反応は、酸を陽イオン、塩基を陰イオンとする酸塩基反応であり、他のすべての酸塩基反応と同じ原理と規則に従っているのである。
加水分解反応は酸塩基反応である
Example \(\PageIndex{1})
これらの化合物の水溶液は酸性、塩基性、中性であるかを予測しなさい。
- (KNO_3)
- (CrBr_3 cdot H_2O)
- (Na_2SO_4)
Given: compound
Asked for.は、これらの化合物の水溶液が酸性か塩基性か、または中性かを予測する。 水溶液の酸性度または塩基性
Strategy:
- カチオンとアニオンの酸塩基特性を評価する。 陽イオンが弱アルイス酸であれば、溶液のpHに影響を与えません。
- アニオンが強酸の共役塩基であれば、溶液のpHに影響を与えない。
溶液:
a
- 陽イオン(K^+)は正の電荷が小さく(+1)、半径が比較的大きいので(周期表の4行目にあるので)非常に弱いルイス酸であると言えるでしょう。
- アニオンは強酸の共役塩基なので、基本的に塩基性を持ちません(表16.1)。 したがって、カチオンもアニオンも水と反応して♪(H^+)や♪(OH^-)を生成せず、溶液は中性となる。
b.
- \(Cr^{3+}) ionは比較的電荷の高い金属カチオンで、(Al^{3+}) ionと同様の挙動を示すはずで、(^{3+}) complexを形成して弱酸として挙動を示すだろう。 \γ^{3+}_{(aq)}となる。 \ʕ-̫͡-ʔ-ʔ Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_{(aq)}. \⑭アニオンは非常に弱い塩基なので(強酸の共役塩基)、溶液のpHに影響を与えません。 したがって、溶液は酸性になる。
c.
- The \(Na^+) ion, like the \(K^+) is a very weak acid, so it should not affect the acidity of the solution.
- In contrast, \(SO_4^{2-}) is conjugate base of \(HSO_4^-), which is a weak acid.したがって、このイオンも酸性であろう。
演習 ⑭(\PageIndex{1})
以下の水溶液が酸性、塩基性、中性であるかを予測しなさい。
- (KI)
- (Mg(ClO_4)_2)
- (NaHS)
Answer:
- neutral
- acidic
- basic (due to reaction of \(HS^-) with water to form \(H_2S) and \(OH^-))
Summary
A salt can dissolution in water to generate a neutral, 弱酸の共役塩基をアニオンとして含むか( \(A^-))、弱塩基の共役酸をカチオンとして含むか( \(BH^+))、その両方かによって、酸性溶液、塩基性溶液、または酸性溶液のいずれかになります。 小さく電荷の高い金属イオンを含む塩は、水中で酸性の溶液を作る。 塩が水と反応して酸性または塩基性の溶液を生成することを加水分解反応という。
