A: アミノ酸
BIOCHEMISTRY – DR. JAKUBOWSKI
最終更新日: 02/27/16
第2章Aに関する学習目標/目的です。 授業と本書の読了後、学生は
- ヘンダーソン・ハッセルバッハの式と任意のpHにおける検査によるおおよその電荷を用いてアミノ酸側鎖の電荷を述べ、
- 求核性側鎖LysおよびCysと一般の化学修飾剤の反応について機構図を描き、生成物を特定し、その理解をHisの反応に拡張できるようになる。
- スルフヒドリルのジスルフィド交換反応の機構を描き、酸化数を用いてシステイン/シスチンの酸化還元反応を説明することができる
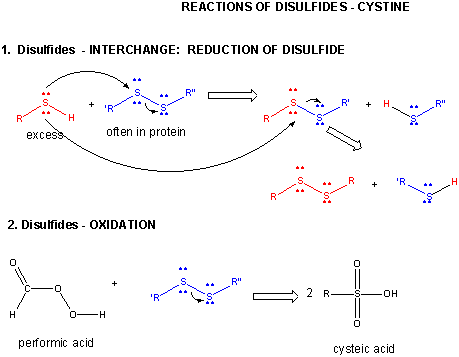
A7. シスチン化学
2つのシステイン側鎖は、タンパク質中で共有結合的に相互作用してジスルフィドを生成することができます。 HOOH(過酸化水素)がHOHよりも酸化されているように(H2O2のOは酸化数1-、H2OのOは酸化数2-)、チオールの酸化型(S酸化数1-)がRSSR、還元型(S酸化数2-)がRSHとなります。 OとSはともに周期表第6族に属し、Cよりも電気陰性度が高いので、この酸化数は類似しています。
酸化還元反応と酸化数について簡単に復習しておきましょう。
図解。 DISULFIDE – CYSTINE – REACTIONS
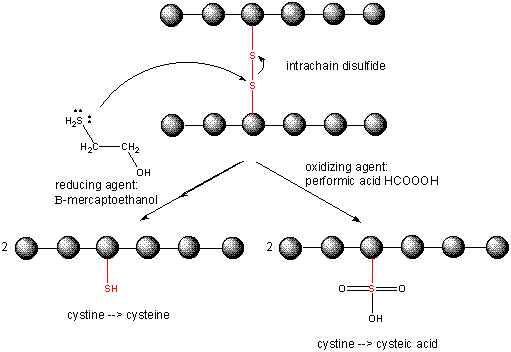
タンパク質が折れるとき、2つのCys側鎖が互いに接近し、鎖内ジスルフィド結合を形成する可能性があります。 同様に、別々のタンパク質上の2つのCys側鎖が互いに接近し、鎖間ジスルフィドを形成する可能性もある。 このようなジスルフィドは、タンパク質の配列を分析する前に切断し、鎖を分離する必要があります。 タンパク質中のジスルフィドは、β-メルカプトエタノール、ジチオスレイトール、トリス(2-カルボキシエチル)ホスフィン(TCEP)などの還元剤や酸化剤によって切断され、さらに酸化されてシステイン酸に分離されます。
図: ジスルフィド酸化剤-b-メルカプトエタノール、ジチオスレイトール、ホスフィン
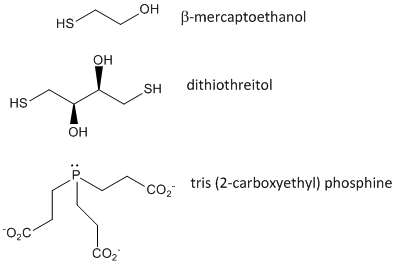
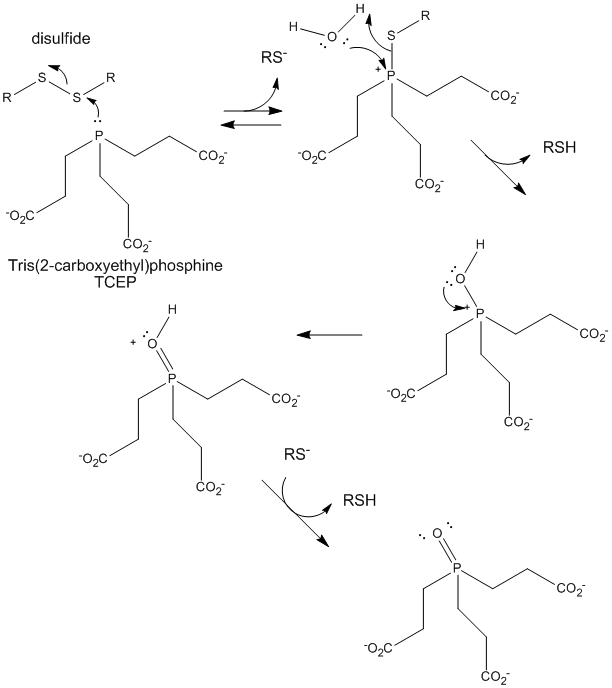
図: TCEPによるジスルフィドの還元
細胞内はトリペプチドg-glu-cys-gly(グルタチオン)などの多くの「還元剤」の存在により還元環境に保たれています。 したがって、細胞内タンパク質は通常ジスルフィドを含まないが、細胞外タンパク質(血液に含まれるものなど)や、小胞体やミトコンドリア膜間空間などの特定の小器官にはジスルフィドcが導入されることがある
Figure:
Cleaving Disulfide Bonds in Proteins
Cysteine Redox Chemistry
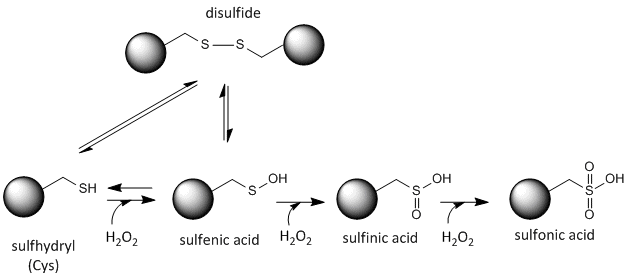
システインの硫黄は酸化還元活性があり、したがって、局所の酸化還元環境と酸化剤および還元剤の存在によって、さまざまな状態で存在することが可能である。 細胞内で作られる強力な酸化剤は過酸化水素であり、これはシステイン側鎖により劇的で不可逆的な化学修飾をもたらす可能性がある。 反応性の高いCysがタンパク質の機能にとって重要であれば、下図に示すように、様々な酸化剤を用いてタンパク質の機能を(時には可逆的に、時には不可逆的に)調節することが可能である。
図:システインの酸化還元状態
ナビゲーション
第2章A:アミノ酸のセクションに戻る
生化学オンライン目次に戻る
完全版のアーカイブに戻る
