 Open Access Article
Open Access Article This Open Access Article is licensed under a
This Open Access Article is licensed under a
Creative Commons Attribution 3.XXXXXXX.XXXXXXX.XXXXXXX.XXXXXXX.XXXXXXX.XXXXXXX.XXXXX.XXXXXXX.XXXXX.XXXXX.XXXXX.XXXXX.XXXXX.XXXXX.XXXXX.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc and Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry&化学生物学(教育部)、清華大学化学部、北京100084、P. R. China.。 E-mail: [email protected]
b 北京化工大学化学資源工学国家重点実験室、北京、100029、P. R. China
c 浙江中医薬大学薬学院、杭州、浙江、311400、P. R. R. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
First published on 27th March 2017
バイオ関連の研究ではポリエチレングリコール(PEG)誘導体は広く使用されている。 しかし、PEGオリゴマー(分子量が異なる)やPEG系モノマー(鎖末端基が異なる)は、実際には化学的・物理的性質が異なり、潜在的な毒性につながる可能性がある。 本研究では、一連のPEG誘導体(オリゴマーおよびモノマー)の細胞毒性を、モデル細胞としてヒト子宮頸がん細胞(HeLa)およびマウス由来の線維芽細胞の細胞株(L929)を用いて測定している。 L929細胞に対して高濃度で毒性を示すトリエチレングリコール(TEG)を除き、ほとんどのPEGオリゴマーはどちらのタイプの細胞に対しても安全であることが確認された。 一方、ポリエチレングリコールメチルエーテルアクリレート(mPEGA)およびポリエチレングリコールメチルエーテルメタクリレート(mPEGMA)を含むPEGベースモノマーは、明らかな細胞毒性を示した。 その後、これらの毒性のあるPEG誘導体は、その毒性の異なるメカニズムを明らかにするために研究されてきた。 本研究では、PEG誘導体の細胞毒性を評価し、「安全な」生体材料の潜在的な危険性を指摘することで、今後PEG誘導体を生物医学研究に用いる際の有用な参考となる可能性があります。 例えば、PEGは優れた保湿性と潤滑性を持つことから、食品医薬品局(FDA)認可の下剤に使用されています1-3。また、医薬品やタンパク質をPEGで修飾(PEG化)することにより、医薬品の水溶性や循環半減期を効果的に改善し、安全性や治療効果を高めることができます4,5。 実際、PEG化は最も魅力的なバイオテクノロジーの1つとなっており、基礎研究および市場において大きな成功を収めています6-11。現在までに、多くのPEG誘導体が優れた出発材料として用いられ、バイオ応用のための多くの新しい高分子材料を合成してきました12。例えば、直鎖PEGは二官能化PEG(DF-PEG)として修飾されており、興味深い自己修復ヒドロゲルを迅速に生成することができる13、14。 いくつかのPEGオリゴマーは、無機ナノ粒子表面の改質を行い、水溶性の向上や無機材料の毒性低減に使用されている15。-17 ポリエチレングリコールメチルエーテルアクリレート(mPEGA)やポリエチレングリコールメチルエーテルメタクリレート(mPEGMA)のような市販のPEGベースモノマーは、その後のタンパク質コンジュゲーション、自己集合、ドラッグデリバリーなどのための分岐ポリマーの調製に用いられてきた18-27
通常PEGはほとんど無毒と考えられているが、研究者によって低分子量PEGのいくつかの安全ではない問題点が指摘されてきている。 Smythらは、PEGオリゴマー(Mn ∼ 200)のラットにおける慢性経口毒性を報告しており28,29、またサルにおいても有害な結果が観察されており30、これらの「安全な」材料の安全性に関する潜在的な問題が示唆されています。 したがって、PEG誘導体の研究分野での幅広い利用を考慮すると、これらのPEGオリゴマーおよびPEGベースモノマーの系統的な細胞毒性研究は、バイオ関連分野でのさらなる応用のために必要かつ重要である(Scheme 1)
Scheme 1 異なる分子量および最終基数を持つPEG誘導体の考えられる細胞毒性。
本研究では、いくつかのPEGオリゴマー(分子量の異なるもの)および市販PEG系モノマー(鎖末端基の異なるもの)について、ヒト子宮頸癌細胞(HeLa)およびマウス由来の線維芽細胞株(L929)への細胞毒性を評価しました。 PEGオリゴマーの分子量依存的な細胞毒性が観察され、PEGオリゴマーとPEG系モノマーの異なる細胞毒性メカニズムが初めて明らかとなった。 このようなPEG誘導体の細胞毒性情報は、PEGを出発物質として選択し、精製経路を設計して生体適合性の高いPEG系材料を調製し、さらなるバイオメディカル応用を目指す人々にとって貴重な参考となる可能性がある。1 化学物質トリエチレングリコール(TEG、97%、HEOWNS)、PEG-400(Mn ∼ 400、TCI)、PEG-1000(Mn ∼ 1000、Jiangsu Haitian Petrochemical Works)。 PEG-2000(Mn ∼ 2000、SCRC)、PEG-4000(Mn ∼ 4000、SCRC)、ポリエチレングリコールメチルエーテルアクリレート480(mPEGA-480。 Mn ∼ 480、Sigma-Aldrich)、ポリ(エチレングリコール)メチルエーテルメタクリレート500(mPEGMA-500、Mn ∼ 500、Sigma-Aldrich)およびポリ(エチレングリコール)メチルエーテルメタクリレート950(mPEGMA-950、Mn ∼ 950、Sigma-Aldrich)はさらに精製せずに直接使用された。
ヒト子宮頸癌細胞(HeLa)およびマウス由来の線維芽細胞の細胞株(L929)は、American type culture collection(ATCC)から入手した。 ダルベッコ改変イーグル培地(DMEM、コーニング-セルグロ)、リン酸緩衝生理食塩水(PBS、pH ∼ 7.2-7.4, 0.01 M、ソーラーバイオ)、牛胎児血清(FBS、ギブコ)、ロスウェルパーク記念研究所1640培養液(RPMI1640培養液、ギブコ)、ペニシリン-ストレプトマイシン溶液(ギブコ)、トリプシン-EDTA(ギブコ、0.25%)、4-(3-(2-メトキシ-4-ニトロフェニル)-2-(4-ニトロフェニル)-2H-テトラゾール-3-イウム-5-イル)ベンゼン-1,3-ジスルホン酸(CCK-8、Beyotime)、2,7-ジクロロジフルオレセインジアセテート(DCFH-DA、Beyotime)、酸化型グルタチオン(GSSG、Beyotime)。 ニコチンアミドアデニンジヌクレオチドリン酸(NADPH、Beyotime)、5,5′-ジチオビス-(2-ニトロ安息香酸)(DTNB、Beyotime)、フルオレセインジアセテート(FDA、Sigma)およびヨウ化プロピジウム(PI、94%、Sigma)は購入時のものを使用した。
2.2 細胞培養
細胞培養は、5% CO2を含む37℃のインキュベーターで維持し、細胞の指数関数的成長を維持するために1〜2日ごとに培養液を取り替えた。 HeLa細胞は子宮頸がん細胞由来で、10%牛胎児血清(FBS)、1%ペニシリンおよびストレプトマイシンを添加したDMEM培地で培養した。 2.3 細胞毒性解析
結果は平均値±標準偏差(SD)で示し、PEG誘導体の半値最大阻害濃度50%(IC50)値はSPSS 15.0により算出した。
我々の以前の研究32、33によれば、fluorescein diacetate(FDA)とpropidium iodide(PI)は細胞の生存率を観察するのに迅速かつ便利な二重染色法として使用できた。 L929細胞は、24ウェルプレートに約5×104個/mLとなるように播種した。 付着後、細胞をPBSで洗浄し、異なる濃度のPEG誘導体を培養液に添加し24時間培養した。 続いてPBS-FDA-PI混合溶液(FDA:3μg mL-1;PI:3μg mL-1)を加え、24ウェルプレートを37℃、15分間インキュベートした。 蛍光顕微鏡(Leica Germany)を用い、450-490nmおよび515-560nmのバンドパス励起フィルター(I3およびN2.1)下で生細胞および死細胞をそれぞれ観察した(100W水銀灯)
 000 rpm、10分間)して細胞上清の試料を得た。 A1〜A6ウェルのサンプルを用いて、総グルタチオン(GSH+GSSG)レベルを測定した。 NADPH溶液(0.5 mg mL-1)を加えてグルタチオンをすべてGSHに還元し、5,5′-ジチオビス-(2-ニトロ安息香酸)(DTNB)を用いてGSHを酸化し、405 nmでの吸光度の変化をマイクロプレートリーダー(VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader)によって記録した。35,36 A′1-A′6 ウェルからのサンプルは、酸化グルタチオン(GSSG)レベルの測定に使用された。 GSH 除去液を使用することで、試料溶液には GSSG のみが残される。 試料を上記と同様の方法で分析し、GSSGの濃度を測定した。 総グルタチオン量と酸化グルタチオン量を測定し、還元グルタチオン量を算出し、コントロールとして純粋培養液中の細胞のGSH量を用いた。 結果は平均値±SDで示した。
000 rpm、10分間)して細胞上清の試料を得た。 A1〜A6ウェルのサンプルを用いて、総グルタチオン(GSH+GSSG)レベルを測定した。 NADPH溶液(0.5 mg mL-1)を加えてグルタチオンをすべてGSHに還元し、5,5′-ジチオビス-(2-ニトロ安息香酸)(DTNB)を用いてGSHを酸化し、405 nmでの吸光度の変化をマイクロプレートリーダー(VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader)によって記録した。35,36 A′1-A′6 ウェルからのサンプルは、酸化グルタチオン(GSSG)レベルの測定に使用された。 GSH 除去液を使用することで、試料溶液には GSSG のみが残される。 試料を上記と同様の方法で分析し、GSSGの濃度を測定した。 総グルタチオン量と酸化グルタチオン量を測定し、還元グルタチオン量を算出し、コントロールとして純粋培養液中の細胞のGSH量を用いた。 結果は平均値±SDで示した。
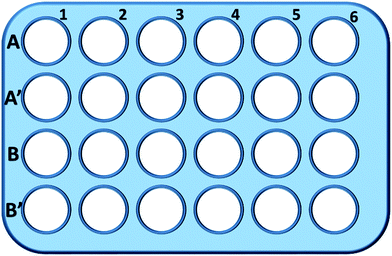
B系統およびB′系統のウェルを用いて、同じ手順により、mPEGA-480の存在下でGSHおよびGSSGの総量についてそれぞれ試験した。
結果および考察
3.1 細胞生存率試験
HeLa細胞(癌細胞のモデル)を用いた場合(図2A)、低濃度(≤5 mgL-1)ではすべてのPEGオリゴマーの細胞毒性を無視することが可能である。 濃度の上昇に伴い(≧10 mg mL-1)、PEGサンプルの分子量依存的な細胞毒性が観察された。 トリエチレングリコール(TEG)は10 mg mL-1以上で明らかな細胞毒性を示し(p < 0.05; 5 mg mL-1以上では他のオリゴマーと対照),HeLa細胞に対するTEGのIC50値は19.8 mg mL-1と算出された。 一方、他のPEGオリゴマー(Mn ∼ 400-4000)でも小さな細胞毒性を示した。
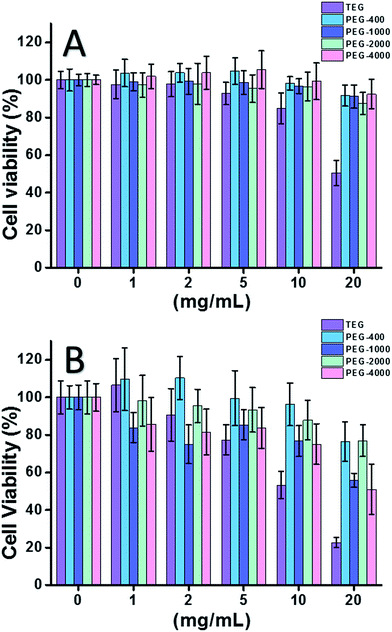
L929細胞(正常細胞のモデル)に対するPEGオリゴマーの細胞毒性も評価した(Fig.2B)。 細胞生存率は、予想通りPEG濃度の増加とともに低下した。 TEGの他に、HeLa細胞に対して安全ないくつかのPEGオリゴマー(PEG-1000、PEG-4000)も検出可能な細胞毒性を示し、TEG、PEG-1000、PEG-4000のL929細胞に対するIC50値は、それぞれ12.4, 22.5, 20.0 mg mL-1と算出されており、PEGオリゴマーの分子量依存性細胞毒性を示すことも明らかにした。
以上の結果から、HeLa細胞は癌細胞の生命力の強さからL929細胞よりもPEGオリゴマーに対する耐性が高く、TEGは他の分子量の高いPEGオリゴマーよりもはるかに高い細胞毒性を持つことが示唆された(p < 0.05; 5 mgL-1を超えた場合は他のオリゴマーとの対比)。 PEG-1000とPEG-4000のL929細胞に対する細胞毒性は中程度であり、PEG-400とPEG-2000の細胞毒性はほとんどないことが今回の研究で明らかになった。 PEGの細胞毒性の理由はまだ明らかではないが、PEG-400とPEG-2000は生体適合性材料を合成する人々にとってより良い選択肢であると思われる。
mPEGMA-500を試験したところ、HeLa細胞、L929細胞ともにmPEGMA-500の濃度上昇とともに細胞生存率が低下し(図3A)、2種類の細胞の間に明らかな差は認められなかった。 24時間培養後のmPEGMA-500のIC50値は,HeLa細胞に対して4.7 mg mL-1,L929細胞に対して5.3 mg mL-1であり,上記のPEGオリゴマーよりもmPEGMA-500の細胞毒性が顕著であり,PEG誘導体の鎖端基がその毒性に重要であると示唆される。 同じ鎖末端を持ち、より高分子量のmPEGMA-950を同じ手順で試験したところ(図3B)、HeLa細胞やL929細胞に対するmPEGMA-950の細胞毒性がはるかに低く、(p < 0.05; 2 mgL-1を超える場合)mPEGMA-950のIC50値はHeLa細胞に対して20.8 mg mL-1, そして21.7 mgL-1であり、PEGメタクリル酸の分子量依存的な細胞毒性を示している。 3 mPEGMA-500 (A), mPEGMA-950 (B) およびmPEGA-480 (C and D) のHeLa細胞およびL929細胞に対する濃度依存性細胞毒性,mPEGMAの濃度は1〜20 mg mL-1,mPEGAの濃度は0.1〜20 mg mL-1である. PEG系モノマーを含まない細胞をポジティブコントロールとし、細胞を含まないものをネガティブコントロールとした。
さらに、PEG系アクリレートmPEGA-480もテストされた。 mPEGA-480とmPEGMA-500の違いは鎖末端のメチル基だけであるが、mPEGA-480は急性の細胞毒性を示した(図3C)。 1 mg mL-1 mPEGA-480を培養液に入れただけでも95%以上の細胞が生存能力を失った。 したがって、その細胞毒性を決定するためには、さらに低濃度で実験を行う必要がある(Fig. 3D)。24時間培養後のmPEGA-480のIC50値は、HeLa細胞に対して0.2 mg mL-1、L929細胞に対して0.1 mg mL-1と算出された。
細胞生存率実験から、鎖末端基と分子量の両方がPEG誘導体の細胞毒性に重要な影響要素であり、PEGベースのモノマーはPEGオリゴマーと比較してはるかに顕著な細胞毒性を示すことが確認された。
一方、PEG系モノマーに含まれる阻害剤、ハイドロキノンメチルエーテル(MEHQ、mPEGA中100ppm)およびブチルヒドロキシトルエン(BHT、mPEGMA中300ppm)の細胞毒性も評価し(図4)、L929細胞は低濃度の阻害剤(≤1 μg mL-1)で高い生存率(≥90%)を維持した。 mPEGA-480 1 mg mL-1中にMEHQ 0.1 μg mL-1、mPEGA-500 10 mg mL-1中にBHT 3 μg mL-1が存在し、mPEG-480とmPEGMA-500はその濃度で明らかな細胞毒性を示した。 このように、PEG系モノマーに含まれる微量の阻害剤は、モノマーの細胞毒性にほとんど影響を与えないようであった。tif
3.2 細胞形態観察
L929細胞に対するPEG誘導体の細胞毒性を直接評価するために、光学顕微鏡観察を行った。 20 mg mL-1 TEGおよび0.1 mg mL-1 mPEGAに24時間暴露したL929細胞の光学像をそれぞれ図5AおよびBに示した。
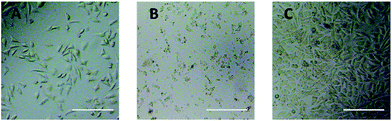
20 mg mL-1 TEGで24時間培養した後、細胞は対照群(図5C、純粋培養液中の細胞)と同様の形態を保ったが(図5A)、細胞数は劇的に減少した。これは高濃度のTEGによる細胞毒性があり、細胞は死んでマイクロプレートの底部から続いて剥離したことを示したものだ。 Fig. 5Bは、0.1 mg mL-1 mPEGA-480とインキュベートした後のL929細胞の形態を示している。 ほぼすべての細胞が正常な形態を失っており、このような低濃度であってもmPEGA-480の急性細胞毒性を示唆している。
さらに、細胞はフルオレセインを用いて染色した。 FDA/PI二重染色は、生細胞と死細胞を観察するための迅速、簡便かつ同時の手順である。43 FDAは完全な細胞に入り込んで細胞内に蓄積することができるので、細胞からのフルオレセインの漏出を防ぐためには、完全な細胞膜が必要である。 一方,PIは無傷の細胞膜を通過することはできないが,損傷した細胞膜を通過することにより死細胞の核を染色することができる。 Fig. 6 が示すように、20 mg mL-1 TEG とインキュベートした L929 細胞は、FDA 染色後、コントロール(Fig. 6a)に比べて生存細胞が減少し(Fig. 6b)、PI 染色後はより多くの死細胞が観察された(Fig. mPEG-480の急性細胞毒性は、FDA/PI二重染色後にも観察され、0.1 mg mL-1 mPEG-480と24時間インキュベートした後、緑色のシグナルは確認されなかった(Fig.6cとc′)。
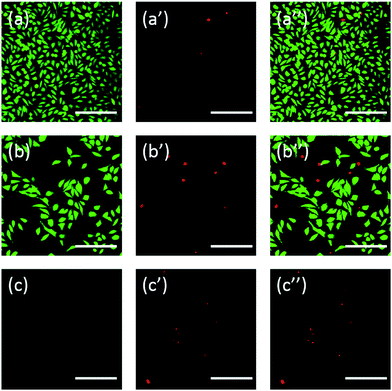
光学および蛍光画像の両方が、それらのPEG誘導体の細胞毒性を直感的に示し、CCK-8アッセイを通して得られた結論をさらに支持した。 これは、FDA/PI二重染色が細胞膜の生死を区別するのに対し、CCK-8アッセイはミトコンドリア内の脱水素酵素の活性を検出することに起因しており、細胞の状態をより詳細に把握するためにFDA/PI染色がCCK-8アッセイの優れた補助となることが示唆されました。
3.3 メカニズム研究
細胞生存率実験によると、24時間培養後のHeLaとL929細胞に対するPEGオリゴマーとPEGベースモノマーのIC50値を計算し、まとめた(表1)。PEGベースモノマーはPEGオリゴマーより細胞への毒性が高く、mPEGAが最も細胞毒性があることが示唆された。 そこで、細胞毒性の2つの主要なメカニズムである活性酸素の生成と細胞内のGSHの減少を分析し、細胞毒性の原因と考えられるものを探った。
| PEG-400 | PEG-1000 | PEG-
| TEG |
PEG-400 |
PEG-1000 |
PEG- |
TEG- |
PEG-4000 |
mPEGMA-500 |
mPEGMA-950 |
mPEGA-480 |
|
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ヘラ細胞 | 32.5 | 36.2 | 38.2 | 29.6 | 4.7 | 20.8 | 0.2 | ||||||
| L929 cells | 12.4 | 24.0 | 3.0 | 3.0 | 3.0 | 3.2 | 3.0 | 22.5 | 28.7 | 20.0 | 5.3 | 21.7 | 0.1 |
L929細胞をTEGとインキュベートし、異なる時点(0, 0.5, 1.0, 1.5, 2 h)での活性酸素レベルを我々の過去の報告に従って検出し、図7に示すように、それぞれのROSレベルは、TEGによって誘導された。 一例として、異なる濃度のTEGと2時間インキュベートした後の活性酸素レベルをFig.7Aに示した。 図2Bの細胞生存率実験の結果と一致し、TEG濃度が低いと(≦2 mg mL-1)活性酸素レベルは安定しているが、TEG濃度が2 mg mL-1より高くなると有意に増加することが明らかである。 同様に、異なる時点の活性酸素レベル対TEG濃度の図を描き、統合して3Dマップを得た(Fig.7B)。 最大活性酸素レベルは、20 mg mL-1 TEGで2時間後に見つかり、コントロール(活性酸素レベル=100)よりも約400%増加した活性酸素レベルが検出され、最も明るい蛍光強度となった。 これらの結果は、ROSの生成がTEGの細胞毒性のメカニズムの可能性を示唆し、TEGによって誘導された高レベルのROSが細胞アポトーシスの主な理由である可能性を示している。
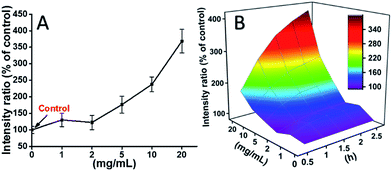
Fig. 7 L929 cells from the hydrolysis of DCFH-DA after incubation with the TEG, two h and for multiple time (B)ROS Generation of the TEG, inc.
2時間後のmPEGA-480によって誘導される活性酸素レベルも試験した(Fig.8A)。 TEGとは異なり、mPEGAは細胞内の活性酸素の急激な増加を引き起こさず、コントロールと比較して最大で約170%の活性酸素の増加が観察されたのみであった。 3DのROSレベル対mPEGA & 時間(図8B)は、mPEGA-480によって誘導されたROSレベルを波として示し、中程度の濃度のmPEGA(5 mg mL-1)で頂上が現れ、ROSの著しい発生は観察できないことから、ROSの発生はmPEGA-480の細胞傷害性に一部しか寄与しない可能性があることが示唆された。
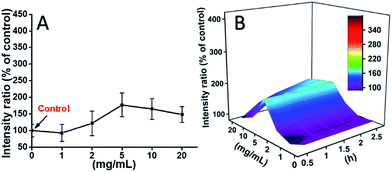
Fig. 8 L929 cells from ROS Generation of DCFH-DA by the hydrolysis after incubation with mPEGA-480 for 2 h (A) and for multiple time (B).
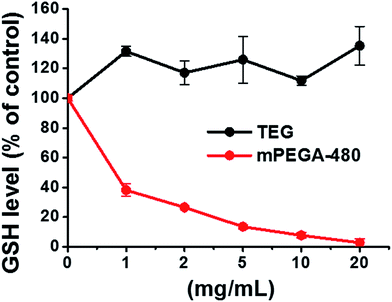
GSHの還元性チオール基は生物において重要な抗酸化源である。 mPEGA-480の細胞毒性は、チオール基とビニル結合のマイケル付加反応に起因すると考えられ、細胞内の酸化還元平衡が崩れ、アポトーシスを引き起こすと考えられている。 チオールとアクリレート間のマイケル付加反応はチオールとメタクリレート間のマイケル付加反応よりも速いことがこれまでの研究で示唆されており52,mPEGA-480とmPEGMA-500の急性細胞毒性が異なる妥当な理由であると考えられる。 PEGオリゴマーおよびPEGベースモノマーの濃度依存的な細胞毒性を確認し、HeLa細胞およびL929細胞に対するIC50値として示した。 PEG-400, PEG-2000は今回の研究ではほとんど細胞毒性がないようである。 PEG-1000, PEG-4000, mPEGMA-950は,特に高濃度では中程度の細胞毒性を示した. TEGとmPEGMA-500は顕著な細胞毒性を示し、mPEGA-480は急性細胞毒性を示した。 さらに,細胞の種類も細胞毒性試験の結果に影響を与え,HeLa細胞はL929細胞よりもPEG誘導体に対する耐性が高いことがわかった。 PEG誘導体の細胞毒性に関するこれらの結果は予備的なものであるが、将来の生物医学的応用のための基礎的なものであり、他のPEG誘導体に対する細胞の反応や挙動に関するより多くの情報がさらに調査されるであろう。
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein and G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan and J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper and M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J.A.エリクソン, J. C. オースティン, C. S. クーパー, M. A. ボイト, J. Urol. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang and D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun and H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris and R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese and G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley and J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese、Biomaterials、2001、22、405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill and W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y.の項参照。 Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner and W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann and A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li and Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y.L.チャン、L. タオ、S. X. リ、Y. ウェイ、バイオマクロモレキュールズ、2011, 12, 2894-2901 L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao and Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng and Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S.。 Dhar, F. X. Gu, R. Langer, O. C. Farokhzad and S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan and D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li and Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao and Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo and H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka and H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H.を参照。 Hussain, K. Y. Mya and C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander and P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F.Magnusson、S. Bersani、S. Salmaso、C. Alexander、P. Caliceti, 2010, 21, 671-678 CrossRef CAS PubMed. J. Xu, Y. L. Li, E. T. Kang and K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao and K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh and E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu and W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth、C. P. Carpenter、C. S. Weil、J. Am. Pharm. Assoc.、1950、39、349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter and C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E.プレンティス、S.K.マジェド、Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. 冨永昌敬,石山茂樹,大瀬戸史朗,笹本晃一,浜本哲也,鈴木健一,渡辺正昭,Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei and X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B.の項参照。 Yang, Y. Zhang, X. Zhang, L. Tao, S. Li and Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang and J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller and C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode and S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown and A. D’Emanuele、Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta and S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han and W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C.M.サルツマン(M. Saltzman, 2002). W. Chang, E. Bays, L. Tao, S. N. S. Alconcel and H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake and L. Meagher, Adv. Drug Delivery Rev.、2015、91、141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang and P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H.ジョーンズ、J.A.センフト、J.Histochem. Cytochem.、1985、33、77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim and I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka and M. Cruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu and H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li and J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim and M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate and H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch and W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr、C. Brandenberger、K. Fischer、L. Diener、P. Manser、X. Maeder-Althaus、J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser and P. Wick, Toxicol. また、このような研究成果をもとに、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」、「環境負荷低減のための研究開発」を実施しています。 Chem., 2010, 1, 1196-1204 RSC.
.
