De gangbare lange vorm van het periodiek systeem is ontworpen om de elektronenconfiguraties te benadrukken. Aangezien het de buitenste (valentie) elektronen zijn die hoofdzakelijk betrokken zijn bij chemische interacties tussen atomen, is het laatste elektron dat in het opbouwproces aan een atoom wordt toegevoegd van veel meer belang voor een chemicus dan het eerste. Dit laatste elektron wordt het onderscheidende elektron genoemd, omdat het een atoom onderscheidt van het atoom dat er onmiddellijk aan voorafgaat in het periodiek systeem. Het type subshell (s, p, d, f) waarin het onderscheidende elektron wordt geplaatst, houdt nauw verband met het chemische gedrag van een element en geeft aanleiding tot de classificatie die wordt weergegeven door de kleurcodering op het periodiek systeem dat hier wordt afgebeeld. De representatieve elementen zijn die waarin het onderscheidende elektron in de ans- of p-subschil terechtkomt. De meeste elementen waarvan we de chemie en de valentie tot nu toe hebben besproken, vallen in deze categorie. Veel van de chemische eigenschappen van de representatieve elementen kunnen worden verklaard aan de hand van de Lewis-diagrammen. Dat wil zeggen, de valenties van de representatieve elementen kunnen worden voorspeld op basis van het aantal valentie-elektronen dat zij hebben, of op basis van het aantal elektronen dat zou moeten worden toegevoegd om dezelfde elektronenconfiguratie te krijgen als een atoom van een edelgas. Voor representatieve elementen is het aantal valentie-elektronen gelijk aan het periodieke groepsnummer, en het aantal dat nodig is om de volgende edelgasconfiguratie te bereiken is 8 min het groepsnummer. Dit komt overeen met de valentie regels afgeleid uit het periodiek systeem, en resulteert in formules voor chloriden van de eerste dozijn elementen die de periodieke variatie van valentie vertonen.
| Element | Atomair Gewicht | Waterstofverbindingen | Zuurstofverbindingen | Chloorverbindingen |
|---|---|---|---|---|
| Waterstof | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Gevormd | Gevormd | Gevormd |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Stikstof | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Zuurstof | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Niet gevormd | Niet gevormd | |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
De eerste drie horizontale rijen of perioden in het moderne periodiek systeem bestaan geheel uit representatieve elementen. In de eerste periode bevinden de onderscheidende elektronen voor H en He zich in de 1s subschil. In de tweede periode hebben Li en Be onderscheidende elektronen in de 2s-subschil, en worden elektronen toegevoegd aan de 2p-subschil in de atomen van B tot Ne. In de derde periode wordt de 3s subschil gevuld voor Na en Mg, en daarmee Al, Si, P, S, Cl, en Ar. In het algemeen zal bij de representatieve elementen het onderscheidende elektron zich in een ns- of np-subschil bevinden. De waarde van n, het hoofdkwantumgetal voor het onderscheidende elektron, kan snel worden bepaald door vanaf de top van het periodiek systeem naar beneden te tellen. Bijvoorbeeld, jodium is een representatief element in de vijfde periode. Daarom moet het onderscheidende elektron in de 5s of 5p subschil zitten. Aangezien I aan de rechterkant van de tabel staat, is 5p de juiste keuze.
Wanneer het hoofdkwantumgetal drie of meer is, zijn d-type subschillen ook mogelijk. De overgangselementen of overgangsmetalen zijn die elementen waarvan het onderscheidende elektron zich in een d-opening bevindt. De eerste voorbeelden van overgangsmetalen (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) worden gevonden in de vierde periode, hoewel het onderscheidende elektron in elk geval een 3d elektron is en tot de derde schil behoort. Deze hiaat ontstaat, zoals we reeds hebben gezien, doordat de 4s lager in energie is dan de 3d. De 4s orbitaal begint zich dus te vullen, waardoor de vierde periode begint voordat een van de 3d orbitalen bezet kan raken.
Figuur vergelijkt de kansverdelingen van een 4s en een 3d elektron in een V atoom. Hoewel de 4s elektronenwolk gemiddeld verder van de kern ligt dan de 3d wolk, bevindt een klein deel van de 4s elektronendichtheid zich zeer dicht bij de kern waar het nauwelijks wordt afgeschermd van de totale nucleaire lading van +23. Het is de zeer sterke aantrekkingskracht van deze kleine fractie van de totale 4s elektronendichtheid die de energie van het 4s elektron verlaagt tot onder die van het 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Het feit dat de 4s elektronenwolk omvangrijker is dan de 3d heeft een belangrijke invloed op de chemie van de overgangselementen. Wanneer een atoom zoals V (figuur) in wisselwerking treedt met een ander atoom, zijn het de 4s elektronen die het verst van de kern staan en het eerst in contact komen met het andere atoom. De 4s elektronen zijn dus vaak belangrijker dan de 3d bij het bepalen van de valentie en de formules van verbindingen. De 3d elektronen zijn “begraven” onder de oppervlakken van de atomen van de overgangsmetalen. Het toevoegen van een extra 3d elektron heeft aanzienlijk minder effect op hun chemische eigenschappen dan het toevoegen van een extra 3s of 3p elektron deed in het geval van de representatieve elementen. Er is dus een langzame maar gestage overgang in eigenschappen van het ene overgangselement naar het andere. Merk bijvoorbeeld op dat, behalve voor Sc, alle overgangsmetalen chloriden, MCl2, vormen waarbij het metaal een valentie van 2 heeft; voorbeelden zijn TiCl2, VCl2, CrCl2, enzovoort. Dit is te zien in de tabel bovenaan deze pagina. De valentie 2 komt overeen met de twee 4s valentie-elektronen.
Elk overgangsmetaal vertoont ook andere valenties waarbij een of meer van de 3d elektronen ook betrokken zijn. Zo heeft V (vanadium) in sommige verbindingen een valentie van 2 (VO, VCl2), in andere een valentie van 3 (V2O3, VCl3), in weer andere een valentie van 4 (VO2, VCl4), en in ten minste één geval (V2O5) een valentie van 5. Door deze variabele valentie is de scheikunde van de overgangsmetalen ingewikkelder en is een grotere verscheidenheid van formules voor verbindingen van overgangsmetalen mogelijk. In sommige gevallen fungeren elektronen in de d-deelschalen als valentie-elektronen, in andere gevallen niet. Hoewel de 3d elektronenwolken zich niet verder van de kern uitstrekken dan 3s en 3p (en dus geen andere schil vormen zoals de 4s elektronen doen), zijn ze grondig afgeschermd van de kernlading en fungeren dus vaak als valentie-elektronen. Dit Jekyll en Hyde gedrag van 3d elektronen maakt het leven ingewikkelder (en vaak veel interessanter) voor chemici die de overgangselementen bestuderen.
| Z | Element | Configuratie |
|---|---|---|
| 1 | H | 1s 1 |
| 2 | He | 1s 2 |
| 3 | Li | 2s 1 |
| 4 | Be | 2s 2 |
| 5 | B | 2s 2p1 |
| 6 | C | 2s 2 2p2 |
| 7 | N | 2s 2 2p3 |
| 8 | 0 | 2s 2 2p4 |
| 9 | F | 2s 2 2p5 |
| 10 | Ne | 2s 2 2p6 |
| 11 | Na | 3s 1 |
| 12 | Mg | 3s 2 |
| 13 | Al | 3s 2 3p1 |
| 14 | Si | 3s 2 3p2 |
| 15 | P | 3s 2 3p3 |
| 16 | S | 3s 2 3p4 |
| 17 | Cl | 3s 2 3p5 |
| 18 | Ar | 3s 2 3p6 |
| 19 | K | 4s 1 |
| 20 | Ca | 4s 2 |
| 21 | Sc | 3d 1 4s 2 |
| 22 | Ti | 3d 2 4s 2 |
| 23 | V | 3d 3 4s 2 |
| 24 | Cr | 3d 5 4s 1 |
| 25 | Mn | 3d 5 4s 2 |
| 26 | Fe | 3d 6 4s 2 |
| 27 | Co | 3d 7 4s 2 |
| 28 | Ni | 3d 8 4s 2 |
| 29 | Cu | 3d 10 4s 1 |
| 30 | Zn | 3d 10 4s 2 |
| 31 | Ga | 3d 10 4s 2 4p 1 |
| 32 | Ge | 3d 10 4s 2 4p 2 |
| 33 | As | 3d 10 4s 2 4p 3 |
| 34 | Se | 3d 10 4s 2 4p 4 |
| 35 | Br | 3d 10 4s 2 4p 5 |
| 36 | Kr | 3d 10 4s 2 4p 6 |
| 37 | Rb | 5s 1 |
| 38 | Sr | 5s 2 |
| 39 | Y | 4d 1 5s 2 |
| 40 | Zr | 4d 2 5s 2 |
| 41 | Nb | 4d 4 5s 1 |
| 42 | Mo | 4d 5 5s 1 |
| 43 | Tc | 4d 5 5s 2 |
| 44 | Ru | 4d 7 5s 1 |
| 45 | Rh | 4d 8 5s 1 |
| 46 | Pd | 4d 10 |
| 47 | Ag | 4d 10 5s 1 |
| 48 | Cd | 4d 10 5s 2 |
| 49 | In | 4d 10 5s 2 5p 1 |
| 50 | Sn | 4d 10 5s 2 5p 2 |
| 51 | Sb | 4d 10 5s 2 5p 3 |
| 52 | Te | 4d 10 5s 2 5p 4 |
| 53 | I | 4d 10 5s 2 5p 5 |
| 54 | Xe | 4d 10 5s 2 5p 6 |
| 55 | Cs | 6s 1 |
| 56 | Ba | 6s 2 |
| 57 | La | 5d 1 6s 2 |
| 58 | Ce | 4f 1 5d 1 6s 2 |
| 59 | Pr | 4f 3 6s 2 |
| 60 | Nd | 4f 4 6s 2 |
| 61 | Pm | 4f 5 6s 2 |
| 62 | Sm | 4f 6 6s 2 |
| 63 | Eu | 4f 7 6s 2 |
| 64 | Gd | 4f 7 5d 1 6s 2 |
| 65 | Tb | 4f 9 6s 2 |
| 66 | Dy | 4f 10 6s 2 |
| 67 | Ho | 4f 11 6s 2 |
| 68 | Er | 4f 12 6s 2 |
| 69 | Tm | 4f 13 6s 2 |
| 70 | Yb | 4f 14 6s 2 |
| 71 | Lu | 4f 14 5d 1 6s 2 |
| 72 | Hf | 4f 14 5d 2 6s 2 |
| 73 | Ta | 4f 14 5d 3 6s 2 |
| 74 | W | 4f 14 5d 4 6s 2 |
| 75 | Re | 4f 14 5d 5 6s 2 |
| 76 | 0s | 4f 14 5d 6 6s 2 |
| 77 | Ir | 4f 14 5d 7 6s 2 |
| 78 | Pt | 4f 14 5d 9 6s 1 |
| 79 | Au | 4f 14 5d 10 6s 1 |
| 80 | Hg | 4f 14 5d 10 6s 2 |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 |
| 87 | Fr | 7s 1 |
| 88 | Ra | 7s 2 |
| 89 | Ac | 6d 1 7s 2 |
| 90 | Th | 6d 2 7s 2 |
| 91 | Pa | 5f 2 6d 1 7s 2 |
| 92 | U | 5f 3 6d 1 7s 2 |
| 93 | Np | 5f 4 6d 1 7s 2 |
| 94 | Pu | 5f 6 7s 2 |
| 95 | Am | 5f 7 7s 2 |
| 96 | Cm | 5f 7 6d 1 s 2 |
| 97 | Bk | 5f 9 s 2 |
| 98 | Cf | 5f 10 s 2 |
| 99 | Es | 5f 11 s 2 |
| 100 | Fm | 5f 12 s 2 |
| 101 | Md | 5f 13 s 2 |
| 102 | No | 5f 14 s 2 |
| 103 | Lr | 5f 14 6d 1 s 2 |
| 104 | Rf | 5f 14 6d 2 s 2 |
De derde hoofdcategorie van elementen ontstaat wanneer het onderscheidende elektron een f-subschil bezet. Het eerste voorbeeld doet zich voor bij de lanthanoïden (elementen met atoomnummers tussen 57 en 71).De lanthanoïden hebben de algemene elektronenconfiguratie
4d104f i5s25p65d0 of 16s2
waarbij i een getal tussen 0 en 14 is. In het opbouwproces van de lanthanoïden worden dus elektronen toegevoegd aan een subschil (4f) waarvan het hoofdkwantumgetal twee lager is dan dat van de buitenste orbitaal (6s). Toevoeging van nog een elektron aan een binnenste schil die zo diep begraven is als de 4f heeft weinig of geen effect op de chemische eigenschappen van deze elementen. Zij lijken alle sterk op lanthaan (La) en passen misschien op precies dezelfde plaats in het periodiek systeem als La. De lanthaanelementen lijken zo sterk op elkaar dat speciale technieken nodig zijn om ze te scheiden. Als gevolg daarvan werden zelfs bij benadering zuivere monsters van de meeste van hen pas in de jaren 1870 bereid. Na het element actinium (Ac) volgt een reeks atomen waarin de 5f subschil vullend is. De actinoïden lijken iets minder op Ac dan de lanthanoïden op La omdat er enkele uitzonderingen op de gebruikelijke volgorde van de vulling van de banen voorkomen bij Th, Pa en U (Tabel 1).
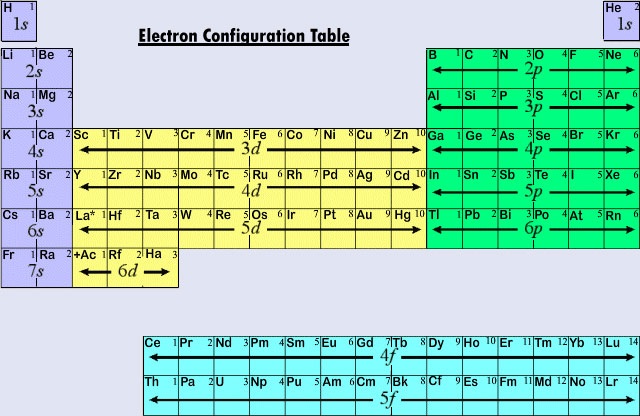
Omdat de lanthanoïden en de meeste actinoïden zich chemisch gedragen alsof ze zouden moeten passen in groep IIIB van het periodiek systeem (waar Lu en Lr worden gevonden), zijn beide groepen gescheiden van de rest van de tabel en samen geplaatst in een blok hieronder. Samen worden de lanthanoïden en actinoïden binnenste overgangselementen genoemd, omdat de gevulde f-subschalen zo diep in de resterende elektronische structuur van hun atomen liggen.
Figuur (Pagina-index{2}) geeft een overzicht van het type subshell waarin het onderscheidende elektron te vinden is voor atomen van elementen in verschillende gebieden van het periodiek systeem. Deze samenvattende informatie maakt het relatief eenvoudig om het periodiek systeem te gebruiken om elektronenconfiguraties te verkrijgen, zoals het volgende voorbeeld laat zien.
Voorbeeld \(\PageIndex{1}\): Elektronenconfiguratie
Ontdek de elektronenconfiguratie voor (a) Nb; (b) Pr.
Oplossing
a) Nb, element nummer 41, bevindt zich in de vijfde periode en in een gebied van het periodiek systeem waar een d-subschil vullend is (de tweede overgangsreeks). Terugkijkend (naar lagere atoomnummers) door het periodiek systeem, is het dichtstbijzijnde edelgas Kr, en dus gebruiken we de Kr-kern:
Nb _____
Het volgende element na 36K is 37Rb, waarin de 5s subschil zich vult. Nog een plaats naar rechts en we komen bij 38Sr dat een 5s2 paar heeft. Tot nu toe hebben we Nb _____ 5s2 voor de Nb-configuratie. We gaan nu nog verder naar rechts in het gebied van de 4d subschil van het periodiek systeem en tellen over drie velden (Y, Zr, Nb) om bij Nb uit te komen. De totale elektronenconfiguratie is dus Nb 4d35s2 (Merk op dat het hoofdkwantumgetal van de d-subschil 4 is – één minder dan het getal van de periode. Als u de tabel met elektronenconfiguraties bekijkt, moet u ook opmerken dat Nb een uitzondering is op de typische regels voor het vullen van banen) b) Een soortgelijke procedure wordt gevolgd voor Pr, element nummer 59. Terugkijkend in de tabel is het dichtstbijzijnde edelgas Xe, en dus gebruiken we de Xe-kern. Als we weer vooruit tellen, komen Cs en Ba overeen met 6s2. Dan corresponderen La, Ce en Pr met nog eens drie elektronen in de 4f-schil. De configuratie is dus Pr…4f36s2
Er moet nog een punt worden benadrukt over de relatie tussen de elektronenconfiguratie en het periodiek systeem. De atomen van elementen in dezelfde verticale kolom van het periodiek systeem hebben vergelijkbare elektronenconfiguraties. Neem bijvoorbeeld de alkali-aardelementen (groep IIA). Met behulp van onze regels voor het afleiden van elektronenconfiguraties (voorbeeld 1) hebben we
| Element | Elektronenconfiguratie | Lewis-diagram |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Dus de gelijkenissen van chemisch gedrag en valentie die eerder voor deze elementen werden opgemerkt, correleren met de gelijkenissen van hun buitenste elektronenwolken. Dergelijke overeenkomsten verklaren het succes van Mendeleevs voorspellingen van de eigenschappen van onontdekte elementen.
Bijdragers en toeschrijvingen
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, en Adam Hahn.
