Learning Objectives
- Describe the components involved in a muscle contractraction
- Explain how muscles samentrekken en ontspannen
- Beschrijf het glijdende filament model van spiercontractie
De opeenvolging van gebeurtenissen die resulteren in de contractie van een individuele spiervezel begint met een signaal – de neurotransmitter, AC, van het motorneuron dat die vezel van zenuwbanen voorziet. Het lokale membraan van de vezel zal depolariseren wanneer positief geladen natriumionen (Na+) binnenkomen, waardoor een actiepotentiaal wordt opgewekt dat zich verspreidt naar de rest van het membraan dat zal depolariseren, met inbegrip van de T-tubuli. Dit veroorzaakt het vrijkomen van calciumionen (Ca++) uit de opslag in het sarcoplasmatisch reticulum (SR). Het Ca++ zet vervolgens de contractie in gang, die door ATP in stand wordt gehouden (figuur 1). Zolang Ca++ -ionen in het sarcoplasma blijven om zich aan troponine te binden, waardoor de actine-bindende sites “onbeschermd” blijven, en zolang ATP beschikbaar is om de cross-bridge cyclus en het trekken van actine-strengen door myosine aan te drijven, zal de spiervezel blijven verkorten tot een anatomische limiet.

Figuur 1. Samentrekking van een spiervezel. Er wordt een kruisbrug gevormd tussen actine en de myosinekoppen, die de contractie in gang zet. Zolang Ca++ -ionen in het sarcoplasma aanwezig blijven om zich aan troponine te binden, en zolang ATP beschikbaar is, zal de spiervezel zich blijven verkorten.
De spiercontractie stopt gewoonlijk wanneer het signaal van het motorneuron ophoudt, waardoor het sarcolemma en de T-tubuli worden gerepolariseerd en de spanningsafhankelijke calciumkanalen in het SR worden gesloten. Ca++ -ionen worden dan teruggepompt in het SR, waardoor tropomyosine de bindingsplaatsen op de actinestrengen opnieuw afschermt (of bedekt). Een spier kan ook stoppen met samentrekken wanneer zijn ATP opraakt en hij vermoeid raakt (figuur 2).

Figuur 2. Ontspanning van een spiervezel. Ca++ -ionen worden teruggepompt in de SR, waardoor tropomyosine de bindingsplaatsen op de actinestrengen weer afschermt. Een spier kan ook stoppen met samentrekken wanneer zijn ATP opraakt en vermoeid raakt.
De moleculaire gebeurtenissen van spiervezelverkorting vinden plaats binnen de sarcomeren van de vezel (zie figuur 3). De contractie van een gestreepte spiervezel vindt plaats als de sarcomeren, lineair gerangschikt binnen myofibrillen, verkorten doordat myosinekoppen aan de actinefilamenten trekken.
Het gebied waar dikke en dunne filamenten elkaar overlappen ziet er dicht uit, omdat er weinig ruimte tussen de filamenten is. Dit gebied waar dunne en dikke filamenten elkaar overlappen is zeer belangrijk voor de spiercontractie, omdat het de plaats is waar de filamentbeweging begint. Dunne filamenten, die aan hun uiteinden verankerd zijn door de Z-schijven, strekken zich niet volledig uit in het centrale gebied dat alleen dikke filamenten bevat, die aan hun basis verankerd zijn op een plaats die de M-lijn wordt genoemd. Een myofibril bestaat uit vele sarcomeren die over de gehele lengte lopen; dus trekken myofibrillen en spiercellen samen als de sarcomeren samentrekken.
The Sliding Filament Model of Contraction
Wanneer een motorneuron een signaal geeft, trekt een skeletspiervezel samen doordat de dunne filamenten worden aangetrokken en dan langs de dikke filamenten binnen de sarcomeren van de vezel schuiven. Dit proces staat bekend als het glijdende gloeidraadmodel van spiercontractie (figuur 3). Het glijden kan alleen plaatsvinden wanneer myosine-bindende plaatsen op de actinefilamenten worden blootgelegd door een reeks stappen die begint met Ca++ toegang tot het sarcoplasma.

Figuur 3. Het glijdende filamentmodel van spiercontractie. Wanneer een sarcomeer samentrekt, schuiven de Z-lijnen dichter naar elkaar toe en wordt de I-band kleiner. De A band blijft even breed. Bij volledige contractie overlappen de dunne en dikke filamenten elkaar.
Tropomyosine is een eiwit dat zich rond de ketens van het actine filament wikkelt en de myosine-bindende plaatsen bedekt om te voorkomen dat actine aan myosine bindt. Tropomyosine bindt zich aan troponine om een troponine-tropomyosine complex te vormen. Het troponine-tropomyosine complex voorkomt dat de myosine “koppen” zich binden aan de actieve plaatsen op de actine microfilamenten. Troponine heeft ook een bindingsplaats voor Ca++ ionen.
Om spiercontractie op gang te brengen moet tropomyosine de myosine-bindingsplaats op een actinefilament blootleggen om de vorming van een cross-bridge tussen de actine- en myosine-microfilamenten mogelijk te maken. De eerste stap in het contractieproces is dat Ca++ zich aan troponine bindt, zodat tropomyosine weg kan glijden van de bindingsplaatsen op de actinestrengen. Hierdoor kunnen de myosinekoppen zich binden aan deze blootliggende bindingsplaatsen en cross-bruggen vormen. De dunne filamenten worden dan door de myosinekoppen aangetrokken om langs de dikke filamenten naar het centrum van het sarcomeer te glijden. Maar elke kop kan slechts een zeer korte afstand trekken voordat hij zijn limiet heeft bereikt en moet worden “teruggekoppeld” voordat hij weer kan trekken, een stap waarvoor ATP nodig is.
ATP en spiercontractie
Om dunne filamenten tijdens de spiercontractie langs dikke filamenten te laten glijden, moeten myosinekoppen aan de actine op de bindingsplaatsen trekken, zich losmaken, zich weer vastklikken, zich aan meer bindingsplaatsen vastmaken, trekken, zich losmaken, zich weer vastklikken, enzovoort. Deze herhaalde beweging staat bekend als de cross-bridge cyclus. Deze beweging van de myosinekoppen is vergelijkbaar met de roeispanen wanneer iemand een boot roeit: De peddel van de roeispanen (de myosinekoppen) trekken, worden uit het water getild (losmaken), weer in positie gebracht (opnieuw vastmaken) en vervolgens weer ondergedompeld om te trekken (figuur 4). Elke cyclus vergt energie, en de actie van de myosinekoppen in de sarcomeren die herhaaldelijk aan de dunne filamenten trekken vergt ook energie, die wordt geleverd door ATP.
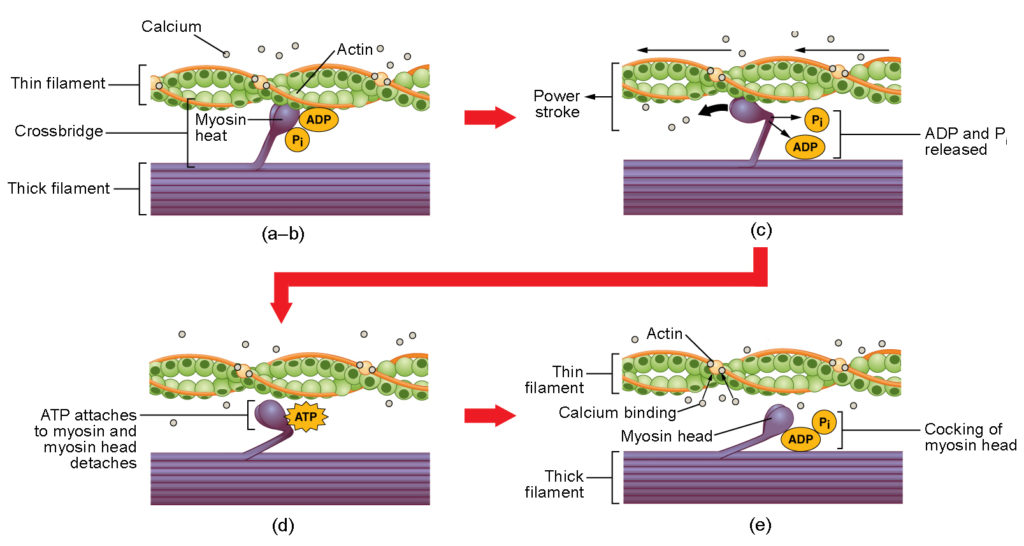
Figuur 4. Samentrekking van skeletspieren. (a) De actieve plaats op actine komt bloot te liggen wanneer calcium zich aan troponine bindt. (b) De myosinekop wordt aangetrokken door actine, en myosine bindt actine op zijn actinebindende plaats, waardoor de overbrugging wordt gevormd. (c) Tijdens de krachtstoot komt het fosfaat vrij dat in de vorige contractiecyclus is gegenereerd. Hierdoor draait de myosinekop naar het midden van het sarcomeer, waarna het aangekoppelde ADP en de fosfaatgroep worden vrijgemaakt. (d) Een nieuw ATP-molecuul hecht zich aan de myosinekop, waardoor de cross-brug loskomt. (e) De myosinekop hydrolyseert ATP tot ADP en fosfaat, waardoor de myosine weer in de gespannen positie komt te staan.
Kruisbrugvorming treedt op wanneer de myosinekop zich aan de actine hecht terwijl adenosinedifosfaat (ADP) en anorganisch fosfaat (Pi) nog aan myosine gebonden zijn (figuur 4a,b). Pi komt dan vrij, waardoor myosine zich sterker aan het actine hecht, waarna de myosinekop naar de M-lijn beweegt en het actine met zich meetrekt. Terwijl actine wordt meegetrokken, bewegen de filamenten ongeveer 10 nm in de richting van de M-lijn. Deze beweging wordt de krachtslag genoemd, omdat bij deze stap beweging van de dunne filamenten optreedt (figuur 4c). In afwezigheid van ATP komt de myosinekop niet los van actine.
Een deel van de myosinekop hecht zich aan de bindingsplaats op de actine, maar de kop heeft nog een bindingsplaats voor ATP. ATP-binding zorgt ervoor dat de myosinekop loskomt van de actine (figuur 4d). Hierna wordt ATP door de intrinsieke ATPase-activiteit van myosine omgezet in ADP en Pi. De energie die vrijkomt bij de ATP-hydrolyse verandert de hoek van de myosinekop in een scheve positie (figuur 4e). De myosinekop is nu in positie voor verdere beweging.
Wanneer de myosinekop scheef staat, bevindt myosine zich in een hoogenergetische configuratie. Deze energie wordt verbruikt als de myosinekop door de krachtslag beweegt, en aan het eind van de krachtslag bevindt de myosinekop zich in een laagenergetische positie. Na de energieslag komt ADP vrij, maar de gevormde kruisbrug is nog op zijn plaats en actine en myosine zijn aan elkaar gebonden. Zolang ATP beschikbaar is, hecht het zich gemakkelijk aan myosine, kan de cross-bridge cyclus zich herhalen, en kan de spiercontractie doorgaan.
Merk op dat elk dik filament van ruwweg 300 myosinemoleculen meerdere myosinekoppen heeft, en dat vele cross-bridges zich voortdurend vormen en breken tijdens de spiercontractie. Vermenigvuldig dit met alle sarcomeren in één myofibril, alle myofibrillen in één spiervezel, en alle spiervezels in één skeletspier, en u kunt begrijpen waarom er zoveel energie (ATP) nodig is om skeletspieren aan de gang te houden. In feite is het het verlies van ATP dat resulteert in de rigor mortis die kort na iemands dood wordt waargenomen. Zonder verdere ATP-productie is er geen ATP beschikbaar voor myosinekoppen om zich los te maken van de actine-bindende plaatsen, zodat de cross-bruggen op hun plaats blijven, wat de stijfheid in de skeletspieren veroorzaakt.
Bronnen van ATP
ATP levert de energie voor de spiercontractie om plaats te vinden. Naast zijn directe rol in de cross-bridge cyclus, levert ATP ook de energie voor de actief-transport Ca++ pompen in de SR. Spiercontractie vindt niet plaats zonder voldoende hoeveelheden ATP. De hoeveelheid ATP die in de spier is opgeslagen is zeer gering, slechts voldoende om een paar seconden samentrekkingen te bewerkstelligen. Aangezien ATP wordt afgebroken, moet het snel worden geregenereerd en vervangen om een aanhoudende contractie mogelijk te maken. Er zijn drie mechanismen waarmee ATP kan worden geregenereerd: het creatinefosfaatmetabolisme, anaërobe glycolyse, fermentatie en aërobe ademhaling.
Creatinefosfaat is een molecuul dat energie kan opslaan in zijn fosfaatbindingen. In een spier in rust brengt een teveel aan ATP zijn energie over op creatine, waarbij ADP en creatinefosfaat ontstaan. Dit fungeert als een energiereserve die kan worden gebruikt om snel meer ATP te creëren. Wanneer de spier begint samen te trekken en energie nodig heeft, draagt creatinefosfaat zijn fosfaat weer over aan ADP om ATP en creatine te vormen. Deze reactie wordt gekatalyseerd door het enzym creatinekinase en vindt zeer snel plaats; zo wordt ATP uit creatinefosfaat de eerste paar seconden van de spiercontractie gevoed. Creatinefosfaat kan echter slechts ongeveer 15 seconden energie leveren, waarna een andere energiebron moet worden gebruikt (figuur 5).

Figuur 5. Spiermetabolisme. In een spier in rust wordt wat ATP opgeslagen. Wanneer de contractie begint, wordt dit in enkele seconden opgebruikt. Gedurende ongeveer 15 seconden wordt meer ATP gegenereerd uit creatinefosfaat.
Als het door creatinefosfaat geproduceerde ATP op is, wenden de spieren zich tot de glycolyse als ATP-bron. Glycolyse is een anaëroob (niet-zuurstof-afhankelijk) proces dat glucose (suiker) afbreekt om ATP te produceren; glycolyse kan echter niet zo snel ATP genereren als creatinefosfaat. De overschakeling op glycolyse resulteert dus in een tragere beschikbaarheid van ATP voor de spier. De suiker die in de glycolyse wordt gebruikt, kan worden geleverd door bloedglucose of door metabolisatie van glycogeen dat in de spier is opgeslagen. De afbraak van één glucosemolecuul levert twee ATP op en twee moleculen pyrodruivenzuur, die kunnen worden gebruikt in de aërobe ademhaling of, wanneer het zuurstofgehalte laag is, kunnen worden omgezet in melkzuur (figuur 6).

Figuur 6. Glycolyse en aërobe ademhaling. Elke glucosemolecule produceert twee ATP en twee moleculen pyrodruivenzuur, dat kan worden gebruikt in aërobe ademhaling of kan worden omgezet in melkzuur. Als er geen zuurstof beschikbaar is, wordt pyrodruivenzuur omgezet in melkzuur, wat kan bijdragen tot spiervermoeidheid. Dit gebeurt tijdens zware inspanningen wanneer grote hoeveelheden energie nodig zijn, maar zuurstof niet voldoende aan de spieren kan worden geleverd.
Als zuurstof beschikbaar is, wordt pyrodruivenzuur gebruikt bij de aërobe ademhaling. Is er echter geen zuurstof beschikbaar, dan wordt pyrodruivenzuur omgezet in melkzuur, dat tot spiervermoeidheid kan bijdragen. Deze omzetting maakt de recycling mogelijk van het enzym NAD+ uit NADH, dat nodig is om de glycolyse voort te zetten. Dit gebeurt tijdens zware inspanning wanneer grote hoeveelheden energie nodig zijn, maar zuurstof niet voldoende aan de spieren kan worden geleverd. Glycolyse zelf kan niet erg lang worden volgehouden (ongeveer 1 minuut spieractiviteit), maar is nuttig bij het vergemakkelijken van korte uitbarstingen van hoge intensiteit. Dit komt omdat glycolyse glucose niet erg efficiënt gebruikt, en een netto winst van twee ATP’s per molecuul glucose produceert, en het eindproduct melkzuur, dat kan bijdragen aan spiervermoeidheid als het zich ophoopt.
Aerobe ademhaling is de afbraak van glucose of andere voedingsstoffen in de aanwezigheid van zuurstof (O2) om kooldioxide, water en ATP te produceren. Ongeveer 95 procent van het ATP dat nodig is voor rustende of matig actieve spieren wordt geleverd door aërobe ademhaling, die plaatsvindt in mitochondriën. De input voor aërobe ademhaling bestaat uit glucose dat in de bloedbaan circuleert, pyrodruivenzuur en vetzuren. Aërobe ademhaling is veel efficiënter dan anaërobe glycolyse: per glucosemolecuul worden ongeveer 36 ATP’s geproduceerd, tegen vier bij glycolyse. Aërobe ademhaling kan echter niet worden volgehouden zonder een gestage toevoer van O2 naar de skeletspier en verloopt veel trager (figuur 7). Ter compensatie slaan de spieren een kleine hoeveelheid overtollige zuurstof op in eiwitten die myoglobine worden genoemd, waardoor de spiersamentrekkingen efficiënter verlopen en er minder vermoeidheid optreedt. Aërobe training verhoogt ook de efficiëntie van de bloedsomloop, zodat de spieren langer van O2 kunnen worden voorzien.

Figuur 7. Cellulaire ademhaling. Aërobe ademhaling is de afbraak van glucose in aanwezigheid van zuurstof (O2) om kooldioxide, water en ATP te produceren. Ongeveer 95 procent van het ATP dat nodig is voor spieren in rust of matig actieve spieren wordt geleverd door aërobe ademhaling, die plaatsvindt in mitochondriën.
Spiervermoeidheid treedt op wanneer een spier niet langer kan samentrekken als reactie op signalen van het zenuwstelsel. De precieze oorzaken van spiervermoeidheid zijn niet volledig bekend, hoewel bepaalde factoren in verband zijn gebracht met de verminderde spiercontractie die bij vermoeidheid optreedt. ATP is nodig voor normale spiercontractie, en wanneer de ATP-voorraden afnemen, kan de spierfunctie afnemen. Dit kan meer een factor zijn bij korte, intense spierinspanningen dan bij langdurige, minder intensieve inspanningen. Ophoping van melkzuur kan de intracellulaire pH verlagen, wat de enzymen- en proteïneactiviteit beïnvloedt. Onbalans in Na+ en K+ niveaus als gevolg van membraan depolarisatie kan de Ca++ stroom uit de SR verstoren. Lange perioden van langdurige inspanning kunnen het SR en het sarcolemma beschadigen, wat resulteert in een verminderde Ca++ -regulatie.
Intense spieractiviteit resulteert in een zuurstofschuld, dat is de hoeveelheid zuurstof die nodig is om te compenseren voor ATP dat zonder zuurstof wordt geproduceerd tijdens de spiercontractie. Zuurstof is nodig om de ATP- en creatinefosfaatniveaus te herstellen, melkzuur om te zetten in pyrodruivenzuur en, in de lever, melkzuur om te zetten in glucose of glycogeen. Andere systemen die tijdens de inspanning worden gebruikt, hebben ook zuurstof nodig, en al deze gecombineerde processen resulteren in de verhoogde ademhalingsfrequentie die na de inspanning optreedt. Totdat de zuurstofschuld is ingelost, blijft de zuurstofopname verhoogd, zelfs nadat de inspanning is gestopt.
Relaxatie van een skeletspier
Relaxatie van skeletspiervezels, en uiteindelijk van de skeletspier, begint met het motorneuron, dat stopt met het vrijgeven van zijn chemische signaal, ACh, in de synaps bij het NMJ. De spiervezel zal repolariseren, wat de poorten in de SR sluit waar Ca++ werd vrijgegeven. Door ATP aangedreven pompen zullen Ca++ uit het sarcoplasma terug in de SR brengen. Dit resulteert in het “reshielding” van de actine-bindende plaatsen op de dunne filamenten. Zonder de mogelijkheid om cross-bridges te vormen tussen de dunne en dikke filamenten, verliest de spiervezel zijn spanning en ontspant hij.
Spiersterkte
Het aantal skeletspiervezels in een bepaalde spier is genetisch bepaald en verandert niet. Spierkracht is direct gerelateerd aan de hoeveelheid myofibrillen en sarcomeren in elke vezel. Factoren, zoals hormonen en stress (en kunstmatige anabole steroïden), die op de spier inwerken, kunnen de productie van sarcomeren en myofibrillen binnen de spiervezels doen toenemen, een verandering die hypertrofie wordt genoemd en die resulteert in de toegenomen massa en omvang van een skeletspier. Op dezelfde manier resulteert een verminderd gebruik van een skeletspier in atrofie, waarbij het aantal sarcomeren en myofibrillen verdwijnt (maar niet het aantal spiervezels). Het is gebruikelijk dat een ledemaat in het gips geatrofieerde spieren vertoont wanneer het gips wordt verwijderd, en bepaalde ziekten, zoals polio, vertonen geatrofieerde spieren.
Stoornissen van het spierstelsel
Duchenne spierdystrofie (DMD) is een progressieve verzwakking van de skeletspieren. Het is een van de ziekten die worden aangeduid met de verzamelnaam “spierdystrofie”. DMD wordt veroorzaakt door een gebrek aan het eiwit dystrofine, dat de dunne filamenten van myofibrillen helpt binden aan het sarcolemma. Zonder voldoende dystrofine zorgen spiercontracties ervoor dat het sarcolemma scheurt, wat een instroom van Ca++ veroorzaakt, wat leidt tot cellulaire schade en afbraak van spiervezels. Na verloop van tijd, wanneer de spierschade zich opstapelt, gaat spiermassa verloren en ontwikkelen zich grotere functionele stoornissen.
DMD is een erfelijke aandoening die wordt veroorzaakt door een abnormaal X-chromosoom. Het treft vooral mannen, en de diagnose wordt meestal in de vroege kinderjaren gesteld. DMD verschijnt meestal eerst als moeilijkheden met evenwicht en beweging, en gaat dan over in onvermogen om te lopen. Het gaat verder omhoog in het lichaam, van de onderste ledematen naar het bovenlichaam, waar het de spieren aantast die verantwoordelijk zijn voor de ademhaling en de bloedsomloop. De ziekte veroorzaakt uiteindelijk de dood door ademhalingsstilstand en de getroffenen worden meestal niet ouder dan 20 jaar.
Omdat DMD wordt veroorzaakt door een mutatie in het gen dat codeert voor dystrofine, werd gedacht dat het inbrengen van gezonde myoblasten in patiënten een effectieve behandeling zou kunnen zijn. Myoblasten zijn de embryonale cellen die verantwoordelijk zijn voor de spierontwikkeling, en idealiter zouden zij gezonde genen dragen die de dystrofine zouden kunnen produceren die nodig is voor normale spiersamentrekking. Deze aanpak is bij mensen tot nu toe weinig succesvol gebleken. Een recente benadering bestaat uit pogingen om de spierproductie van utrofine op te voeren, een eiwit dat lijkt op dystrofine en dat mogelijk de rol van dystrofine kan overnemen en cellulaire schade kan voorkomen.
Zelfcontrolevragen
Doe de onderstaande quiz om te zien of u de samentrekking en ontspanning van spiervezels begrijpt:
