A: AMINO ACIDS
BIOCHEMISTRY – DR. JAKUBOWSKI
Laatste update: 02/27/16
Leerdoelen/doelstellingen voor hoofdstuk 2A: Na de les en deze lezing kunnen de leerlingen
- de lading van aminozuurzijketens bepalen met behulp van de Henderson Hasselbach-vergelijking en de geschatte lading door inspectie bij een gegeven pH
- mechanismen tekenen en producten identificeren voor de reactie van nucleofiele zijketens Lys en Cys met gangbare chemische modificatiemiddelen en dit begrip uitbreiden tot reacties van His.
- mechanismen tekenen voor disulfide-uitwisselingsreacties voor sulfhydryls met gebruikmaking daarvan en oxidatiegetallen om redoxreacties van cysteïne/cystine te verklaren.
A7. Cystine Chemie
Twee cysteine zijketens kunnen covalent op elkaar inwerken in een eiwit om een disulfide te produceren. Net zoals HOOH (waterstofperoxide) meer geoxideerd is dan HOH (O in H2O2 heeft oxidatiegetal 1- terwijl de O in H2O een oxidatiegetal 2- heeft), is RSSR de geoxideerde vorm (S-oxidatiegetal 1-) en RSH de gereduceerde vorm (S-oxidatiegetal 2-) van thiolen. Deze oxidatiegetallen zijn analoog omdat O en S beide in groep 6 van het periodiek systeem zitten en beide elektronegatiever zijn dan C.
Een snel overzicht van redoxreacties en oxidatiegetallen.
Figuur: DISULFIDE – CYSTINE – REACTIES
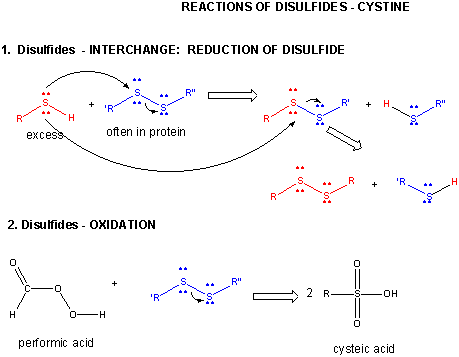
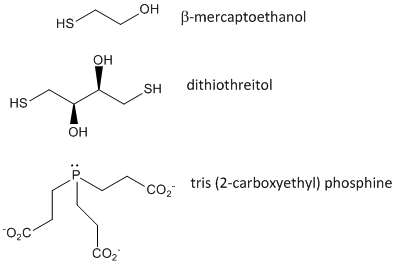
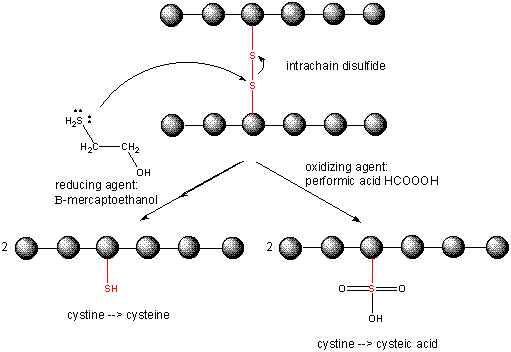
Wanneer een eiwit zich vouwt, kunnen twee Cys-zijketens elkaar naderen en een intrachain-disulfidebinding vormen. Evenzo kunnen twee Cys-zijketens van verschillende eiwitten elkaar naderen en een disulfide tussen de ketens vormen. Dergelijke disulfiden moeten worden gesplitst, en de ketens gescheiden voordat de volgorde van het eiwit wordt geanalyseerd. De disulfide in eiwit kan worden gesplitst door reductiemiddelen zoals beta-mercaptoethanol, dithiothreitol, tris (2-carboxyethyl) fosfine (TCEP) of oxiderende middelen die verder oxideert de disulfide te scheiden cysteïnezuren.
Figuur: Disulfide oxiderende agentia – b-mercaptoethanol, dithiothreitol, en fosfines
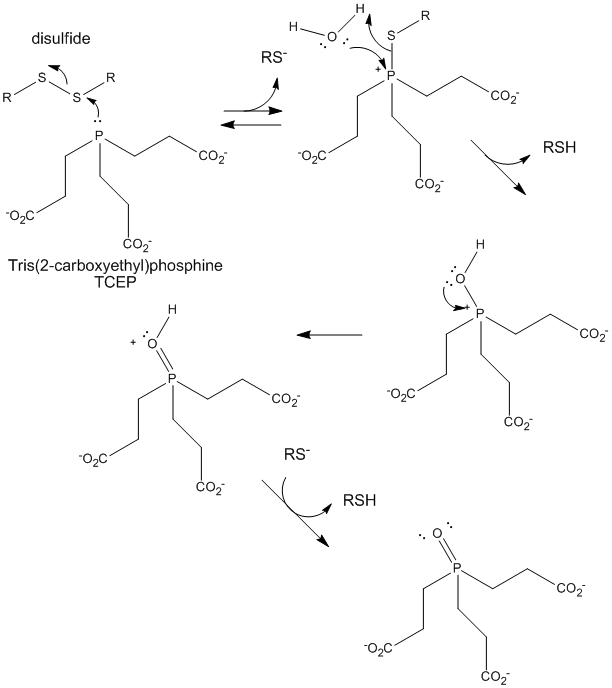
Figuur: TCEP-reductie van disulfiden
Het inwendige van cellen wordt in een gereduceerde omgeving gehouden door de aanwezigheid van veel “reducerende” stoffen, zoals het tripeptide g-glu-cys-gly (glutathion). Vandaar dat intracellulaire eiwitten gewoonlijk geen disulfiden bevatten, die overvloedig aanwezig zijn in extracellulaire eiwitten (zoals die in het bloed) of in bepaalde organellen zoals het endoplasmatisch reticulum en de mitochondriale intermembraanruimte, waar disulfiden kunnen worden geïntroduceerd.
Figuur:
Het splitsen van disulfidebindingen in eiwitten
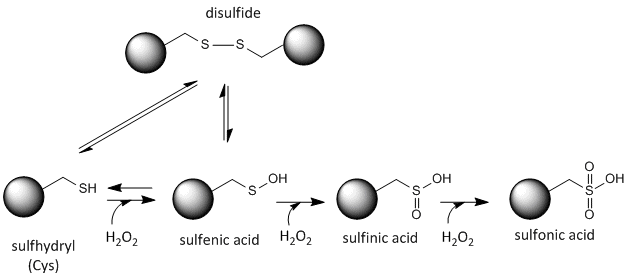
Cysteïne Redox Chemie
De zwavel in cysteïne is redox-actief en kan derhalve in een grote verscheidenheid van toestanden bestaan, afhankelijk van het lokale redox-milieu en de aanwezigheid van oxiderende en reducerende agentia. Een krachtig oxidatiemiddel dat in cellen kan worden gemaakt is waterstofperoxide, dat kan leiden tot meer drastische en onomkeerbare chemische modificaties aan de Cys zijketens. Als een reactieve Cys belangrijk is voor de eiwitfunctie, dan kan de functie van het eiwit worden gemoduleerd (soms reversibel, soms irreversibel) met verschillende oxidatiemiddelen, zoals in de onderstaande figuur is aangegeven.
Figuur:Redoxtoestand van Cysteïne
Navigatie
Kom terug naarHoofdstuk 2A: Aminozuursecties
Kom terug naarBiochemie Online Inhoudsopgave
Gearchiveerde versie van volledigeHoofdstuk 2A: Aminozuren
