 Open Access Article
Open Access Article Dit Open Access Article is gelicenseerd onder een
Dit Open Access Article is gelicenseerd onder een
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc en Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Voor het eerst gepubliceerd op 27 maart 2017
Polyethyleenglycol (PEG) derivaten zijn op grote schaal gebruikt in bio-gerelateerd onderzoek. Echter, PEG oligomeren (met verschillende molecuulgewichten) of PEG gebaseerde monomeren (met verschillende keten eindgroepen) hebben eigenlijk verschillende chemische en fysische eigenschappen, wat zou kunnen leiden tot potentiële toxiciteit. In dit werk is de cytotoxiciteit van een reeks PEG-derivaten (oligomeren en monomeren) gemeten met menselijke baarmoederhalskankercellen (HeLa) en een cellijn van fibroblasten afkomstig van muizen (L929) als modelcellen. De meeste PEG-oligomeren zijn veilig voor beide celtypes, behalve triethyleenglycol (TEG), dat in hoge concentraties toxisch is voor L929-cellen. Anderzijds vertoonden PEG-gebaseerde monomeren, waaronder poly(ethyleenglycol) methylether acrylaat (mPEGA) en poly(ethyleenglycol) methylether methacrylaat (mPEGMA), duidelijke cytotoxiciteit. Vervolgens zijn deze toxische PEG-derivaten bestudeerd om de verschillende mechanismen van hun toxiciteit te onthullen. Dit huidige onderzoek evalueerde de cytotoxiciteit van PEG-derivaten en wees op het potentiële gevaar van ‘veilige’ biomaterialen, wat een nuttige referentie kan bieden voor mensen om de PEG-derivaten in toekomstig biomedisch onderzoek te gebruiken.
Inleiding
Polyethyleenglycol (PEG) is op grote schaal toegepast in verschillende medische gebieden vanwege zijn uitstekende eigenschappen, zoals bevredigende veiligheid, biocompatibiliteit, hydrofiliteit, enz. PEG is bijvoorbeeld gebruikt in sommige door de Food and Drug Administration goedgekeurde laxeermiddelen vanwege zijn uitstekende vochtretentie en smerende vermogen.1-3 Een ander voorbeeld is het modificeren van geneesmiddelen/eiwitten met PEG (PEGylering) om hun wateroplosbaarheid en circulerende halfwaardetijd van geneesmiddelen,4,5 effectief te verbeteren, wat resulteert in verbeterde veiligheid en therapie-effecten. PEGylatie is één van de meest aantrekkelijke biotechnologieën aan het worden en kent een enorm succes in fundamenteel onderzoek en op de markt.6-11 Ondertussen zijn veel PEG derivaten gebruikt als uitstekende uitgangsmaterialen voor de synthese van een aantal nieuwe polymere materialen voor biotoepassingen.12 Bijvoorbeeld, een lineair PEG is gemodificeerd als een gedifunctionaliseerd PEG (DF-PEG) dat gebruikt kan worden om snel een interessante zelfhelende hydrogel te genereren.13,14 Sommige PEG-oligomeren zijn gebruikt om het oppervlak van anorganische nanodeeltjes te modificeren om de oplosbaarheid in water te verbeteren en de toxiciteit van die anorganische materialen te verminderen.15-17 Sommige commerciële PEG-gebaseerde monomeren zoals poly(ethyleenglycol) methylether acrylaat (mPEGA) en poly(ethyleenglycol) methylether methacrylaat (mPEGMA) zijn gebruikt om vertakte polymeren te bereiden voor daaropvolgende eiwitconjugatie, zelfassemblage, medicijnafgifte enz.18-27
Hoewel PEG normaal beschouwd wordt als bijna niet-toxisch, zijn sommige onveilige problemen van PEG met lage molecuulgewichten opgemerkt door onderzoekers. Smyth et al. rapporteerden de chronische orale toxiciteit van PEG oligomeer (Mn ∼ 200) bij ratten,28,29 de nadelige resultaten zijn ook waargenomen bij apen,30 wat wijst op potentiële veiligheidsproblemen van deze ‘veilige’ materialen. Daarom is, gezien het brede gebruik van PEG-derivaten in onderzoeksgebieden, de systematische cytotoxiciteitsstudie van die PEG-oligomeren en PEG-gebaseerde monomeren noodzakelijk en belangrijk voor hun verdere toepassing in biogerelateerde gebieden (Schema 1).
In het huidige werk werd de cytotoxiciteit geëvalueerd van sommige PEG-oligomeren (met verschillende molecuulgewichten) en commerciële PEG-gebaseerde monomeren (met verschillende keteneindgroepen) op menselijke baarmoederhalskankercellen (HeLa) en een cellijn van fibroblasten afkomstig van muizen (L929). De molecuulgewicht-afhankelijke cytotoxiciteit van PEG oligomeren werd waargenomen, en de verschillende cytotoxiciteitsmechanismen van PEG oligomeren en PEG-gebaseerde monomeren werden voor de eerste keer onthuld. Deze cytotoxiciteitsinformatie van PEG-derivaten zou waardevolle referenties kunnen zijn voor mensen om PEG als startmateriaal te kiezen en zuiveringsroutes te ontwerpen om biocompatibele PEG-gebaseerde materialen voor verdere biomedische toepassingen te bereiden.
Materialen en methoden
2.1 Chemische stoffen
Triethyleenglycol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poly(ethyleenglycol) methylether-acrylaat 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poly(ethyleenglycol)methylethermethacrylaat 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) en poly(ethyleenglycol)methylethermethacrylaat 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) werden rechtstreeks gebruikt zonder verdere zuivering.
Humane baarmoederhalskankercellen (HeLa) en een cellijn van fibroblasten afkomstig van muizen (L929) werden verkregen van de American type culture collection (ATCC). Dulbecco’s gemodificeerd eagle medium (DMEM, Corning-Cellgro), fosfaat gebufferde zoutoplossing (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), foetaal runderserum (FBS, Gibco), Roswell Park Memorial Institute 1640 cultuurmedium (RPMI 1640 cultuurmedium, Gibco), penicilline-streptomycine oplossing (Gibco), trypsine-EDTA (Gibco, 0.25%), 4-(3-(2-methoxy-4-nitrofenyl)-2-(4-nitrofenyl)-2H-tetrazol-3-ium-5-yl)benzeen-1,3-disulfonaat (CCK-8, Beyotime), 2,7-dichloordihydrofluoresceïne-diacetaat (DCFH-DA, Beyotime), geoxideerd glutathion (GSSG, Beyotime), nicotinamide adenine dinucleotide fosfaat (NADPH, Beyotime), 5,5′-dithiobis-(2-nitrobenzoëzuur) (DTNB, Beyotime), fluoresceïne diacetaat (FDA, Sigma) en propidiumjodide (PI, 94%, Sigma) werden gebruikt zoals aangekocht.
2.2 Celkweek
Celkweek werd gehandhaafd in een 37 ° C incubator met 5% CO2, kweekmedium werd om de een of twee dagen veranderd voor het behoud van de exponentiële groei van de cellen. HeLa-cellen waren afkomstig van baarmoederhalskankercellen en werden gekweekt in DMEM-medium, aangevuld met 10% foetaal runderserum (FBS) en 1% penicilline en streptomycine. L929-cellen waren afkomstig van muizen en werden gekweekt in RPMI 1640-medium aangevuld met 10% foetaal runderserum (FBS) en 1% penicilline en streptomycine.
2.3 Cytotoxiciteitsanalyse
De resultaten werden gepresenteerd als gemiddelde ± standaardafwijking (SD), en de half-maximale remmende concentratie 50% (IC50) waarden van PEG-derivaten werden berekend door SPSS 15.0.
Volgens ons eerdere werk,32,33 kunnen fluoresceïne diacetaat (FDA) en propidiumjodide (PI) worden gebruikt als een snelle en handige dubbele kleuring methode om de levensvatbaarheid van de cellen te observeren. L929 cellen werden gezaaid in een 24-well plaat bij een dichtheid van ∼5 × 104 cellen per ml. Na aanhechting werden de cellen gewassen met PBS en gekweekt met verschillende concentraties PEG-derivaten in kweekmedium gedurende 24 uur. Vervolgens werd een PBS-FDA-PI-mengoplossing (FDA: 3 μg mL-1; PI: 3 μg mL-1) toegevoegd en werd de 24-wellsplaat gedurende 15 min. bij 37 °C geïncubeerd. Een fluorescentiemicroscoop (Leica Duitsland) werd gebruikt om de levende en dode cellen te observeren onder 450-490 nm en 515-560 nm band-pass excitatie filters (I3 en N2.1), respectievelijk (100 W kwiklamp).
Briefjes, L929 cellen werden gezaaid in een 24-wells plaat en geïncubeerd in 0,5 mL kweekmedium met verschillende concentratie van TEG (A, A′) gedurende 1 uur (Fig. 1), A1-A6 wells werden gebruikt om de totale hoeveelheid glutathion (GSH + GSSG) te meten, terwijl A′1-A′6 wells werden gebruikt om de hoeveelheid geoxideerd glutathion (GSSG) te meten in aanwezigheid van TEG. Na 1 uur, werden de cellen verzameld door trypsine ontsluiting en centrifugatie (1000 rpm, 5 min). Vervolgens werd een drievoudig volume eiwitverwijderingsoplossing (50 mg ml-1) toegevoegd om de ruisende eiwitten te verwijderen. Na drie snelle vries-dooi cycli in vloeibare stikstof en een 37 ° C waterbad, werden de suspensie geplaatst in een koelkast (4 ° C) gedurende 5 min, en de monsters van de cel supernatant werden verkregen na centrifugatie (10 000 rpm, 10 min). Monsters uit de putjes A1-A6 werden gebruikt om het totale glutathiongehalte (GSH + GSSG) te meten. NADPH oplossing (0,5 mg ml-1) werd toegevoegd om alle glutathion te verminderen tot GSH, dan, 5,5′-dithiobis-(2-nitrobenzoëzuur) (DTNB) werd gebruikt om de GSH oxideren, de veranderde absorptie bij 405 nm werd opgenomen door een microplate reader (VICTOR ™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Monsters van A′1-A′6 wells werden gebruikt om het geoxideerde glutathion (GSSG) niveau te meten. Door de GSH-verwijderingsoplossing te gebruiken, werd alleen GSSG in de monsteroplossing achtergelaten. De monsters werden geanalyseerd volgens dezelfde methode als hierboven om het GSSG-niveau te meten. De totale hoeveelheid glutathion en de hoeveelheid geoxideerd glutathion werden verzameld om het niveau van gereduceerd glutathion te berekenen, terwijl het GSH-niveau van cellen in zuiver kweekmedium als controle werd gebruikt. De resultaten werden gepresenteerd als gemiddelde ± SD.
000 rpm, 10 min). Monsters uit de putjes A1-A6 werden gebruikt om het totale glutathiongehalte (GSH + GSSG) te meten. NADPH oplossing (0,5 mg ml-1) werd toegevoegd om alle glutathion te verminderen tot GSH, dan, 5,5′-dithiobis-(2-nitrobenzoëzuur) (DTNB) werd gebruikt om de GSH oxideren, de veranderde absorptie bij 405 nm werd opgenomen door een microplate reader (VICTOR ™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Monsters van A′1-A′6 wells werden gebruikt om het geoxideerde glutathion (GSSG) niveau te meten. Door de GSH-verwijderingsoplossing te gebruiken, werd alleen GSSG in de monsteroplossing achtergelaten. De monsters werden geanalyseerd volgens dezelfde methode als hierboven om het GSSG-niveau te meten. De totale hoeveelheid glutathion en de hoeveelheid geoxideerd glutathion werden verzameld om het niveau van gereduceerd glutathion te berekenen, terwijl het GSH-niveau van cellen in zuiver kweekmedium als controle werd gebruikt. De resultaten werden gepresenteerd als gemiddelde ± SD.
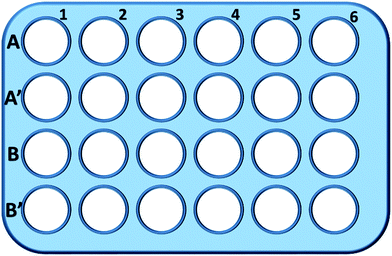
Wells in lijn B en B′ werden gebruikt om de totale hoeveelheid GSH en GSSG te testen in aanwezigheid van mPEGA-480, respectievelijk, door middel van dezelfde procedure.
Resultaten en discussie
3.1 Levensvatbaarheidsstudie van de cellen
Wanneer HeLa cel (een model van kankercellen) werd gebruikt (Fig. 2A), kon de cytotoxiciteit van alle PEG oligomeren bij lage concentraties (≤5 mg ml-1) worden verwaarloosd. Bij verhoogde concentratie (≥10 mg ml-1) werd de molecuulgewicht-afhankelijke cytotoxiciteit van PEG-monsters waargenomen. Het triethyleenglycol (TEG) vertoonde een duidelijke cytotoxiciteit boven 10 mg ml-1 (p < 0,05; in tegenstelling tot elk ander oligomeer bij een concentratie van meer dan 5 mg ml-1) en de IC50-waarde van het TEG voor HeLa-cellen werd berekend op 19,8 mg ml-1. Ondertussen vertoonden andere PEG-oligomeren (Mn ∼ 400-4000) ook minieme cytotoxiciteit.
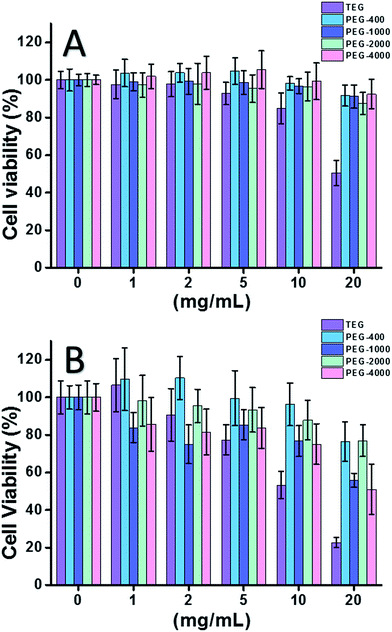
De cytotoxiciteit van PEG-oligomeren voor L929-cellen (een model van normale cellen) werd ook geëvalueerd (Fig. 2B). De levensvatbaarheid van de cellen daalde zoals verwacht met toenemende PEG-concentratie. Naast TEG vertoonden sommige PEG-oligomeren (PEG-1000, PEG-4000) die veilig zijn voor HeLa-cellen ook detecteerbare cytotoxiciteit; de IC50-waarden van TEG, PEG-1000 en PEG-4000 werden berekend als respectievelijk 12,4, 22,5 en 20,0 mg ml-1 voor L929-cellen, wat ook duidt op de molecuulgewicht-afhankelijke cytotoxiciteit van PEG-oligomeren.
Voorgaande resultaten suggereerden dat HeLa-cellen een betere tolerantie voor PEG-oligomeren hebben dan L929-cellen vanwege de hardnekkige vitaliteit van kankercellen, en dat TEG een veel hogere cytotoxiciteit heeft dan andere PEG-oligomeren met een hoger molecuulgewicht (p < 0,05; contrast met elk ander oligomeer wanneer de concentratie hoger is dan 5 mg ml-1). Opvallend in het huidige onderzoek is de matige cytotoxiciteit van PEG-1000 en PEG-4000 voor L929-cellen, en de vrijwel niet-cytotoxiciteit van PEG-400 en PEG-2000, wat afwijkt van de gangbare indruk dat PEG’s met een hoog molecuulgewicht biocompatibeler zouden zijn dan hun tegenhangers met een laag molecuulgewicht. Hoewel de reden van de cytotoxiciteit van PEG’s nog steeds niet duidelijk is, lijken PEG-400 en PEG-2000 betere keuzes te zijn voor mensen om biocompatibele materialen te synthetiseren.
Wanneer mPEGMA-500 werd getest, nam de levensvatbaarheid van zowel HeLa-cellen als L929-cellen af met toenemende concentratie van mPEGMA-500 (Fig. 3A), en er werd geen duidelijk verschil tussen twee celtypen waargenomen. De IC50-waarden van mPEGMA-500 zijn 4,7 mg ml-1 voor HeLa-cellen en 5,3 mg ml-1 voor L929-cellen na 24 uur cultuur, wat wijst op een significantere cytotoxiciteit van mPEGMA-500 dan bovengenoemde PEG-oligomeren, en wat impliceert dat de keteneindgroepen van PEG-derivaten cruciaal zijn voor hun toxiciteit. Toen mPEGMA-950, een ander PEG-gebaseerd methacrylaat met dezelfde keteneindgroep maar hoger moleculair gewicht werd getest via dezelfde procedure (Fig. 3B), werd een veel lagere cytotoxiciteit van mPEGMA-950 voor HeLa-cellen of L929-cellen waargenomen (p < 0,05; wanneer de concentratie meer dan 2 mg mL-1 bedraagt), de IC50-waarden van mPEGMA-950 zijn 20,8 mg mL-1 voor HeLa-cellen, en 21.7 mg ml-1 op L929-cellen na 24 uur cultuur, wat ook de molecuulgewichtafhankelijke cytotoxiciteit van methacrylaat op basis van PEG aantoont.
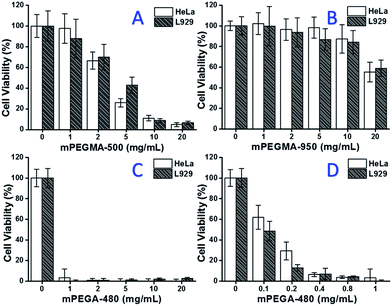
Daarnaast werd ook het op PEG gebaseerde acrylaat mPEGA-480 getest. Hoewel het verschil tussen mPEGA-480 en mPEGMA-500 slechts een methylgroep aan het uiteinde van de keten is, vertoonde mPEGA-480 acute cytotoxiciteit (Fig. 3C). Meer dan 95% van de cellen verloor de levensvatbaarheid, zelfs met 1 mg mL-1 mPEGA-480 in het kweekmedium. Daarom moeten aanvullende experimenten worden uitgevoerd met lagere concentraties om de cytotoxiciteit te bepalen (Fig. 3D), en de IC50 waarden van mPEGA-480 werden berekend als 0,2 mg mL-1 voor HeLa cellen en 0,1 mg mL-1 voor L929 cellen na 24 u cultuur.
De cellevensvatbaarheidsexperimenten bevestigden dat zowel de keteneindgroepen als het molecuulgewicht belangrijke invloedselementen zijn voor de cytotoxiciteit van PEG-derivaten, en de PEG-gebaseerde monomeren vertoonden een veel merkbaarder cytotoxiciteit in vergelijking met PEG-oligomeren.
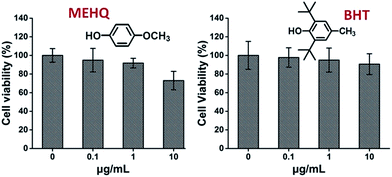
Ondertussen werd de cytotoxiciteit van remmers in PEG-gebaseerde monomeren, hydrochinonmethylether (MEHQ, 100 ppm in mPEGA) en gebutyleerd hydroxytolueen (BHT, 300 ppm in mPEGMA), ook geëvalueerd (Fig. 4), en de L929-cellen behielden een hoge levensvatbaarheid (≥90%) bij laag geconcentreerde remmers (≤1 μg mL-1). Er zijn 0,1 μg mL-1 van MEHQ in 1 mg mL-1 van mPEGA-480, en 3 μg mL-1 van BHT in 10 mg mL-1 van mPEGA-500, terwijl mPEG-480 en mPEGMA-500 toonden duidelijke cytotoxiciteit bij die concentraties. De sporen van remmers in monomeren op basis van PEG’s lijken dus een verwaarloosbare invloed te hebben op de cytotoxiciteit van monomeren.
3.2 Celmorfologie-observatie
Optische microscoopobservatie werd gebruikt om de cytotoxiciteit van PEG-derivaten op L929-cellen rechtstreeks te evalueren. De optische beelden van L929-cellen blootgesteld aan 20 mg ml-1 TEG en 0,1 mg ml-1 mPEGA gedurende 24 uur werden getoond in Fig. 5A en B, respectievelijk.
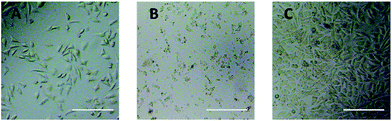
Na incubatie met 20 mg mL-1 TEG gedurende 24 uur, de cellen behielden de vergelijkbare morfologie (Fig. 5A) met de controlegroep (Fig. 5C, cellen in zuiver kweekmedium), maar het aantal cellen drastisch afgenomen, wat duidt op de cytotoxiciteit van TEG bij hoge concentratie, die leidde tot de dood en volgde onthechting van de cellen van de bodem van de microtiterplaat. Fig. 5B toonde de morfologie van L929 cellen na incubatie met 0,1 mg mL-1 mPEGA-480. Bijna alle cellen verloren de normale morfologie, wat wijst op de acute cytotoxiciteit van mPEGA-480, zelfs bij zo’n lage concentratie.
Daarnaast werden de cellen ook gekleurd met fluoresceïne. FDA/PI dubbelkleuring is een snelle, eenvoudige en gelijktijdige procedure om de levende en dode cellen te observeren.43 FDA kan de volledige cellen binnendringen en zich in de cellen ophopen, daarom is het volledige celmembraan noodzakelijk om het lekken van fluoresceïne uit de cel te voorkomen. PI daarentegen kan niet door het intacte celmembraan heen, maar kan de kern van dode cellen kleuren door door het beschadigde celmembraan heen te gaan. Zoals blijkt uit Fig. 6, hebben L929 cellen geïncubeerd met 20 mg mL-1 TEG minder levensvatbare cellen na de FDA-kleuring (Fig. 6b) vergeleken met de controle (Fig. 6a), en kunnen meer dode cellen worden waargenomen na de PI-kleuring (Fig. 6b′), identiek aan het resultaat door observatie door middel van een optische microscopie. mPEGA-480’s acute cytotoxiciteit werd ook waargenomen na de FDA/PI dubbele-kleuring procedure, geen groen signaal kon worden geïdentificeerd na incubatie van cellen met 0,1 mg mL-1 mPEG-480 gedurende 24 uur (Fig. 6c en c′′).
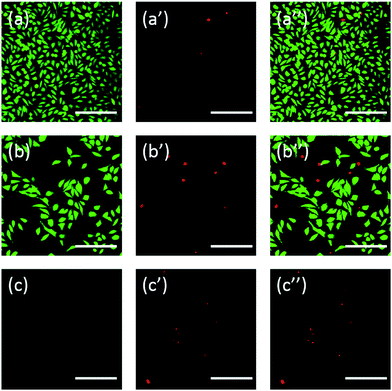
Zowel de optische als de fluorescente beelden toonden intuïtief de cytotoxiciteit van deze PEG-derivaten aan, wat de via CCK-8-tests verkregen conclusie verder ondersteunt. Opvallend is dat mPEGA-480 giftiger leek door de FDA/PI dubbele kleuring assay, wat wordt toegeschreven aan de FDA/PI dubbele kleuring onderscheidt de volledigheid van de levende / dode celmembraan, terwijl de CCK-8 assay detecteert de activiteit van dehydrogenase in mitochondriën, wat suggereert FDA / PI kleuring een uitstekende aanvulling van CCK-8 assay om meer details van de cel status te bieden.
3.3 Mechanismestudie
Volgens de cellevensvatbaarheidsexperimenten werden de IC50-waarden van de PEG-oligomeren en PEG-gebaseerde monomeren op HeLa- en L929-cellen na 24 uur cultuur berekend en samengevat (tabel 1), wat suggereert dat de PEG-gebaseerde monomeren veel giftiger zijn voor cellen dan de PEG-oligomeren, en de mPEGA heeft de hoogste cytotoxiciteit. De generatie van ROS en afname van GSH in cellen, twee belangrijke mechanismen van cytotoxiciteit werden daarom geanalyseerd om de mogelijke reden van cytotoxiciteit te onderzoeken.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa cellen | 19.8 | 32.5 | 36.2 | 38.2 | 29.6 | 4.7 | 20.8 | 0.2 |
| L929 cellen | 12.4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
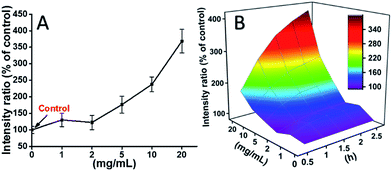
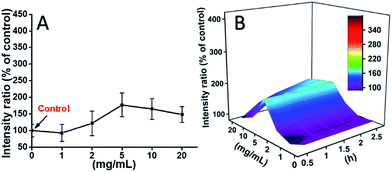
L929 cellen werden geïncubeerd met TEG, en de ROS niveaus op verschillende tijdstippen (0, 0,5, 1,0, 1,5, 2 uur) werden gedetecteerd volgens onze eerdere rapporten en getoond in Fig. 7. Als voorbeeld, de ROS niveaus na incubatie met verschillende concentraties TEG gedurende 2 uur werden getoond in Fig. 7A. Het is duidelijk te zien dat de ROS niveaus stabiel bleven bij lage TEG-concentratie (≤ 2 mg ml-1), maar significant toenamen wanneer de TEG-concentratie hoger is dan 2 mg ml-1, consistent met het resultaat van het cellevensvatbaarheidsexperiment in Fig. 2B. Op dezelfde manier werden de cijfers van ROS niveau vs. TEG concentratie op verschillende tijdstippen getekend en samengevoegd om een 3D kaart te krijgen (Fig. 7B). De maximale ROS niveaus werden gevonden bij 2 uur met 20 mg ml-1 TEG, een ongeveer 400% verhoogd ROS niveau ten opzichte van de controle (ROS niveau = 100) werd gedetecteerd, wat resulteerde in de helderste fluorescentie intensiteit. Deze resultaten suggereren dat de generatie van ROS het mogelijke mechanisme is van de cytotoxiciteit van TEG, en dat het hoge ROS-niveau dat door TEG wordt geïnduceerd de belangrijkste reden zou kunnen zijn voor celapoptose.
De ROS-niveaus geïnduceerd door mPEGA-480 na 2 uur werden ook getest (Fig. 8A). Anders dan bij TEG, veroorzaakte mPEGA geen snelle toename van ROS in de cellen, slechts ∼170% ROS toename ten opzichte van de controle werd waargenomen als het maximum. Het 3D ROS-niveau versus mPEGA & tijd (Fig. 8B) toonde het door mPEGA-480 geïnduceerde ROS-niveau als een golf en de top verscheen bij een matige concentratie mPEGA (5 mg ml-1), er kan geen significante generatie van ROS worden waargenomen, wat suggereert dat de generatie van ROS mogelijk slechts gedeeltelijk bijdraagt aan de cytotoxiciteit van mPEGA-480.
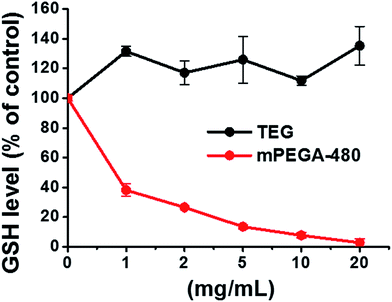
De reducerende thiolgroep in GSH is een belangrijke anti-oxidatiebron in organismen. Een mogelijk mechanisme voor de cytotoxiciteit van mPEGA-480 wordt toegeschreven aan de Michael-additie reactie tussen thiolgroep en vinylbinding, leidend tot het verbroken intracellulaire redox-evenwicht en celapoptose. Eerder onderzoek suggereerde dat de Michael-additie tussen thiol en acrylaat veel sneller verloopt dan die tussen thiol en methacrylaat,52 wat een redelijke oorzaak zou kunnen zijn voor de verschillende acute cytotoxiciteit tussen mPEGA-480 en mPEGMA-500.
Conclusies
De cytotoxiciteit van PEG-oligomeren en PEG-gebaseerde monomeren aan HeLa-cellen en L929-cellen werd voor de eerste keer geëvalueerd. Concentratie-afhankelijke cytotoxiciteit van PEG-oligomeren en PEG-gebaseerde monomeren is bevestigd, en gepresenteerd als IC50-waarden voor HeLa-cellen en L929-cellen. PEG-400, PEG-2000 lijken in het huidige onderzoek vrijwel niet-cytotoxisch. PEG-1000, PEG-4000 en mPEGMA-950 vertoonden een matige cytotoxiciteit, vooral bij hoge concentraties. TEG en mPEGMA-500 vertoonden significante cytotoxiciteit, en mPEGA-480 vertoonde acute cytotoxiciteit. Bovendien beïnvloeden celtypes ook de resultaten van de cytotoxiciteitsstudie; HeLa-cellen zijn robuuster dan L929-cellen om PEG-derivaten te verdragen. Deze resultaten over de cytotoxiciteit van PEG-derivaten zijn voorlopig, maar fundamenteel voor hun toekomstige biomedische toepassing, meer informatie over de celreactie en het gedrag op andere PEG-derivaten zal verder worden onderzocht.
Acknowledgements
Dit onderzoek werd ondersteund door de National Science Foundation van China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein and G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan and J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper and M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang and D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun and H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris and R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese en G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley and J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill and W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner and W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann and A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li en Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao and Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng and Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad and S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan and D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li and Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao and Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo en H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka and H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya en C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander and P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang and K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao en K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh en E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu en W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter en C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter and C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice en S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki and M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei en X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li en Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang en J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller and C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode and S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown and A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta en S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han and W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel and H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake and L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang and P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones en J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim en I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka en M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu and H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li en J. Liu, Toxicol. Appl. Pharmacol, 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim en M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate and H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch and W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser en P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer and D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
