Leerlingendoelstellingen
- Beschrijf de energetica van covalente en ionische binding vorming en verbreking
- Gebruik de gemiddelde energieën van covalente bindingen om de enthalpie van reacties te schatten
De sterkte van een binding beschrijft hoe sterk elk atoom met een ander atoom is verbonden, en dus hoeveel energie er nodig is om de binding tussen de twee atomen te verbreken.
Het is essentieel te onthouden dat energie moet worden toegevoegd om chemische bindingen te verbreken (een endotherm proces), terwijl het vormen van chemische bindingen energie vrijmaakt (een exotherm proces). In het geval van waterstofmoleculen is de covalente binding zeer sterk; er moet een grote hoeveelheid energie, 436 kJ, worden toegevoegd om de bindingen in één mol waterstofmoleculen te verbreken en de atomen te scheiden:
![]()
Omgekeerd komt dezelfde hoeveelheid energie vrij bij de vorming van één mol \text{H}_2 moleculen uit twee mol H-atomen:
\text{2H} (g)
\text{H}_2(g)
\text{H}_2(g)
bindingsenergie = -436 kJ}
Bondsterkte: Covalente bindingen
Stabiele moleculen bestaan omdat covalente bindingen de atomen bij elkaar houden. We meten de sterkte van een covalente binding aan de hand van de energie die nodig is om ze te verbreken, dat wil zeggen, de energie die nodig is om de gebonden atomen te scheiden. Het scheiden van elk paar gebonden atomen kost energie. Hoe sterker een binding, hoe groter de energie die nodig is om hem te verbreken.
De energie die nodig is om een bepaalde covalente binding in één mol gasmoleculen te verbreken, wordt de bindingsenergie of de bindingsdissociatie-energie genoemd. De bindingsenergie voor een diatomisch molecuul, ![]() , is gedefinieerd als de standaard enthalpieverandering voor de endotherme reactie:
, is gedefinieerd als de standaard enthalpieverandering voor de endotherme reactie:
![]()
Bijv. de bindingsenergie van de zuivere covalente binding H-H, ![]() , is 436 kJ per mol verbroken H-H bindingen:
, is 436 kJ per mol verbroken H-H bindingen:
![]()
Moleculen met drie of meer atomen hebben twee of meer bindingen. De som van alle bindingsenergieën in zo’n molecuul is gelijk aan de standaard enthalpieverandering voor de endotherme reactie die alle bindingen in het molecuul verbreekt. Bijvoorbeeld, de som van de vier C-H bindingsenergieën in ![]() , 1660 kJ, is gelijk aan de standaard enthalpieverandering van de reactie:
, 1660 kJ, is gelijk aan de standaard enthalpieverandering van de reactie:

De gemiddelde C-H bindingsenergie, ![]() , is 1660/4 = 415 kJ/mol omdat er vier mol C-H bindingen per mol van de reactie worden verbroken. Hoewel de vier C-H bindingen in het oorspronkelijke molecuul equivalent zijn, hebben ze niet elk dezelfde energie nodig om te verbreken; als de eerste binding eenmaal is verbroken (waarvoor 439 kJ/mol nodig is), zijn de resterende bindingen gemakkelijker te verbreken. De waarde van 415 kJ/mol is het gemiddelde, niet de exacte waarde die nodig is om een binding te verbreken.
, is 1660/4 = 415 kJ/mol omdat er vier mol C-H bindingen per mol van de reactie worden verbroken. Hoewel de vier C-H bindingen in het oorspronkelijke molecuul equivalent zijn, hebben ze niet elk dezelfde energie nodig om te verbreken; als de eerste binding eenmaal is verbroken (waarvoor 439 kJ/mol nodig is), zijn de resterende bindingen gemakkelijker te verbreken. De waarde van 415 kJ/mol is het gemiddelde, niet de exacte waarde die nodig is om een binding te verbreken.
De sterkte van een binding tussen twee atomen neemt toe naarmate het aantal elektronenparen in de binding toeneemt. In het algemeen neemt de lengte van de binding af naarmate de sterkte van de binding toeneemt. Zo vinden we dat drievoudige bindingen sterker en korter zijn dan dubbele bindingen tussen dezelfde twee atomen; evenzo zijn dubbele bindingen sterker en korter dan enkele bindingen tussen dezelfde twee atomen. De gemiddelde bindingsenergieën voor enkele veel voorkomende bindingen staan in de tabel hieronder, en een vergelijking van de bindingslengtes en bindingssterkten voor enkele veel voorkomende bindingen staat in de volgende tabel. Wanneer een atoom bindt aan verschillende atomen in een groep, neemt de bindingssterkte typisch af naarmate we lager in de groep komen. Bijvoorbeeld, ![]() is 439 kJ/mol,
is 439 kJ/mol, ![]() is 330 kJ/mol, en
is 330 kJ/mol, en ![]() is 275 kJ/mol.
is 275 kJ/mol.
| Bondenergieën (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Bond | Bondenergie | Bond | Bondsenergie | Bond | Bondsenergie | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Gemiddelde bindingslengtes en bindingsenergieën voor sommige Gemeenschappelijke Bindingen | ||
|---|---|---|
| Bond | Bondlengte (Å) | Bondsenergie (kJ/mol) |
| 1,54 | 345 | |
| 1,34 | 611 | |
| 1.20 | 837 | |
| 1,43 | 290 | |
| 1,38 | 615 | |
| 1.16 | 891 | |
| 1,43 | 350 | |
| 1,23 | 741 | |
| 1,13 | 1080 | |
De bindingsenergie is het verschil tussen het energieminimum (dat optreedt op de bindingsafstand) en de energie van de twee gescheiden atomen. Dit is de hoeveelheid energie die vrijkomt wanneer de binding wordt gevormd. Omgekeerd is dezelfde hoeveelheid energie nodig om de binding te verbreken. Voor het molecuul \text{H}_2 in de tabel hierboven is het systeem bij de bindingsafstand van 74 pm 7,24 × 10-19 J lager in energie dan de twee gescheiden waterstofatomen. Dit lijkt misschien een klein getal. Maar, zoals we later in meer detail zullen leren, worden bindingsenergieën vaak besproken op een per-mole basis. Zo is er 7,24 × 10-19 J nodig om één H-H binding te verbreken, maar is er 4,36 × 105 J nodig om 1 mol H-H bindingen te verbreken. Een vergelijking van enkele bindingslengtes en -energieën staat in de tabellen hierboven. We vinden veel van deze bindingen in een verscheidenheid van moleculen, en deze tabel geeft gemiddelde waarden. Zo is voor het verbreken van de eerste C-H binding in ![]() 439,3 kJ/mol nodig, terwijl voor het verbreken van de eerste C-H binding in
439,3 kJ/mol nodig, terwijl voor het verbreken van de eerste C-H binding in ![]() (een gewone verfverdunner) 375.5 kJ/mol.
(een gewone verfverdunner) 375.5 kJ/mol.
Zoals te zien is in de tabellen hierboven, is een gemiddelde enkelvoudige koolstof-koolstof binding 347 kJ/mol, terwijl in een koolstof-koolstof dubbele binding de binding ![]() de bindingssterkte met 267 kJ/mol verhoogt. Toevoeging van een extra binding
de bindingssterkte met 267 kJ/mol verhoogt. Toevoeging van een extra binding ![]() veroorzaakt een verdere toename van 225 kJ/mol. We zien een vergelijkbaar patroon wanneer we andere
veroorzaakt een verdere toename van 225 kJ/mol. We zien een vergelijkbaar patroon wanneer we andere ![]() en
en ![]() bindingen vergelijken. Elke afzonderlijke binding
bindingen vergelijken. Elke afzonderlijke binding ![]() is dus in het algemeen zwakker dan een overeenkomstige binding
is dus in het algemeen zwakker dan een overeenkomstige binding ![]() tussen dezelfde twee atomen. In een binding
tussen dezelfde twee atomen. In een binding ![]() is er een grotere mate van overlap van orbitalen dan in een binding
is er een grotere mate van overlap van orbitalen dan in een binding ![]() .
.
We kunnen bindingsenergieën gebruiken om bij benadering enthalpieveranderingen te berekenen voor reacties waar enthalpie van vorming niet beschikbaar is. Berekeningen van dit type vertellen ons ook of een reactie exotherm of endotherm is. Een exotherme reactie (ΔH negatief, geproduceerde warmte) ontstaat wanneer de bindingen in de producten sterker zijn dan de bindingen in de reactanten. Een endotherme reactie (ΔH positief, geabsorbeerde warmte) ontstaat wanneer de bindingen in de producten zwakker zijn dan die in de reactanten.
De enthalpieverandering, ΔH, voor een chemische reactie is ongeveer gelijk aan de som van de energie die nodig is om alle bindingen in de reactanten te verbreken (energie “in”, positief teken) plus de energie die vrijkomt wanneer alle bindingen in de producten worden gevormd (energie “uit”, negatief teken). Dit kan wiskundig als volgt worden uitgedrukt:
![]()
In deze uitdrukking betekent het symbool ![]() “de som van” en D staat voor de bindingsenergie in kilojoule per mol, wat altijd een positief getal is. De bindingsenergie wordt verkregen uit een tabel en zal afhangen van het feit of de betreffende binding een enkelvoudige, dubbele of drievoudige binding is. Bij het berekenen van enthalpiecoëfficiënten op deze manier is het dus belangrijk dat we de binding in alle reactanten en producten in aanmerking nemen. Omdat D-waarden meestal gemiddelden zijn voor één type binding in veel verschillende moleculen, geeft deze berekening een ruwe schatting, geen exacte waarde, voor de enthalpie van de reactie.
“de som van” en D staat voor de bindingsenergie in kilojoule per mol, wat altijd een positief getal is. De bindingsenergie wordt verkregen uit een tabel en zal afhangen van het feit of de betreffende binding een enkelvoudige, dubbele of drievoudige binding is. Bij het berekenen van enthalpiecoëfficiënten op deze manier is het dus belangrijk dat we de binding in alle reactanten en producten in aanmerking nemen. Omdat D-waarden meestal gemiddelden zijn voor één type binding in veel verschillende moleculen, geeft deze berekening een ruwe schatting, geen exacte waarde, voor de enthalpie van de reactie.
Bekijk de volgende reactie:
![]()
of
![]()
Om twee mol \text{HCl} te vormen, moeten één mol H-H bindingen en één mol Cl-Cl bindingen worden verbroken. De energie die nodig is om deze bindingen te verbreken is de som van de bindingsenergie van de H-H binding (436 kJ/mol) en de Cl-Cl binding (243 kJ/mol). Tijdens de reactie worden twee mol H-Cl bindingen gevormd (bindingsenergie = 432 kJ/mol), waarbij 2 × 432 kJ vrijkomt; ofwel 864 kJ. Omdat de bindingen in de producten sterker zijn dan die in de reactanten, komt bij de reactie meer energie vrij dan er verbruikt wordt:
| = -. | ||
Deze overtollige energie komt als warmte vrij, dus de reactie is exotherm. Bijlage G geeft een waarde voor de standaard molaire enthalpie van vorming van ![]() ,
, ![]() , van -92,307 kJ/mol. Tweemaal die waarde is -184.6 kJ, hetgeen goed overeenkomt met het eerder verkregen antwoord voor de vorming van twee mol HCl.
, van -92,307 kJ/mol. Tweemaal die waarde is -184.6 kJ, hetgeen goed overeenkomt met het eerder verkregen antwoord voor de vorming van twee mol HCl.
VOORBEELD
Het gebruik van bindingsenergieën om enthalpieveranderingen bij benadering te berekenen
Methanol, ![]() , kan een uitstekende alternatieve brandstof zijn. Bij de hoge-temperatuurreactie van stoom en koolstof ontstaat een mengsel van de gassen koolmonoxide,
, kan een uitstekende alternatieve brandstof zijn. Bij de hoge-temperatuurreactie van stoom en koolstof ontstaat een mengsel van de gassen koolmonoxide, ![]() , en waterstof, \text{H}_2 , waaruit methanol kan worden gemaakt. Bereken met behulp van de bindingsenergieën in de tabellen hierboven bij benadering de enthalpieverandering, ΔH, voor de reactie hier:
, en waterstof, \text{H}_2 , waaruit methanol kan worden gemaakt. Bereken met behulp van de bindingsenergieën in de tabellen hierboven bij benadering de enthalpieverandering, ΔH, voor de reactie hier:
![]()
Oplossing
Eerst moeten we de Lewisstructuren van de reactanten en de producten schrijven:

Hieruit blijkt dat ΔH voor deze reactie de energie omvat die nodig is om een C-O drievoudige binding en twee H-H enkelvoudige bindingen te verbreken, alsmede de energie die vrijkomt bij de vorming van drie C-H enkelvoudige bindingen, een C-O enkelvoudige binding, en een O-H enkelvoudige binding. We kunnen dit als volgt uitdrukken:
Met behulp van de bindingsenergiewaarden in de tabel, verkrijgen we:
| =….107 kJ} |
We kunnen deze waarde vergelijken met de waarde die is berekend op basis van ![]() gegevens uit Bijlage G:
gegevens uit Bijlage G:
Merk op dat er een vrij groot verschil is tussen de waarden die met de twee verschillende methoden zijn berekend. Dit komt omdat D-waarden het gemiddelde zijn van verschillende bindingssterkten; daarom geven ze vaak slechts een ruwe overeenkomst met andere gegevens.
Check Your Learning
Ethylalcohol, ![]() , was een van de eerste organische chemische stoffen die door mensen opzettelijk werden gesynthetiseerd. Het heeft vele toepassingen in de industrie, en het is de alcohol in alcoholische dranken. Het kan worden verkregen door de fermentatie van suiker of worden gesynthetiseerd door de hydratatie van ethyleen in de volgende reactie:
, was een van de eerste organische chemische stoffen die door mensen opzettelijk werden gesynthetiseerd. Het heeft vele toepassingen in de industrie, en het is de alcohol in alcoholische dranken. Het kan worden verkregen door de fermentatie van suiker of worden gesynthetiseerd door de hydratatie van ethyleen in de volgende reactie:

Bereken met behulp van de bindingsenergieën in de tabel bij benadering de enthalpieverandering, ΔH, voor deze reactie.
-35 kJ
Ionische bindingssterkte en rooster-energie
Een ionische verbinding is stabiel door de elektrostatische aantrekking tussen de positieve en negatieve ionen. De tralie-energie van een verbinding is een maat voor de sterkte van deze aantrekkingskracht. De rooster-energie (ΔHrooster) van een ionische verbinding wordt gedefinieerd als de energie die nodig is om één mol van de vaste stof te scheiden in de gasvormige ionen waaruit deze bestaat. Voor de ionische vaste stof MX is de rooster-energie de enthalpieverandering van het proces:
![]()
Merk op dat we de conventie gebruiken waarbij de ionische vaste stof in ionen wordt gescheiden, zodat onze rooster-energieën endotherm zullen zijn (positieve waarden). Sommige teksten gebruiken de equivalente maar tegengestelde conventie, waarbij de roosterenergie wordt gedefinieerd als de energie die vrijkomt wanneer afzonderlijke ionen samenkomen om een rooster te vormen, en geven negatieve (exotherme) waarden. Als u dus de roosterenergie in een ander naslagwerk opzoekt, moet u nagaan welke definitie wordt gebruikt. In beide gevallen duidt een grotere waarde voor de roosterenergie op een stabielere ionische verbinding. Voor natriumchloride is ![]() . Er is dus 769 kJ nodig om één mol vaste stof
. Er is dus 769 kJ nodig om één mol vaste stof ![]() in gasvormige ↪No_21532> en
in gasvormige ↪No_21532> en ![]() ionen. Wanneer uit één mol gasvormige \text{Na}^+ en
ionen. Wanneer uit één mol gasvormige \text{Na}^+ en ![]() ionen vaste
ionen vaste ![]() , komt 769 kJ warmte vrij.
, komt 769 kJ warmte vrij.
De rooster energie ![]() van een ionisch kristal kan worden uitgedrukt met de volgende vergelijking (afgeleid van de wet van Coulomb, die de krachten tussen elektrische ladingen regelt):
van een ionisch kristal kan worden uitgedrukt met de volgende vergelijking (afgeleid van de wet van Coulomb, die de krachten tussen elektrische ladingen regelt):
![]()
waarin C een constante is die afhangt van het type kristalstructuur; Z+ en Z- zijn de ladingen op de ionen; en Ro is de interionische afstand (de som van de stralen van de positieve en negatieve ionen). De rooster-energie van een ionisch kristal neemt dus snel toe naarmate de ladingen van de ionen toenemen en de afmetingen van de ionen afnemen. Wanneer alle andere parameters constant worden gehouden, verviervoudigt een verdubbeling van de lading van zowel het kation als het anion de roosterenergie. Bijvoorbeeld, de traliekenergie van ![]() (Z+ en Z- = 1) is 1023 kJ/mol, terwijl die van
(Z+ en Z- = 1) is 1023 kJ/mol, terwijl die van ![]() (Z+ en Z- = 2) 3900 kJ/mol is (Ro is bijna hetzelfde- ongeveer 200 pm voor beide verbindingen).
(Z+ en Z- = 2) 3900 kJ/mol is (Ro is bijna hetzelfde- ongeveer 200 pm voor beide verbindingen).
Verschillende interatomaire afstanden veroorzaken verschillende roosterenergieën. We kunnen bijvoorbeeld de rooster energie van ![]() (2957 kJ/mol) vergelijken met die van
(2957 kJ/mol) vergelijken met die van ![]() (2327 kJ/mol) om het effect op de rooster energie van de kleinere ionische grootte van F- in vergelijking met I- te observeren.
(2327 kJ/mol) om het effect op de rooster energie van de kleinere ionische grootte van F- in vergelijking met I- te observeren.
EXAMPLE
Vergelijkingen van de roosterenergie
De kostbare edelsteen robijn is aluminiumoxide, ![]() , met sporen van
, met sporen van ![]() . De verbinding
. De verbinding ![]() wordt gebruikt bij de fabricage van sommige halfgeleiderelementen. Welke heeft de grootste energie,
wordt gebruikt bij de fabricage van sommige halfgeleiderelementen. Welke heeft de grootste energie, ![]() of
of ![]() ?
?
Oplossing
In deze twee ionische verbindingen zijn de ladingen Z+ en Z- gelijk, zodat het verschil in energie van het rooster afhangt van Ro. Het ![]() ion is kleiner dan het
ion is kleiner dan het ![]() ion. Zo zou
ion. Zo zou ![]() een kortere interionische afstand hebben dan
een kortere interionische afstand hebben dan ![]() , en
, en ![]() zou de grotere tralie-energie hebben.
zou de grotere tralie-energie hebben.
Check Your Learning
Zinkoxide, ![]() , is een zeer effectief zonnefilter. Hoe zou de tralie-energie van
, is een zeer effectief zonnefilter. Hoe zou de tralie-energie van ![]() vergelijken met die van
vergelijken met die van ![]() ?
?
KEY TAKEAWAYS
De sterkte van een covalente binding wordt gemeten aan de hand van de dissociatie-energie van de binding, dat wil zeggen, de hoeveelheid energie die nodig is om die specifieke binding in een mol moleculen te verbreken. Meervoudige bindingen zijn sterker dan enkelvoudige bindingen tussen dezelfde atomen. De enthalpie van een reactie kan worden geschat op basis van de energie-input die nodig is om bindingen te verbreken en de energie die vrijkomt wanneer nieuwe bindingen worden gevormd. Voor ionische bindingen is de tralie-energie de energie die nodig is om één mol van een verbinding te scheiden in zijn gasfase-ionen. De traliekenergie neemt toe voor ionen met hogere ladingen en kortere afstanden tussen de ionen.
- Bindingsenergie voor een diatomisch molecuul:
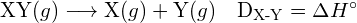
- Enthalpieverandering:

- Rooster energie voor een vaste stof MX:
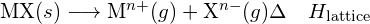
- Rooster energie voor een ionisch kristal:
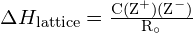
EINDE VAN DE OEFENINGEN VAN HOOFDSTUK
- Welke binding van elk van de volgende bindingsparen is het sterkst? (a)
 of
of 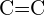 b)
b) 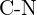 of
of 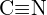 c)
c) 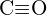 of
of 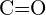 d)
d) 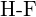 of
of 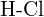 (e)
(e) 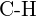 of
of 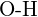 (f)
(f) 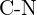 of
of 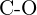
- Bepaal met behulp van de bindingsenergieën in de tabel bij benadering de enthalpieverandering voor elk van de volgende reacties: (a)
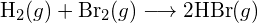 b)
b) 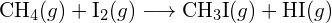 (c)
(c) 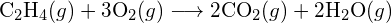 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Bepaal, met behulp van de bindingsenergieën in de tabel, bij benadering de enthalpieverandering voor elk van de volgende reacties: (a)
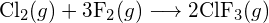 b)
b) 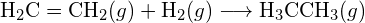 (c)
(c) 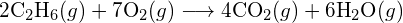
- Teken een kromme die de energie beschrijft van een systeem met H en Cl atomen op verschillende afstanden. Vind vervolgens op twee manieren de minimumenergie van deze kromme.(a) Gebruik de bindingsenergie uit de tabellen om de energie te berekenen voor een enkele \text{HCl}
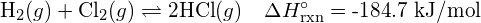
Leg uit waarom bindingen ontstaan op specifieke gemiddelde bindingsafstanden in plaats van dat de atomen elkaar oneindig dicht naderen.


 De C-C enkelvoudige bindingen zijn het langst.
De C-C enkelvoudige bindingen zijn het langst. 
| Element | Eerste ionisatie-energie (kJ/mol) | Tweede ionisatie-energie (kJ/mol) |
|---|---|---|
| K | 419 | 3050 |
| Ca | 590 | 1140 |
(d) De eerste ionisatie-energie van Mg is 738 kJ/mol en die van Al is 578 kJ/mol. Verklaar dit verschil.
(a) Wanneer twee elektronen uit de valentieschil worden verwijderd, verliest de Ca straal het buitenste energieniveau en keert terug naar het lagere n = 3 niveau, dat veel kleiner is in straal.(b) De +2 lading op calcium trekt de zuurstof veel dichter bij vergeleken met K, waardoor de rooster energie toeneemt ten opzichte van een minder geladen ion.
(c) Verwijdering van het 4s elektron in Ca vereist meer energie dan verwijdering van het 4s elektron in K vanwege de sterkere aantrekkingskracht van de kern en de extra energie die nodig is om de koppeling van de elektronen te verbreken. De tweede ionisatie-energie voor K vereist dat een elektron wordt verwijderd uit een lager energieniveau, waar de aantrekkingskracht van de kern op het elektron veel sterker is. Bovendien is er energie nodig om twee elektronen in een volledige orbitaal te ontparen. Voor Ca vereist de tweede ionisatiepotentiaal het verwijderen van slechts een lone elektron in het blootgestelde buitenste energieniveau.
(d) In Al is het verwijderde elektron relatief onbeschermd en ongepaard in een p-baan. De hogere energie voor Mg weerspiegelt hoofdzakelijk het ongepaarde 2s elektron.
Voetnoten
- 1 Deze vraag is afkomstig uit het Advanced Placement Examen Chemistry en wordt gebruikt met toestemming van de Educational Testing Service.
Glossary
bindingsenergie (ook, bindingsdissociatie-energie) energie die nodig is om een covalente binding in een gasvormige stof te verbreken rooster-energie (ΔHrooster) energie die nodig is om één mol van een ionische vaste stof te scheiden in zijn component gasvormige ionen
energie die nodig is om één mol van een ionische vaste stof te scheiden in de samenstellende gasvormige ionen
