Insecten verzamelen is voor velen een interessante hobby, maar is ook zeer nuttig bij wetenschappelijk onderzoek. In dit bericht wordt uitgelegd hoe men insecten verzamelt en bewaart, en wordt getoond hoe men ze moet vastpinnen.
Insecten verzamelen kan op elk moment, hoewel ze vooral aanwezig zijn in de lente, tot laat in de herfst. De zomer is waarschijnlijk de beste tijd, omdat de insecten dan het talrijkst zijn. Op warme, zonnige dagen zijn waarschijnlijk de meeste insecten aanwezig, maar het is verstandig om op verschillende tijdstippen en onder verschillende weersomstandigheden te controleren, omdat verschillende insecten op verschillende tijdstippen tevoorschijn komen. s Nachts zijn straatlantaarns en portiekverlichting een goede plek om te kijken. Bladafval en planten zijn waarschijnlijk huis insecten, en er zijn ook veel nachtelijke insecten die weg te blijven van lichten.
Verzamelen apparatuur:
- Insectennet – Deze kunnen worden gekocht of gemaakt. Ze moeten worden gemaakt van netten, die worden vastgestikt aan een neteldoek of canvasdoek dat om de draad wordt gewikkeld. Van daaruit kan het insect in een pot worden overgebracht, hetzij door de pot in het net te steken, hetzij door het insect bij de thorax vast te houden.
-

Mijn moordpot. PC: Colton Weaver Killing Jar – Het is het beste om 2-3 potten te hebben in verschillende vormen en maten. In het ideale geval zijn ze voorzien van een kurk, maar dat kan afhangen. Op de potten moet duidelijk “POISON” staan. Gips of katoen wordt in het potje gedaan om het dodelijke middel vast te houden. Borror, Delong, en Triplehorn bevelen cyanide aan, maar ethylacetaat kan ook gebruikt worden en is aanzienlijk veiliger. Tetrachloorkoolstof of chloroform kunnen ook worden gebruikt.
- Pillendozen met weefsel
- Enveloppen, of papier om ze te maken – Nuttig voor tijdelijke opslag. Deze kunnen gemakkelijk in het veld worden gemaakt en houden uw specimens relatief veilig.
- Flesjes gevuld met conserveervloeistof
- Tangen
- Handlens
- Aspirator – Deze vangen kleine insecten in flesjes met behulp van uw adem. Meestal hebben ze een scherm om te voorkomen dat u het insect inademt.
- Kloppende paraplu of blad – Een blad of paraplu wordt onder een plant gelegd, die vervolgens wordt geslagen of geschud zodat kleine insecten op het blad vallen.
- Zeef – Bladafval kan langzaam worden gezeefd op wit laken of karton, en dan kunnen de gevonden insecten worden opgezogen.
- Vallen – Er zijn veel soorten vallen. Een Berlese trechter heeft een trechter met een scherm, en een gloeilamp bovenop, met alcohol op de bodem. Insecten worden aangetrokken en vallen dan in de dodelijke pot. Een lichtval kan doeltreffend zijn voor sommige insecten, en kan zo eenvoudig zijn als een lamp boven het dodingsmiddel, of een inloopval waarin de insecten zich nestelen en met de hand kunnen worden verzameld. Valkuilen kunnen worden gebruikt voor aaskevers of andere niet-vliegende insecten, en zijn gewoon blikken met aas op de bodem. De insecten vallen erin en kunnen niet ontsnappen. Een eenvoudige val kan gewoon een suikeroplossing zijn die op een oppervlak wordt uitgespreid.
- Hoofdlamp
- Mes
Hanteren van de vangst: Veel zachte insecten kunnen direct in 70-90% isopropyl- of ethylalcohol worden gelegd. Dit geldt voor larven en nimfen van veel soorten, maar ook voor sommige kleinere insecten. Harde insecten moeten in de dodingspot worden gedaan. Hoe lang dat duurt, hangt af van het insect en van het dodingsmiddel, en kan variëren van een paar minuten tot een paar uur. Als het insect dood is, moet het zo snel mogelijk worden verwijderd om extra verkleuring te voorkomen. Deze kunnen worden bewaard in pillendoosjes of de hierboven beschreven papieren enveloppen.
Relaxeren: Als u een specimen niet onmiddellijk kunt vastpinnen en uitspreiden, zal het waarschijnlijk uitdrogen. In deze toestand is het vrij broos en zal het breken als u het probeert te ordenen. Om dit te verhelpen kunt u een relaxatiekamer gebruiken, relaxatievloeistof, of het insect koken in water (dit kan het echter beschadigen).
Relaxatiekamers zijn containers met nat zand of doek erin. Idealiter moet er carbolzuur aan worden toegevoegd om schimmelvorming te voorkomen. Na een dag of twee moet u het preparaat weer kunnen manipuleren.
Relaxeervloeistof kan worden gemaakt van verschillende mengsels, en meestal laat u het insect er enkele minuten in zitten. Eén mengsel, vaak bekend als Barber’s vloeistof, staat hieronder:
| 95% ethylalcohol | 50 cm3 |
| Water | 50cm3 |
| Ethyl acetaat | 20cm3 |
| Benzeen | 7cm3 |
Een andere methode die kan worden gebruikt is injectie met kraanwater. Dit werkt bij veel Lepidoptera. Injecteer met een 20-25 gauge naald water in de thorax onder de vleugel tot deze volledig gevuld is. Na 5-20 minuten zou uw insect ontspannen moeten zijn.
Bewaren in vloeistof: Dit kan worden gebruikt op veel zachte bodied insecten (zoals meivliegen, steenvliegen, caddisflies, enz.), die niet kunnen worden geprikt, tenzij ze worden gedroogd zoals hierboven vermeld. Het is ook nuttig voor zeer kleine specimens die op microscoopdia’s zullen worden bestudeerd, en voor insectenlarven en -nimfen. Niet-insect arthropoden moeten ook op deze manier worden geconserveerd.
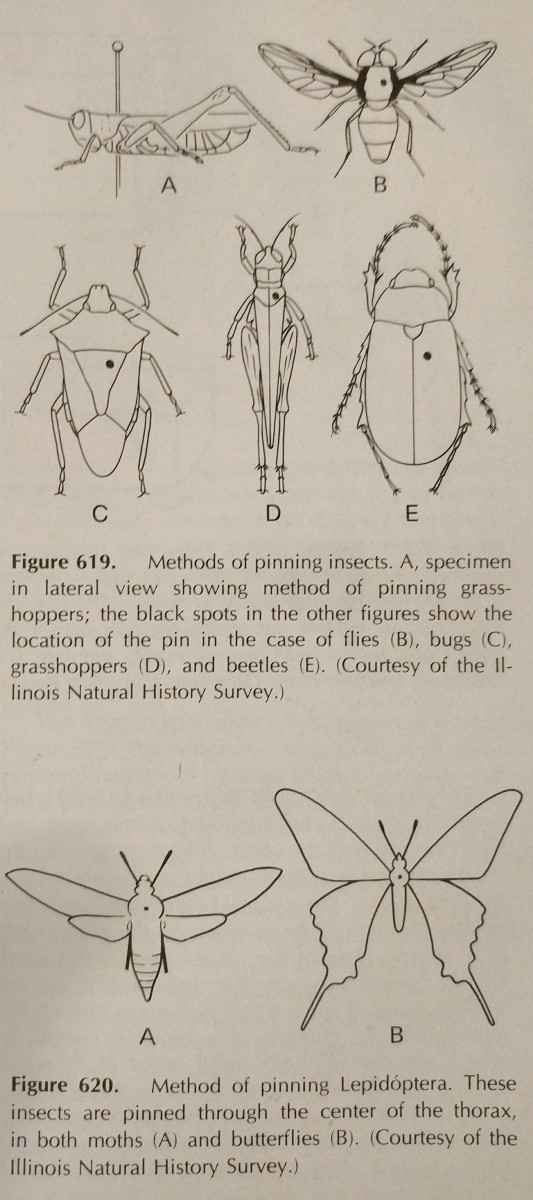
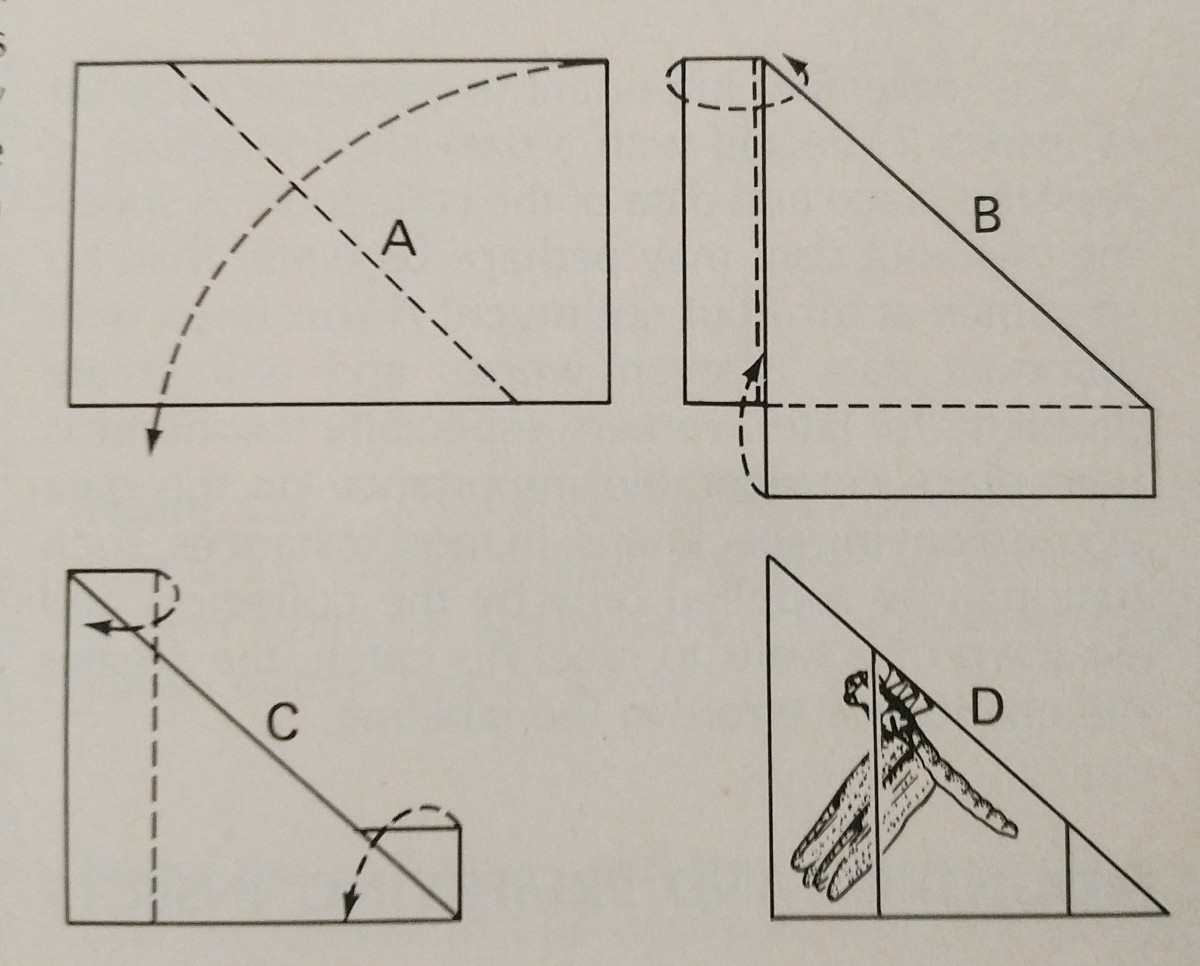
Pinnen: Dit is de gemakkelijkste manier om een hard insect te conserveren. De kleuren vervagen vaak wanneer het insect droogt, maar dit is moeilijk te vermijden. Er moeten speciale insectenspelden worden gebruikt, die langer zijn en niet roesten. Deze zijn verkrijgbaar in de maten 00-7, maar de kleinere kunnen minder goed bruikbaar zijn. Verschillende bestellingen moeten op verschillende plaatsen worden vastgespeld, zoals op de foto. De poten moeten worden uitgestrekt, evenals de vleugels. Vaak hebben bijen hun tong uitgestoken om de identificatie te vergemakkelijken.
Het is het beste als alle soorten in een collectie op dezelfde afstand worden vastgespeld. Ongeveer 25 mm boven de punt is ideaal, en uniforme afstanden kunnen gemakkelijk worden bereikt met behulp van een speldblok, dat is gewoon een blok hout met gaten geboord op verschillende dieptes.
Het verspreiden van een insect is een kwestie van oefening. Het gebruik van een strooibord maakt de taak veel gemakkelijker,
en het hebben van extra spelden en papierstroken is essentieel. Spelden kunnen worden gebruikt om ledematen en vleugels te verplaatsen.
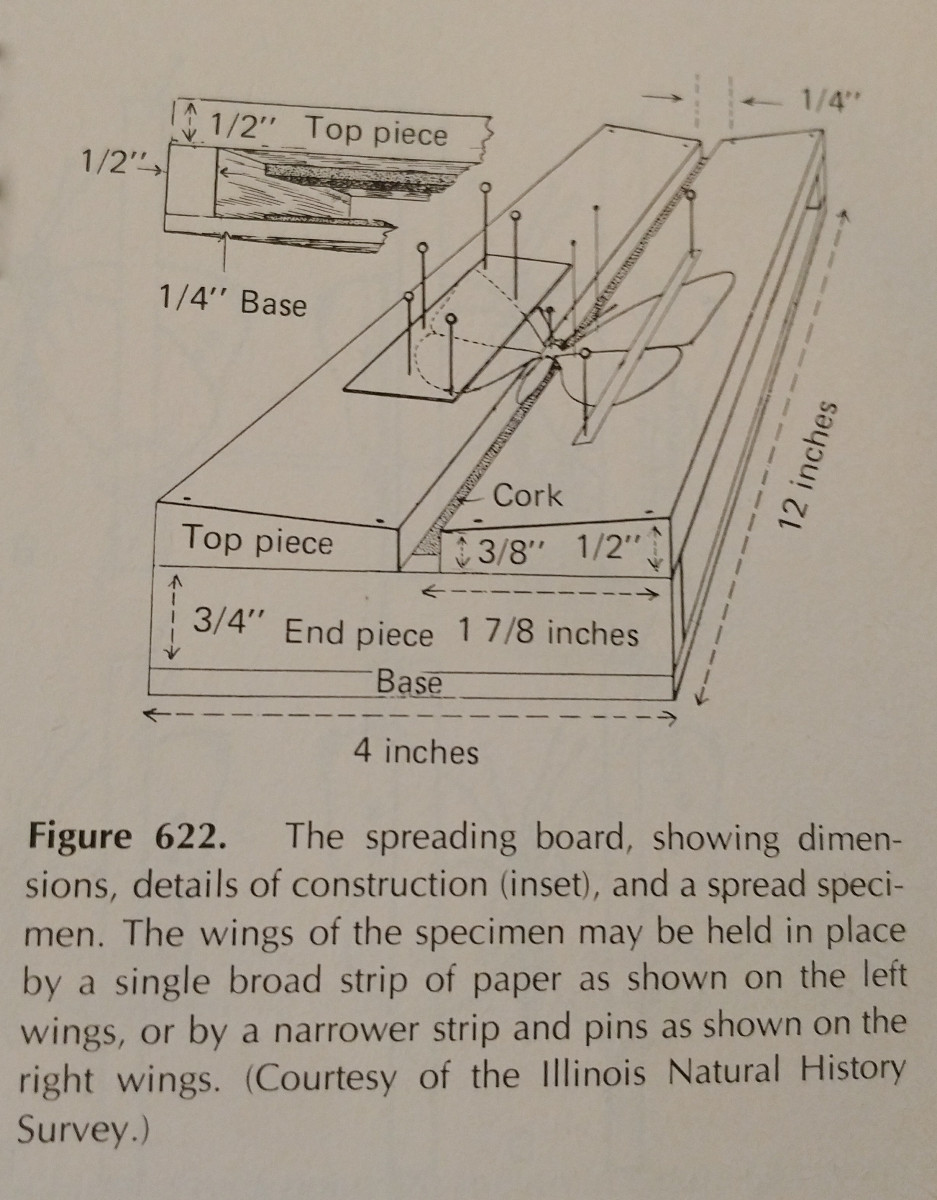
Typisch moet druk worden uitgeoefend op de voorste marginale vleugelader, vooral bij Lepidoptera. De achterrand van de vleugels van een Lepidoptera moet een rechte hoek vormen met het borststuk, en de achtervleugels moeten omhoog staan zodat er geen opening is tussen de vleugels en de voorvleugels, zoals op de afbeelding. Het is  belangrijk om heel voorzichtig te zijn en een tang te gebruiken om de insecten te hanteren. Ze zijn zeer kwetsbaar, en vaak kunnen de schubben en de antenne gemakkelijk worden afgebroken. Papierstroken en spelden kunnen worden gebruikt om de vleugels vast te zetten, en dan blijven ze op hun plaats nadat ze zijn opgedroogd.
belangrijk om heel voorzichtig te zijn en een tang te gebruiken om de insecten te hanteren. Ze zijn zeer kwetsbaar, en vaak kunnen de schubben en de antenne gemakkelijk worden afgebroken. Papierstroken en spelden kunnen worden gebruikt om de vleugels vast te zetten, en dan blijven ze op hun plaats nadat ze zijn opgedroogd.
Kleine insecten vereisen enige vindingrijkheid om te worden gemonteerd, en kunnen worden vastgelijmd op kaartpunten, kleine spelden, of microscopische dia’s. U speldt eenvoudig de kaartpunt vast, doet er een uiterst kleine hoeveelheid lijm op, en lijmt dan het insect vast.
Drogen: Veel vastgespelde insecten kunnen aan de lucht worden gedroogd op een warme, droge plaats. Grotere motten hebben misschien een droogkamer nodig met een of meerdere lampen erin, en bij sommige grote exemplaren moeten misschien zelfs de buikorganen worden verwijderd. Er is geen definitieve tijd die nodig is om een specimen te drogen, maar dit zal met ervaring komen.
Zacht lichaam insecten kunnen worden gevriesdroogd of vacuüm gedroogd en dan vastgepind, om een niet-fragiel, niet-verkleurd specimen te creëren. Normaal gesproken zouden ze verschrompelen, maar deze stap maakt ze droog genoeg om op een speld te blijven.
Typisch wordt een ethylalcoholoplossing gebruikt. Enkele veelgebruikte oplossingen staan hieronder vermeld.
| Hood’s oplossing | |
| 70-80% Ethylalcohol | 95 cm3 |
| Glycerine | 5 cm3 |
| Kahle’s oplossing | |
| 95% Ethylalcohol | 30 cm3 |
| Formaldehyde | 12 cm3 |
| Glazige azijnzuur | 4 cm3 |
| Water | 60 cm3 |
| Alcoholische Bouin’s oplossing | |
| 80% Ethyl Alcohol | 150 cm3 |
| Formaldehyde | 60 cm3 |
| Glazige azijnzuur | 15 cm3 |
| Pitrinezuur | 1g |
Nu we het toch over oplossingen hebben, Ethylacetaat is vaak niet effectief op larven, dus hier zijn dodende middelen die volstaan:
| KAAD mengsel | |
| 95% Ethyl Alcohol | 70-100 cm3 |
| Kerosine (verminderen voor larven met zacht lichaam zoals maden) | 10 cm3 |
| Glazige azijnzuur | 20 cm3 |
| Dioxaan | 10 cm3 |
| XA mengsel | |
| 95% Ethylacetaat | 50 cm3 |
| Xyleen | 50 cm3 |
Beide methodes zouden 1/2 – 4 uur moeten duren. Alle bekende dodingsmiddelen verwijderen kleur, vooral groen, licht en rood.
Typisch moeten geconserveerde specimens een- of tweemaal per jaar worden geïnspecteerd, om na te gaan of er vloeistof is verdampt. Als dat het geval is, moet het worden vervangen.
Montage op Microscoopglaasjes: Er zijn twee soorten microscoopsteunen: permanente en tijdelijke. Ze gebruiken verschillende inbedmiddelen, en bij tijdelijk inbedden worden de preparaten na het inbedden meestal weer in het conserveermiddel teruggeplaatst, waar ze voor onbepaalde tijd kunnen worden bewaard. Permanente preparaten worden eenmalig ingeklikt en kunnen daarna niet meer worden verwijderd; zij kunnen echter geruime tijd, zelfs verscheidene jaren, worden bewaard.
Veel insecten met een zacht lichaam kunnen rechtstreeks in een inbedmedium worden gebracht, maar sommige moeten eerst in een speciale vloeistof worden geklaard. De belangrijkste oplossingen die hiervoor worden gebruikt zijn KOH en Nesbitt’s oplossing. Dit proces houdt vaak in dat het insect enkele uren tot vele dagen moet weken als het koud wordt gedaan, hoewel het sneller kan worden gedaan met behulp van warmte en KOH.
Kleine specimens kunnen worden gemonteerd in een normaal objectglaasje, terwijl grotere een depressie-glaasje nodig hebben of een steun voor het dekglaasje.
De mediums die worden gebruikt voor het tijdelijk inbedden van objectglaasjes zijn water, alcohol, glycerine en glycerine-gelei. Water en alcohol zijn slechts enkele minuten houdbaar voor ze verdampen, dus glycerine wordt over het algemeen gebruikt als preparaten voor langere tijd bestudeerd willen worden.
Dat is het einde van dit bericht en van het conserveringsgedeelte van Borror, Delong, and Triplehorn. De rest van het werk aan deze SOS zal bestaan uit het verzamelen van mijn documenten en dia’s, en het in orde maken van mijn stroomdiagrammen en protocol.
