Wanneer een gas in constante stroming door een vernauwing gaat, b.v. in een opening of klep, ondergaat het gewoonlijk een temperatuursverandering. Dit is gedeeltelijk het gevolg van veranderingen in kinetische energie, maar er is nog een ander deel dat wordt bijgedragen door de niet-idealiteit van het gas. Indien de stroomopwaartse en stroomafwaartse kanalen voldoende groot zijn om de kinetische energie op deze plaatsen te verwaarlozen, worden de stroomopwaartse en stroomneerwaartse temperaturen ver genoeg van de door de vernauwing veroorzaakte verstoring gemeten en is het systeem adiabatisch; het gemeten effect is uitsluitend te wijten aan de niet-idealiteit. Op grond van de eerste wet van de thermodynamica is een dergelijk proces isenthalpisch en het is zinvol de Joule-Thomsoncoëfficiënt te definiëren als:
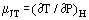
als maat voor de verandering in temperatuur die het gevolg is van een drukdaling over de vernauwing.
Voor de meeste echte gassen die zich rond de omgevingsomstandigheden bevinden, is μ positief – d.w.z. de temperatuur daalt naarmate ze door de vernauwing gaan. Voor waterstof en helium is hij negatief en neemt de temperatuur toe. Bij hogere temperaturen daalt μ voor de meeste gassen en kan zelfs negatief worden, μ kan ook negatief worden door toepassing van druk, zelfs bij omgevingstemperatuur, maar daarvoor is gewoonlijk een druk van meer dan 200 bar nodig.
