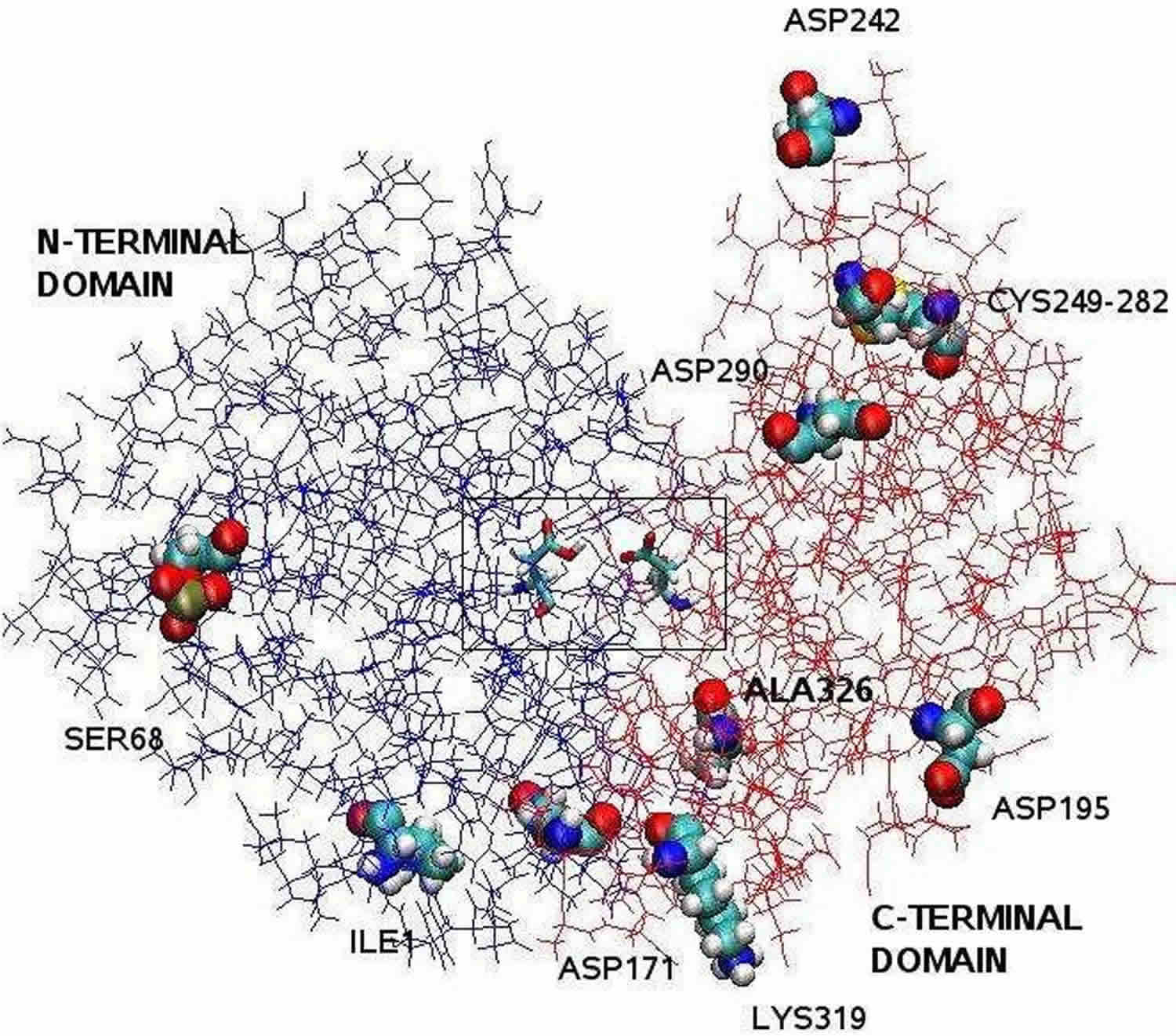
 Vootnoot: De door röntgen-kristallografie opgehelderde pepsinestructuur is tweelobbig met een grote actieve site spleet tussen de twee lobben. Residuen 1 tot 175 vormen het N-terminale domein, terwijl residuen 176 tot 326 het C-terminale domein vormen. Twee aspartaten in het midden van de spleet, Asp32 en Asp215, fungeren als katalytische residuen. De katalytische plaats, bestaande uit Asp32 en Asp215, bevindt zich in het centrum van de spleet. De geladen aminozuurresiduen aan het eiwitoppervlak zijn, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Het gefosforyleerde Ser68 is volledig blootgesteld aan het oplosmiddel en de disulfidebrug tussen Cys 249 en Cys 282 bevindt zich aan het eiwitoppervlak.
Vootnoot: De door röntgen-kristallografie opgehelderde pepsinestructuur is tweelobbig met een grote actieve site spleet tussen de twee lobben. Residuen 1 tot 175 vormen het N-terminale domein, terwijl residuen 176 tot 326 het C-terminale domein vormen. Twee aspartaten in het midden van de spleet, Asp32 en Asp215, fungeren als katalytische residuen. De katalytische plaats, bestaande uit Asp32 en Asp215, bevindt zich in het centrum van de spleet. De geladen aminozuurresiduen aan het eiwitoppervlak zijn, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Het gefosforyleerde Ser68 is volledig blootgesteld aan het oplosmiddel en de disulfidebrug tussen Cys 249 en Cys 282 bevindt zich aan het eiwitoppervlak.
Pepsine heeft, als asparagisch protease, een zeer laag pH optimum. Kondjoyan, Daudin, en Santé-Lhoutellier 9) bestudeerden de verteerbaarheid van myofibrillaire eiwitten en vonden een maximale pepsineactiviteit bij een pH rond 2. Pletschke, Naudé, en Oelofsen 10) bestudeerden de hydrolyse van hemoglobine door varkens- en struisvogelpepersine, en vonden ook een optimale pH van 2,0 voor pepsine-activiteit. Eenmaal geactiveerd bij pH <4,5, worden pepsine-enzym gemakkelijk gedenatureerd bij pH boven 7,0, wat eigenschappen zijn die de eigenschappen van pepsine bepalen 11).
In tegenstelling tot de invloed van pH, wordt het effect van ionensterkte op enzymactiviteit minder vaak besproken. Uit eerder werk van Dale en White 12) bleek dat verhoging van de ionensterkte de reactiesnelheid van geïmmobiliseerd pancreasribonuclease duidelijk verlaagt, terwijl Butré, Wierenga en Gruppen 13) de enzymatische hydrolyse van weiproteïne-isolaat door alcalase en neutrase bestudeerden, en ook vonden dat de aanwezigheid van 0.5M NaCl de snelheid van hydrolyse verminderde.
Twee krachtige in de natuur voorkomende remmers van pepsine zijn bekend: pepstatine, een pentapeptide van Streptomyces, en een unieke eiwitachtige remmer van Ascaris. Pepsine ondergaat ook feedbackremming; een product van de eiwitvertering vertraagt de reactie door pepsine te remmen.14).
Waar wordt pepsine geproduceerd?
De hoofdcellen scheiden pepsine af in de vorm van een inactieve enzymprecursor, pepsinogeen genaamd. Wanneer pepsinogeen in contact komt met zoutzuur uit de pariëtale cellen, breekt het snel af en vormt pepsine 15). Pepsine begint met de vertering van bijna alle soorten voedingseiwitten tot polypeptiden. Dit enzym is het actiefst in een zure omgeving, die wordt gevormd door het zoutzuur in het maagsap.
Figuur 2. Maagcellen (maagklieren)
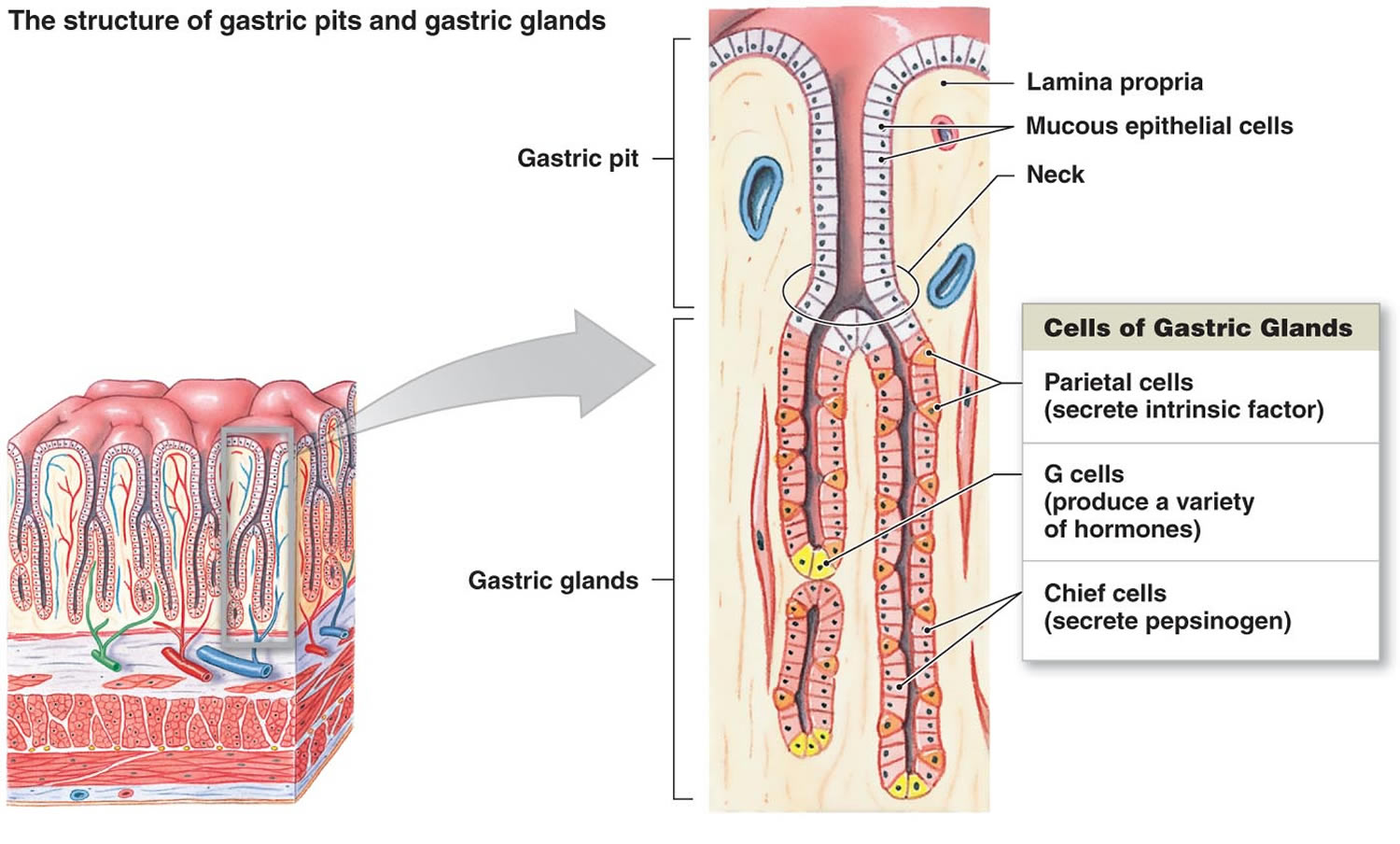 Voetnoot: Bekleding van de maag. Maagklieren omvatten slijmcellen, pariëtale cellen en hoofdcellen. Het maagslijmvlies is bezaaid met maagkuilen die de openingen van de maagklieren zijn.
Voetnoot: Bekleding van de maag. Maagklieren omvatten slijmcellen, pariëtale cellen en hoofdcellen. Het maagslijmvlies is bezaaid met maagkuilen die de openingen van de maagklieren zijn.
Wat doet pepsine?
Pepsine gevormd uit pepsinogeen (inactieve vorm van pepsine) in aanwezigheid van zoutzuur, verteert bijna alle soorten voedingseiwitten in polypeptiden (kleinere eiwitverbindingen). Pepsine verteert eiwitten in sterk maagzuur. Pepsine is geoptimaliseerd voor de vertering van voedsel in het zure milieu van de maag en is de eerste protease die voedseleiwitten tegenkomen in het spijsverteringskanaal. Pepsine is het meest actief in een zure omgeving tussen 37 °C en 42 °C 16).
De specificiteit van pepsine (d.w.z. de splitsingskans van peptidebindingen door pepsine) wordt voornamelijk beïnvloed door de aminozuurresiduen op positie P1 en P1′, terwijl de aminozuurresiduen op andere subsites ook een rol kunnen spelen. In het algemeen splitst pepsine bij voorkeur na fenylalanine, leucine en methionine, terwijl het zelden na histidine, lysine, proline en arginine splitst 17). Aromatische residuen tyrosine, tryptofaan, en fenylalanine zijn favoriet op positie P1′. Proline wordt sterk afgekeurd op de P2, P2′, en P3′ positie, terwijl histidine, lysine, en arginine worden afgekeurd op de P3 positie. De P4 en P4′ posities hebben weinig invloed 18).
Figuur 3. Pepsinefunctie