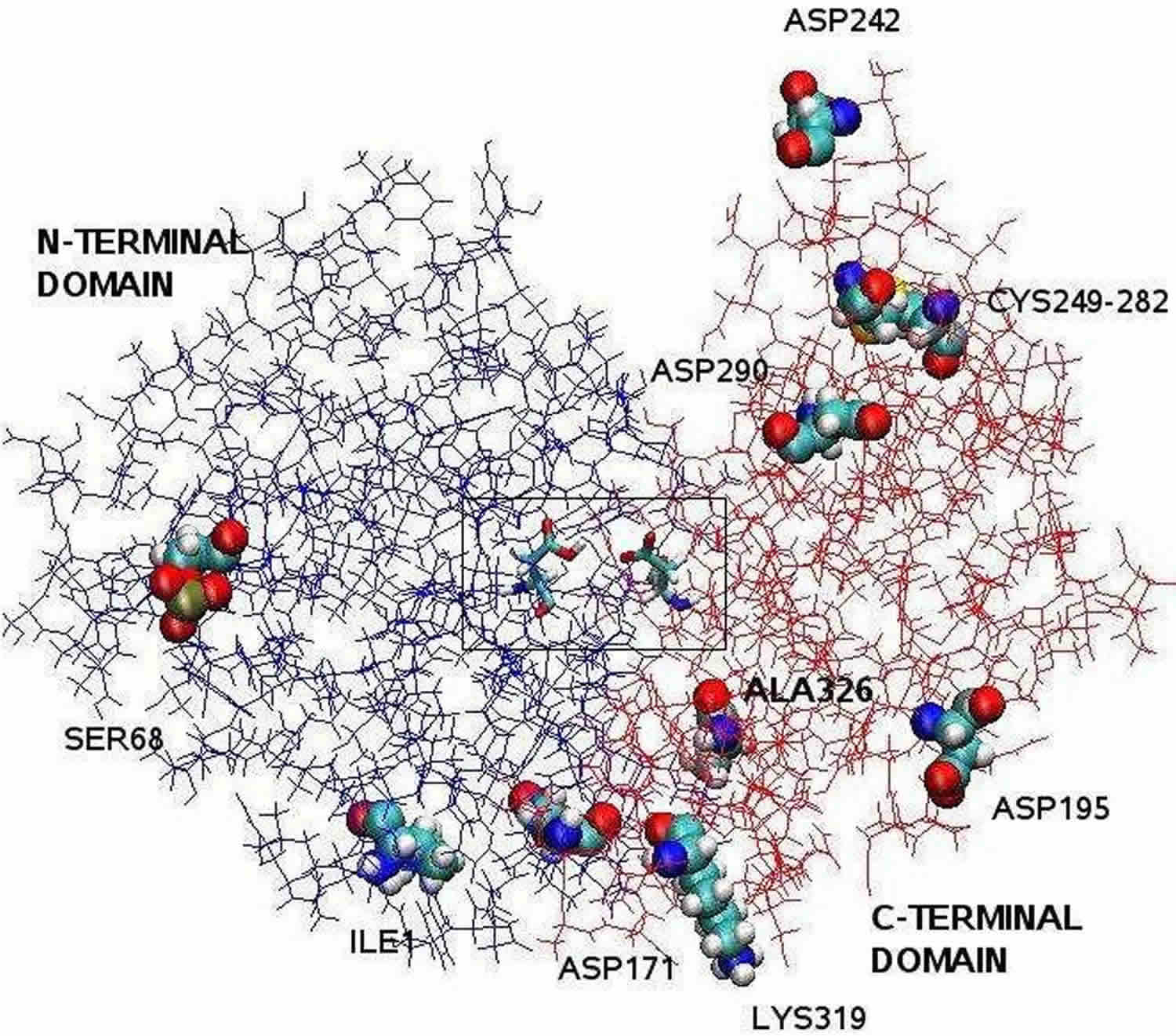
 Nota: La estructura de la pepsina aclarada por cristalografía de rayos X es bilobal con una gran hendidura en el sitio activo entre los dos lóbulos. Los residuos 1 a 175 forman el dominio N-terminal, mientras que los residuos 176 a 326 constituyen el dominio C-terminal. Dos aspartatos en el centro de la hendidura, Asp32 y Asp215, funcionan como residuos catalíticos. El sitio catalítico, formado por Asp32 y Asp215, está situado en el centro de la hendidura. Los residuos de aminoácidos cargados situados en la superficie de la proteína son, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). La Ser68 fosforilada está totalmente expuesta al disolvente y el puente disulfuro entre Cys 249 y Cys 282 se encuentra en la superficie de la proteína.
Nota: La estructura de la pepsina aclarada por cristalografía de rayos X es bilobal con una gran hendidura en el sitio activo entre los dos lóbulos. Los residuos 1 a 175 forman el dominio N-terminal, mientras que los residuos 176 a 326 constituyen el dominio C-terminal. Dos aspartatos en el centro de la hendidura, Asp32 y Asp215, funcionan como residuos catalíticos. El sitio catalítico, formado por Asp32 y Asp215, está situado en el centro de la hendidura. Los residuos de aminoácidos cargados situados en la superficie de la proteína son, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). La Ser68 fosforilada está totalmente expuesta al disolvente y el puente disulfuro entre Cys 249 y Cys 282 se encuentra en la superficie de la proteína.
La pepsina, como proteasa aspártica, tiene un pH óptimo muy bajo. Kondjoyan, Daudin y Santé-Lhoutellier 9) estudiaron la digestibilidad de las proteínas miofibrilares y encontraron la máxima actividad de la pepsina a un pH alrededor de 2. Pletschke, Naudé y Oelofsen 10) estudiaron la hidrólisis de la hemoglobina por la pepsina porcina y de avestruz, y también encontraron un pH óptimo de 2,0 para la actividad de la pepsina. Una vez activada por el pH <4,5, la enzima pepsina se desnaturaliza fácilmente por el pH superior a 7,0, constituyendo propiedades que determinan las características de la pepsina 11).
En contraste con la influencia del pH, el efecto de la fuerza iónica sobre la actividad enzimática se discute con menos frecuencia. Trabajos anteriores de Dale y White 12) mostraron que el aumento de la fuerza iónica disminuye claramente la velocidad de reacción de la ribonucleasa pancreática inmovilizada, mientras que Butré, Wierenga y Gruppen 13) estudiaron la hidrólisis enzimática del aislado de proteína de suero por la alcalasa y la neutrasa, y también encontraron que la presencia de 0.5M de NaCl disminuía la tasa de hidrólisis.
Se conocen dos potentes inhibidores naturales de la pepsina: la pepstatina, un pentapéptido de Streptomyces, y un inhibidor proteico único de Ascaris. La pepsina también sufre una inhibición por retroalimentación; un producto de la digestión de la proteína ralentiza la reacción inhibiendo la pepsina 14).
¿Dónde se produce la pepsina?
Las células principales secretan pepsina en forma de un precursor enzimático inactivo llamado pepsinógeno. Cuando el pepsinógeno entra en contacto con el ácido clorhídrico de las células parietales, se descompone rápidamente, formando pepsina 15). La pepsina inicia la digestión de casi todos los tipos de proteínas alimentarias en polipéptidos. Esta enzima es más activa en un entorno ácido, que es el que proporciona el ácido clorhídrico del jugo gástrico.
Figura 2. Células estomacales (glándulas gástricas)
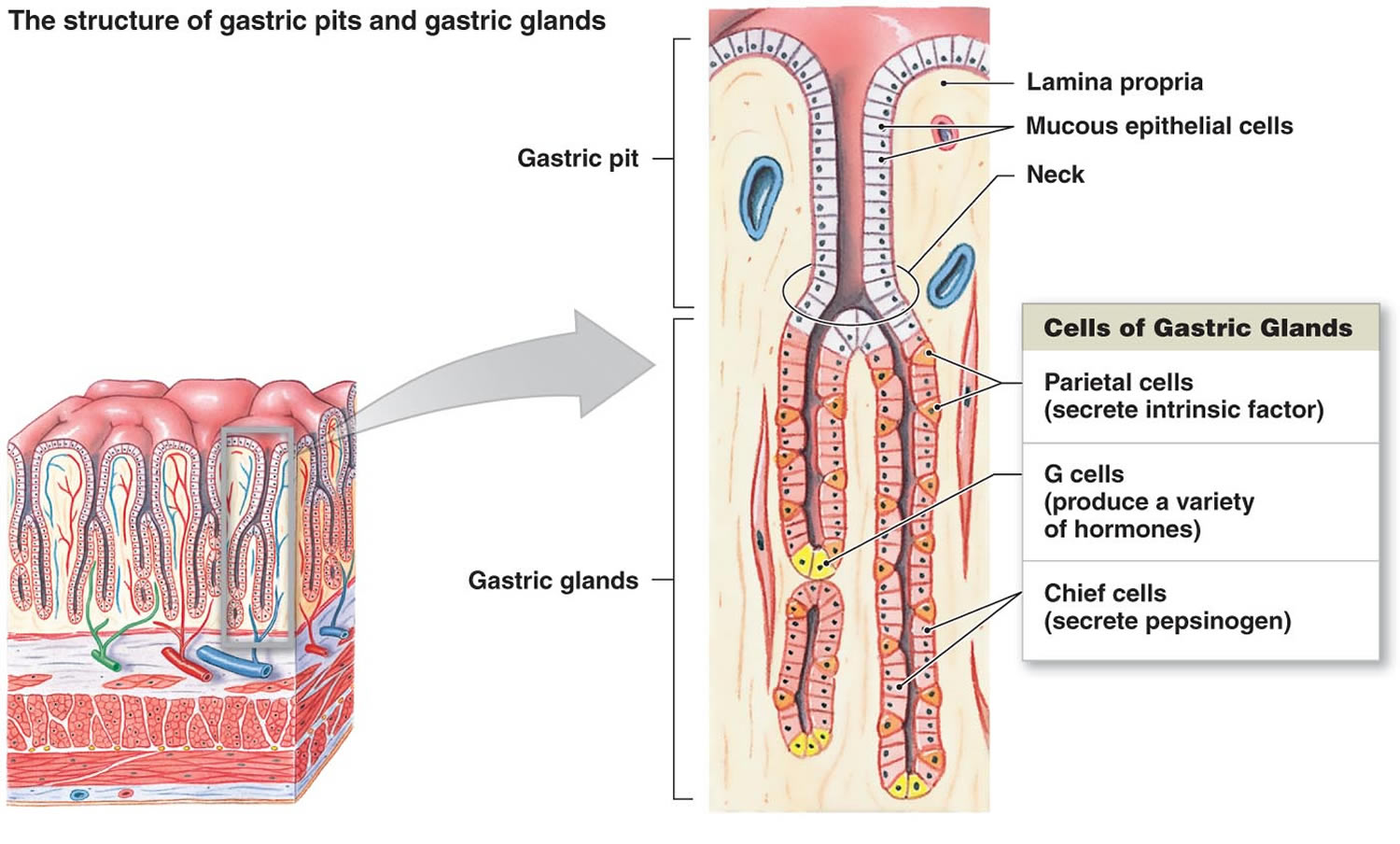 Figura 2: Revestimiento del estómago. Las glándulas gástricas incluyen células mucosas, células parietales y células principales. La mucosa del estómago está salpicada de fosas gástricas que son las aberturas de las glándulas gástricas.
Figura 2: Revestimiento del estómago. Las glándulas gástricas incluyen células mucosas, células parietales y células principales. La mucosa del estómago está salpicada de fosas gástricas que son las aberturas de las glándulas gástricas.
¿Qué hace la pepsina?
La pepsina formada a partir del pepsinógeno (forma inactiva de la pepsina) en presencia del ácido clorhídrico, digiere casi todos los tipos de proteínas alimentarias en polipéptidos (compuestos proteicos más pequeños). La pepsina digiere las proteínas en un ácido estomacal fuerte. La pepsina está optimizada para la digestión de los alimentos en el entorno ácido del estómago y es la primera proteasa que encuentran las proteínas alimentarias en el tracto digestivo. La pepsina es más activa en entornos ácidos entre 37 °C y 42 °C 16).
La especificidad de la pepsina (es decir, la probabilidad de escisión de los enlaces peptídicos por parte de la pepsina) está influenciada principalmente por los residuos de aminoácidos en la posición P1 y P1′, mientras que los residuos de aminoácidos en otros subsitios también pueden desempeñar un papel. En general, la pepsina prefiere escindir después de la fenilalanina, la leucina y la metionina, mientras que rara vez escinde después de la histidina, la lisina, la prolina y la arginina 17). Los residuos aromáticos tirosina, triptófano y fenilalanina son favorecidos en la posición P1′. La prolina está fuertemente desfavorecida en la posición P2, P2′ y P3′, mientras que la histidina, la lisina y la arginina están desfavorecidas en la posición P3. Las posiciones P4 y P4′ tienen poca influencia 18).
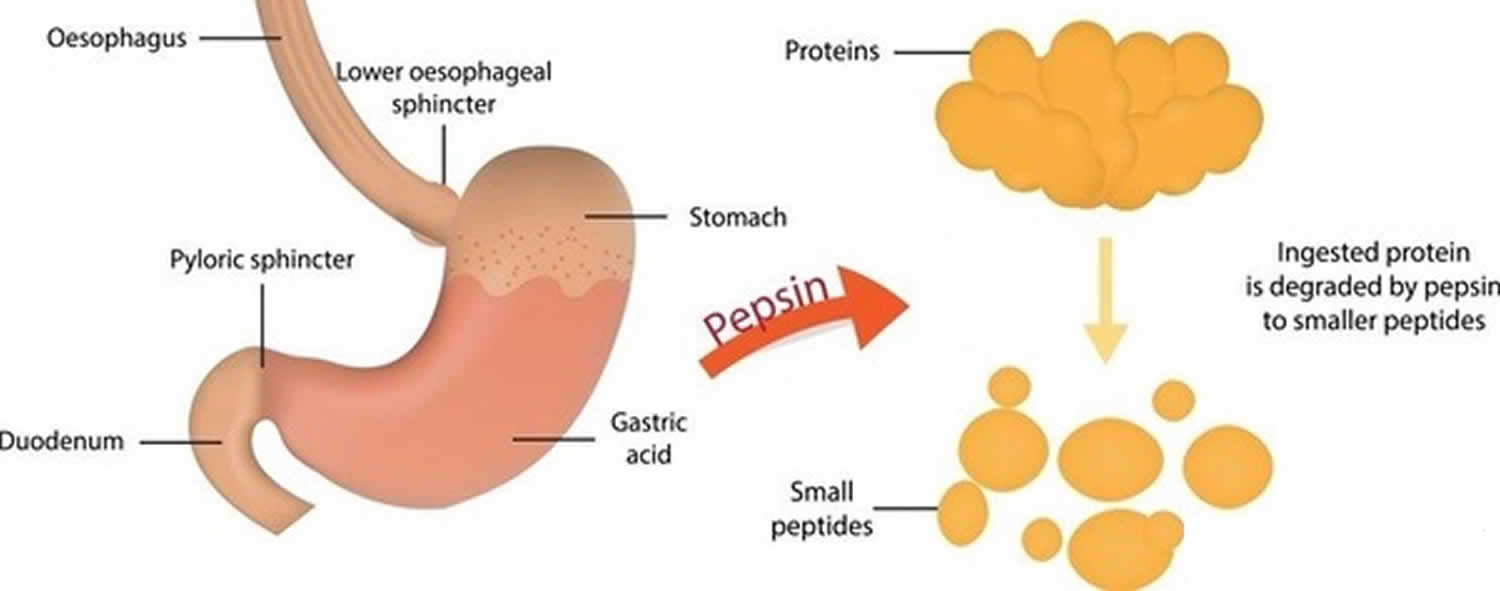
Figura 3. Función de la pepsina